钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为____ ,Co的第四电离能比Fe的第四电离能要小得多,原因是____ 。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1molFe(CO)5含有____ mol配位键,图2中C原子的杂化方式为____ ,形成上述两种化合物的四种元素中电负性最大的是____ (填元素符号)。
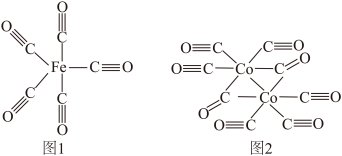
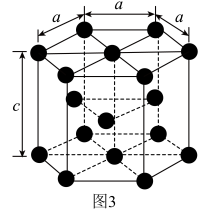
(3)金属钴的堆积方式为六方最密堆积,其配位数是____ ,钴晶体晶胞结构如图3所示,该晶胞中原子个数为____ ;该晶胞的边长为anm,高为cnm,该晶胞的密度为____ (NA表示阿伏加 德罗常数的值,列出代数式)g·cm-3。
(1)Co2+的核外电子排布式为
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1molFe(CO)5含有


(3)金属钴的堆积方式为六方最密堆积,其配位数是
2020·湖南·模拟预测 查看更多[4]
湖南2020年2月高三线上联考(全国I卷)理综化学试题陕西省2020届高三3月线上联考理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编湖南省株洲市第一中学2022-2023学年高二下学期第一次月考化学试题
更新时间:2020-03-25 20:22:40
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】A、B、C、D、E是前四周期原子序数依次增大的元素,A原子核外电子数等于其周期数;B的价电子层中未成对电子有3个;C的最外层电子数为其内层电子数的3倍;D与C同主族;E的价电子排布式为3d104s1。用化学用语回答下列问题:
(1)B原子核外有___ 种不同运动状态的电子,A2C的沸点__ A2D(选填“高于”或“低于”),原因是__ 。
(2)B、C、D形成的简单离子半径由大到小顺序为___ 。
(3)BA3分子的VSEPR模型是__ ,向EDC4溶液中逐滴加入BA3至过量的现象为__ ,该总反应的离子方程式是___ 。
(4)写出B2C分子的一种等电子体__ 。
(1)B原子核外有
(2)B、C、D形成的简单离子半径由大到小顺序为
(3)BA3分子的VSEPR模型是
(4)写出B2C分子的一种等电子体
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(用所对应的元素符号表示)
(1)写出F原子的电子排布式____________ ,F位于周期表____ 区。
(2)A、B、C的第一电离能由小到大的顺序为_____________________ 。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是________________________ 。
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为_______ ,一个晶胞中F原子的数目为__________ 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因____________ 。
(1)写出F原子的电子排布式
(2)A、B、C的第一电离能由小到大的顺序为
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
| 元 素 | M | F | |
| 电能(kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因
您最近一年使用:0次
【推荐3】W、X、Y、Z四种短周期元素的原子序数W>X>Z>Y。X原子的最外层没有p电子,Y原子最外层s电子与p电子数之比为1∶1,W与Z原子核外s电子与p电子数之比均为1∶1。则:
(1)写出各元素的元素符号:W:________ 、X:________ 、Y:________ 、Z:________ 。
(2)四种元素原子半径大小顺序依次为____________________________________ 。
(3)W、X元素最高价氧化物对应水化物的碱性强弱为________________________ (用化学式表示)。
(1)写出各元素的元素符号:W:
(2)四种元素原子半径大小顺序依次为
(3)W、X元素最高价氧化物对应水化物的碱性强弱为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为_______ 。
(2)Ti的四卤化物熔点如下表所示,自TiCl4至TiI4熔点依次升高,原因是_______ 。
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是_______ ;金属离子与氧离子间的作用力为_______ ,Ca2+紧邻的O2-有_______ 个。
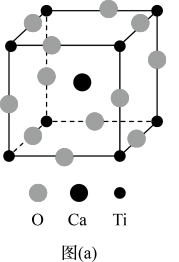
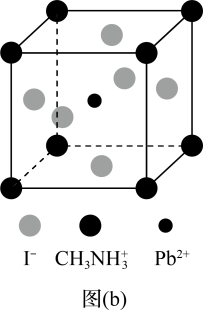
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中_______ 的空间位置相同,有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是_______ ;若晶胞参数为a nm,则晶体密度为_______ g·cm-3(列出计算式)。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如下表所示,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |

(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子
 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】青蒿素是从黄花蒿中提取的一种无色针状晶体,双氢青蒿素是青蒿素的重要衍生物,抗疟疾疗效优于青蒿素,请回答下列问题:

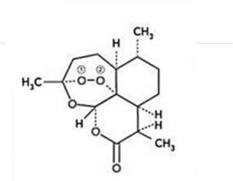
(1)组成青蒿素的三种元素电负性由大到小排序是__________ ,画出基态O原子的价电子排布图__________ 。
(2)一个青蒿素分子中含有_______ 个手性碳原子。
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有: 2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①写出BH4﹣的等电子体_________ (分子、离子各写一种);
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有______ 种共价键;
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是______________ ;
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是_________ ;设晶胞中阴、阳离子为刚性球体且恰好相切,求阴、阳离子的半径比 =
=__________ 由此可知正负离子的半径比是决定离子晶体结构的重要因素,简称几何因素,除此之外影响离子晶体结构的因素还有_________ 、_________ 。


(1)组成青蒿素的三种元素电负性由大到小排序是
(2)一个青蒿素分子中含有
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有: 2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①写出BH4﹣的等电子体
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是
 =
=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为_______________ ,Cr位于元素周期表第四周期____ 族。
(2)Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K___ Cr(填“<”或“>”);
(3)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为______________ 。
(4)Cr的一种配合物结构如图所示:
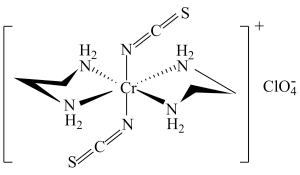
①阴离子C1O4-的空间构型为___________ 形。
②配离子中,中心离子的配位数为________ 。
(5)配体H2NCH2CH2NH2(乙二胺)中碳原子的杂化方式是_____________ ,分子中三种元素电负性从大到小的顺序为________________ 。
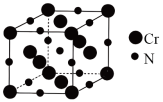
(6)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5.9 g·cm-3,阿伏加 德罗常数的值为6.02×1023,则氮化铬的晶胞边长为_________________ nm(列出计算式).
(1)基态N原子的核外电子排布式为
(2)Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K
(3)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为
(4)Cr的一种配合物结构如图所示:


①阴离子C1O4-的空间构型为
②配离子中,中心离子的配位数为
(5)配体H2NCH2CH2NH2(乙二胺)中碳原子的杂化方式是
(6)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5.9 g·cm-3,阿伏加 德罗常数的值为6.02×1023,则氮化铬的晶胞边长为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】Fe、Co、Ni是三种重要的金属元素。回答下列问题:
(1)Fe、Co、Ni在周期表中的位置为_______ ,基态Fe原子的电子排布式为_______ 。
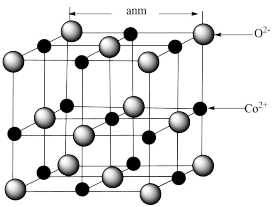
(2)CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为_______ g﹒cm-3:(只列式,不化简)三种元素二价氧化物的晶体类型相同,其熔点由高到低的顺序为_______ 。
(3)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为_______ ,Co(OH)3 (难溶于水)与盐酸反应有黄绿色气体生成,写出反应的离子方程式:_______ 。
(1)Fe、Co、Ni在周期表中的位置为
(2)CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为

(3)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】三硅酸镁在医药上用于制抗酸药,能中和胃酸和保护溃疡面,作用缓慢而持久,发生的反应为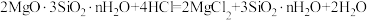 。回答下列问题:
。回答下列问题:
(1)基态氯原子的价层电子轨道表达式为_______ ,基态硅原子中未成对电子数目为_______ 。
(2)Mg和与Mg同周期且相邻的元素原子第一电离能由大到小的顺序为:_______ (填元素符号,下同),H、O、Cl三种元素电负性由小到大的顺序为_______ 。
(3)1070K下用熔融的镁在氩气中还原 可得到多孔的海绵钛,反应的化学方程式为
可得到多孔的海绵钛,反应的化学方程式为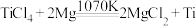 ,金属Mg的熔点为651℃,金属Ti的熔点为1668℃,金属Mg的熔点低于金属Ti的熔点的可能原因是
,金属Mg的熔点为651℃,金属Ti的熔点为1668℃,金属Mg的熔点低于金属Ti的熔点的可能原因是_______ 。
(4)由H、O、Si、Cl四种元素组成的所有微粒中,与 互为等电子体的分子是
互为等电子体的分子是_______ (填化学式,下同),离子是_______ 。
(5)硅化镁是一种窄带隙n型半导体材料,在光电子器件、能源器件、激光、半导体制造等领域具有重要应用前景。硅化镁的晶胞参数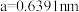 ,属于面心立方晶胞,结构如图所示。
,属于面心立方晶胞,结构如图所示。
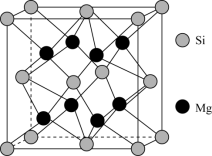
①Si原子的配位数为_______ 。
②晶胞在对角面方向的投影图为_______ (填字母)。
A.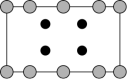 B.
B.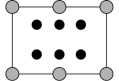 C.
C.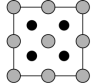 D.
D.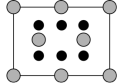
③阿伏加德罗常数的值为NA,该晶体的密度
_______  (列出计算式)。
(列出计算式)。
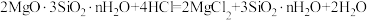 。回答下列问题:
。回答下列问题:(1)基态氯原子的价层电子轨道表达式为
(2)Mg和与Mg同周期且相邻的元素原子第一电离能由大到小的顺序为:
(3)1070K下用熔融的镁在氩气中还原
 可得到多孔的海绵钛,反应的化学方程式为
可得到多孔的海绵钛,反应的化学方程式为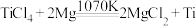 ,金属Mg的熔点为651℃,金属Ti的熔点为1668℃,金属Mg的熔点低于金属Ti的熔点的可能原因是
,金属Mg的熔点为651℃,金属Ti的熔点为1668℃,金属Mg的熔点低于金属Ti的熔点的可能原因是(4)由H、O、Si、Cl四种元素组成的所有微粒中,与
 互为等电子体的分子是
互为等电子体的分子是(5)硅化镁是一种窄带隙n型半导体材料,在光电子器件、能源器件、激光、半导体制造等领域具有重要应用前景。硅化镁的晶胞参数
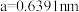 ,属于面心立方晶胞,结构如图所示。
,属于面心立方晶胞,结构如图所示。
①Si原子的配位数为
②晶胞在对角面方向的投影图为
A.
 B.
B. C.
C. D.
D.
③阿伏加德罗常数的值为NA,该晶体的密度

 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】以粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料制取氧化铝的部分工艺流程如图:
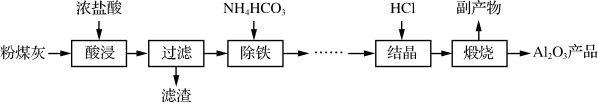
(1)加快“酸浸”步骤的措施有_______ (任写一条)。
(2)滤渣的主要成分是_______ 。
(3)“除铁”时检验溶液中铁元素是否除尽的试剂是_______ (写化学式)。
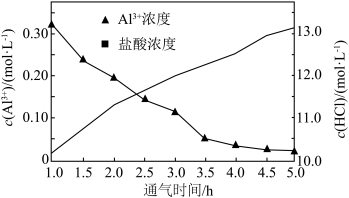
(4)“结晶”是向浓溶液中通入HCl气体,从而获得AlCl3·6H2O晶体的过程,溶液中Al3+和盐酸的浓度随通气时间的变化如图所示。Al3+浓度减小的原因是_______ 。
(5)铝的另一种重要化合物氮化铝的晶胞结构如下图所示:
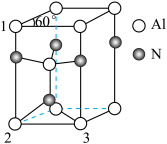
①晶胞中Al原子的电子排布式为_______ 。
②一个该氮化铝晶胞单元中含氮原子数为_______ 。
③设NA表示阿伏加德罗常数,1、2号铝原子核间距为a nm,2、3号铝原子核间距为b nm,求该晶胞的密度:_______ g/cm3(用含a、b、NA的代数式表示)。

(1)加快“酸浸”步骤的措施有
(2)滤渣的主要成分是
(3)“除铁”时检验溶液中铁元素是否除尽的试剂是
(4)“结晶”是向浓溶液中通入HCl气体,从而获得AlCl3·6H2O晶体的过程,溶液中Al3+和盐酸的浓度随通气时间的变化如图所示。Al3+浓度减小的原因是

(5)铝的另一种重要化合物氮化铝的晶胞结构如下图所示:

①晶胞中Al原子的电子排布式为
②一个该氮化铝晶胞单元中含氮原子数为
③设NA表示阿伏加德罗常数,1、2号铝原子核间距为a nm,2、3号铝原子核间距为b nm,求该晶胞的密度:
您最近一年使用:0次



