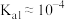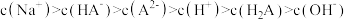测定溶液电导率的变化是定量研究电解质在溶液中反应规律的一种方法,溶液电导率越大其导电能力越强。室温下,用0.100mol•L-1的NH3•H2O滴定10.00mL浓度均为0.100mol•L-1HCl和CH3COOH的混合溶液,所得电导率曲线如图所示。下列说法正确的是( )
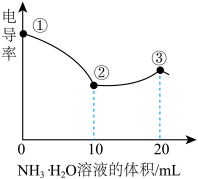

| A.①点溶液:pH最大 |
| B.溶液温度:①高于② |
| C.③点溶液中:c(Cl-)>c(CH3COO-) |
| D.②点溶液中:c(NH4+)+c(NH3•H2O)>c(CH3COOH)+c(CH3COO-) |
2020·陕西咸阳·二模 查看更多[4]
(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(1-7)安徽合肥一六八中学2021-2022学年高三下学第二次调研化学试题广东省广州、深圳市学调联盟2020届高三第二次调研考试化学试题陕西省咸阳市2020届高三下学期第二次模拟考试(网考)(全国II卷)理综化学试题
更新时间:2020-03-25 16:55:10
|
相似题推荐
单选题
|
较难
(0.4)
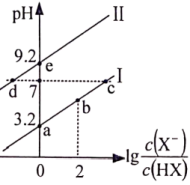
【推荐1】已知常温下HF酸性强于HCN,分别向1L1mol·L-1的HF、HCN溶液中加NaOH固体(忽略温度和溶液体积变化),溶液pH随lg (X表示F或者CN)变化情况如图所示,下列说法错误的是
(X表示F或者CN)变化情况如图所示,下列说法错误的是
 (X表示F或者CN)变化情况如图所示,下列说法错误的是
(X表示F或者CN)变化情况如图所示,下列说法错误的是
| A.lgKa(HF)-lgKa(HCN)=6 | B.溶液中对应的c(X-):d点>c点 |
| C.b点溶液的pH=5.2 | D.e点溶液中c(Na+)>c(HCN)>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是
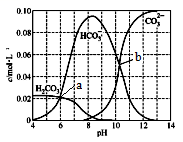

| A.b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-) |
| B.随pH增大,c(CO32-)/c(HCO3-)数值先减小后增大 |
| C.25℃时,碳酸的第一步电离常数Ka1=10-6 |
| D.溶液呈中性时:c(HCO3- )>c(Cl-)>c(CO32-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】已知电离平衡常数:H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,常温下向含1molNa2CO3的溶液中缓缓通入amolSO2,忽略溶液体积变化,下列说法正确的是
A.过程中c(HCO )+c(CO )+c(CO )+c(H2CO3)保持不变 )+c(H2CO3)保持不变 |
| B.a=1时,溶液显酸性 |
C.a=2时,c(Na+)+c(H+)=c(HSO )+2c(SO )+2c(SO )+c(OH-) )+c(OH-) |
D.当溶液pH为7时,c(SO )<c(HSO )<c(HSO ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】在15mL0.lmol·L-1KOH溶液中逐滴加入0.2mol·L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是


| A.在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 |
| B.在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+) |
| C.在D点:c(HCOO-)+c(HCOOH)>2c(K+) |
| D.B→C段:水的电离程度先增大后减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】常温下,用0.1000mol·L-1的盐酸滴定 20.00 mL 未知浓度的氨水,滴定曲线如图所示,滴加 20. 00 mL 盐酸时所得溶液中 c (Cl-)= c( NH4+)+c(NH3·H2O)+c( NH3)。下列说法错误的是


| A.点①溶液中 c( NH4+)+c ( NH3·H2O)+c(NH3)=2c (Cl-) |
| B.点②溶液中 c( NH4+)=c (Cl-) |
| C.点③溶液中 c (Cl-)> c( H+)>c (NH4+)>c(OH-) |
| D.该氨水的浓度为 0.1000mol·L-1 |
您最近一年使用:0次

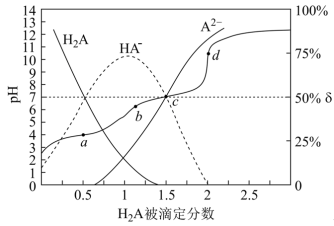
 溶液滴定同浓度的
溶液滴定同浓度的 溶液,
溶液, 、
、 及微粒分布分数
及微粒分布分数 [
[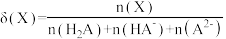 ,X表示
,X表示 或
或 ]的关系如图所示:
]的关系如图所示: