1 . 金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。
(1)镓(Ga)的原子结构示意图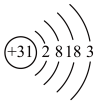 ,镓元素在周期表中的位置是
,镓元素在周期表中的位置是_______________ 。
(2)GaN是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产GaN的工艺如图:

①“热转化”时Ga转化为GaN的化学方程式是_______________ 。
②“酸浸”操作目的是_______________ 。
③某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
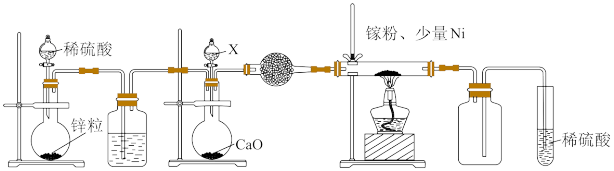
仪器X中的试剂是_______________ 。加热前需先通入一段时间的H2,原因是_______________ 。
(3)As与N同主族,GaAs也是一种重要的半导体材料。
①下列事实不能用元素周期律解释的是_______________ (填字母)。
a.碱性:Ga(OH)3>Al(OH)3
b.非金属性:As>Ga
c.酸性:H3AsO4>H3AsO3
②用原子结构理论解推测,GaAs中As元素化合价为_______________ 价。
③废弃含GaAs的半导体材料可以用浓硝酸溶解,生成H3AsO4和Ga3+,写出该反应的化学方程式_______________ 。
(1)镓(Ga)的原子结构示意图
 ,镓元素在周期表中的位置是
,镓元素在周期表中的位置是(2)GaN是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产GaN的工艺如图:

①“热转化”时Ga转化为GaN的化学方程式是
②“酸浸”操作目的是
③某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:

仪器X中的试剂是
(3)As与N同主族,GaAs也是一种重要的半导体材料。
①下列事实不能用元素周期律解释的是
a.碱性:Ga(OH)3>Al(OH)3
b.非金属性:As>Ga
c.酸性:H3AsO4>H3AsO3
②用原子结构理论解推测,GaAs中As元素化合价为
③废弃含GaAs的半导体材料可以用浓硝酸溶解,生成H3AsO4和Ga3+,写出该反应的化学方程式
您最近半年使用:0次
名校
解题方法
2 . 金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是__________________ 。
(2)GaAs 是一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
①下列事实不能用元素周期律解释的是___________ (填字母)。
a. 碱性:Ga (OH)3> Al (OH)3 b. 非金属性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因_________________ 。
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4和 Ga3+,写出该反应的化学方程式_________ 。
(3)工业上获取镓的方法之一是从闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研单位设计下述流程提取镓,已知:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在。
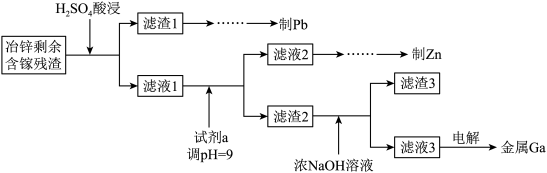
①试剂 a 是_______________ 。
②写出电解制镓时的阴极电极反应式__________________ 。
(1)铝在元素周期表中的位置是
(2)GaAs 是一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
①下列事实不能用元素周期律解释的是
a. 碱性:Ga (OH)3> Al (OH)3 b. 非金属性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4和 Ga3+,写出该反应的化学方程式
(3)工业上获取镓的方法之一是从闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研单位设计下述流程提取镓,已知:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在。

①试剂 a 是
②写出电解制镓时的阴极电极反应式
您最近半年使用:0次
2020-06-28更新
|
262次组卷
|
2卷引用:北京市海淀区中央民族大学附属中学2020届高三考前热身化学试题
解题方法
3 . 锌是一种常用金属,镓(Ga)的化合物氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga的原子结构示意图为___________________ 。
(2)GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式__________________________ 。
(3)下列有关镓和镓的化合物的说法正确的是____ 。
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
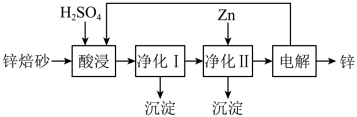
已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为___________________ 。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________ 。
(6)净化II中加入Zn的目的是___________________ 。
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________ 。已知:Ksp[Fe(OH)3] =8.0× 10-38;lg5 = 0.7
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga的原子结构示意图为
(2)GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式
(3)下列有关镓和镓的化合物的说法正确的是____ 。
| A.常温下,Ga可与水剧烈反应放出氢气 |
| B.一定条件下,Ga可溶于盐酸和氢氧化钠 |
| C.一定条件下,Ga2O3可与NaOH反应生成盐 |
| D.Ga2O3可由Ga(OH)3受热分解得到 |
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:

已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是
(6)净化II中加入Zn的目的是
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为
您最近半年使用:0次
解题方法
4 . I.钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
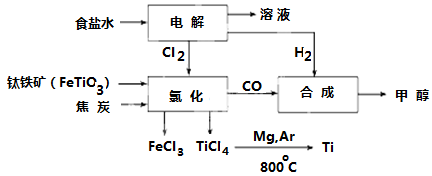
请回答下列问题:
(1)Fe位于元素周期表中第________ 周期,第________ 族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式______________ 。
Ⅱ.A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
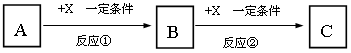
试回答:
(1)若X是强氧化性单质,则A不可能是________________ 。
A.S B.N2 C.Na D.Mg E.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____________ ;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)____________ 。
(3)A还可以是氨气,氨气分子的空间构型是____________________ 。

请回答下列问题:
(1)Fe位于元素周期表中第
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式
Ⅱ.A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。

试回答:
(1)若X是强氧化性单质,则A不可能是
A.S B.N2 C.Na D.Mg E.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为
(3)A还可以是氨气,氨气分子的空间构型是
您最近半年使用:0次
解题方法
5 . 欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。
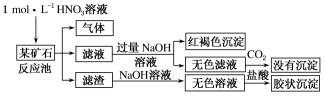
(1)Si在周期表中的位置是____________________ 。
(2)下列说法正确的是______________ 。
a.酸性:H2CO3>H2SiO3b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4d.离子半径:O2-<Al3+
(3)该矿石的组成是_____ ,滤渣和NaOH溶液反应的离子方程式是______________ 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式________________________________ 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,用化学方程式解释该方法的目的:____________________ ;若按以上方案:NO与O2循环通入反应池处理该矿石2.36103kg,得到滤渣1.2103kg,理论上至少需要1 mol L-1HNO3的体积为_____ L。

(1)Si在周期表中的位置是
(2)下列说法正确的是
a.酸性:H2CO3>H2SiO3b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4d.离子半径:O2-<Al3+
(3)该矿石的组成是
(4)该矿石和1 mol L-1HNO3反应的离子方程式
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,用化学方程式解释该方法的目的:
您最近半年使用:0次



