名校
1 . 阅读表中短周期主族元素的相关信息,用化学用语回答下列问题:
(1)E原子的结构示意图___________ ,B离子的电子式___________ ,D最高价氧化物的化学式___________ 。
(2)X的化学式为___________ ,其中含有的化学键种类有___________ 。
(3)A、B两种元素的简单离子的半径大小为___________ (用离子表示)。
(4)A、B两元素组成的化合物 属于
属于___________ 。
A.离子化合物 B.共价化合物
(5)D的单质与水反应的化学方程式为___________ 。
(6)列举一个事实说明D的非金属比E强___________ 。
(7)已知固体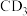 在178℃时升华。再列举一个方法判断其为共价化合物还是离子化合物
在178℃时升华。再列举一个方法判断其为共价化合物还是离子化合物___________ ,因而其为___________ 化合物。
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的3倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
(2)X的化学式为
(3)A、B两种元素的简单离子的半径大小为
(4)A、B两元素组成的化合物
 属于
属于A.离子化合物 B.共价化合物
(5)D的单质与水反应的化学方程式为
(6)列举一个事实说明D的非金属比E强
(7)已知固体
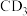 在178℃时升华。再列举一个方法判断其为共价化合物还是离子化合物
在178℃时升华。再列举一个方法判断其为共价化合物还是离子化合物
您最近半年使用:0次
2 . 下表为八种短周期主族元素的部分性质(已知铍的原子半径为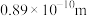 ):
):
(1)元素Z在元素周期表中的位置为___________ ,元素Y为___________ (填元素符号)。
(2)写出Q与J两种元素最高价氧化物对应的水化物之间反应的离子方程式:___________ 。
(3)R与T相比,非金属性较强的是___________ (填元素符号),下列事实能证明这一结论的是___________ (填标号)。
a.常温下T的单质呈固态,R的单质呈气态
b.稳定性: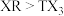
c.最高价氧化物对应水化物的酸性:
(4)J与Q相比,金属性较强的是___________ (填元素符号),能证明这一结论的依据是___________ 。
(5)根据表中数据推测,M的原子半径的最小范围是___________ 。
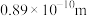 ):
):| 元素代号 | X | Y | Z | M | R | J | Q | T |
原子半径 | 0.74 | 0.75 | r | 0.99 | 1.86 | 1.43 | 1.10 | |
| 主要化合价 |  |  、 、 |  、 、 | 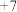 、 、 |  |  |  、 、 | |
| 其他 | 原子核内无中子 | 重要的半导体材料 | 有两种氧化物 |
(2)写出Q与J两种元素最高价氧化物对应的水化物之间反应的离子方程式:
(3)R与T相比,非金属性较强的是
a.常温下T的单质呈固态,R的单质呈气态
b.稳定性:
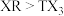
c.最高价氧化物对应水化物的酸性:

(4)J与Q相比,金属性较强的是
(5)根据表中数据推测,M的原子半径的最小范围是
您最近半年使用:0次
解题方法
3 . 有以下6种元素,其中R、W、X、Y、M是原子序数依次增大的五种短周期元素,R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2.工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与X是同一主族的元素,且在元素周期表中与X相邻。Q是第4周期第Ⅷ族元素,它的一种复杂的化合物是具有磁性的黑色晶体。
(1)若R的一种原子中质子数和中子数相等,则R的原子组成符号为___________ ;R2Y、R2X都属于___________ (填“离子”或“共价”)化合物。W在元素周期表中的位置___________ 。
(2)M是生活中常见的一种元素,它能与很多元素形成化合物。
①用电子式表示RM的形成过程___________ 。
②如图所示,将M单质水溶液滴入试管中。试管中的实验现象为___________ 。___________ 。
③MX2是一种高效消毒剂,工业上用其处理中性废水中的锰,使 转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为
转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为___________ 。
(3)元素硒(Se)的原子结构示意图为
根据元素周期律,下列推断正确的是___________ (填字母序号)
a.Se位于第4周期、与Y同主族 b.Se的最低负化合价为-2价
c.SeO2具有还原性 d.H2Se的还原性比H2Y强
e.H2SeO3的酸性强于H2SO4 f.SeO2在一定条件下可与NaOH溶液反应
(4)下列事实能判断元素金属性强弱的是___________ (填字母)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(1)若R的一种原子中质子数和中子数相等,则R的原子组成符号为
(2)M是生活中常见的一种元素,它能与很多元素形成化合物。
①用电子式表示RM的形成过程
②如图所示,将M单质水溶液滴入试管中。试管中的实验现象为

③MX2是一种高效消毒剂,工业上用其处理中性废水中的锰,使
 转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为
转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为(3)元素硒(Se)的原子结构示意图为

根据元素周期律,下列推断正确的是
a.Se位于第4周期、与Y同主族 b.Se的最低负化合价为-2价
c.SeO2具有还原性 d.H2Se的还原性比H2Y强
e.H2SeO3的酸性强于H2SO4 f.SeO2在一定条件下可与NaOH溶液反应
(4)下列事实能判断元素金属性强弱的是
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
您最近半年使用:0次
4 . 已知短周期元素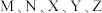 分布在三个周期,
分布在三个周期, 最外层电子数相同,
最外层电子数相同, 原子序数大于
原子序数大于 ,其中
,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中
单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中 的最高价氧化物对应水化物的碱性最强。回答下列问题:
的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1) 在元素周期表中的位置是
在元素周期表中的位置是___________ , 元素的离子结构示意图:
元素的离子结构示意图:___________ ,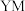 的电子式:
的电子式:___________ 。
(2) 的简单氢化物熔、沸点更高的是
的简单氢化物熔、沸点更高的是___________ (填化学式),原因是___________ 。
(3)在 与
与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:___________ 。
(4)镓 的化合物氮化镓(
的化合物氮化镓(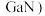 和砷化镓(
和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着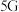 技术的发展,它们的商用价值进入“快车道”。
技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是___________ 。(填字母)
a. 位于元素周期表第四周期第ⅣA族
位于元素周期表第四周期第ⅣA族
b. 为门捷列夫预言的“类铝”
为门捷列夫预言的“类铝”
c. 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含 的半导体材料可以用浓硝酸溶解,放出
的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
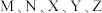 分布在三个周期,
分布在三个周期, 最外层电子数相同,
最外层电子数相同, 原子序数大于
原子序数大于 ,其中
,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中
单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中 的最高价氧化物对应水化物的碱性最强。回答下列问题:
的最高价氧化物对应水化物的碱性最强。回答下列问题:(1)
 在元素周期表中的位置是
在元素周期表中的位置是 元素的离子结构示意图:
元素的离子结构示意图: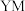 的电子式:
的电子式:(2)
 的简单氢化物熔、沸点更高的是
的简单氢化物熔、沸点更高的是(3)在
 与
与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓
 的化合物氮化镓(
的化合物氮化镓(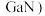 和砷化镓(
和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着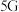 技术的发展,它们的商用价值进入“快车道”。
技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a.
 位于元素周期表第四周期第ⅣA族
位于元素周期表第四周期第ⅣA族b.
 为门捷列夫预言的“类铝”
为门捷列夫预言的“类铝”c.
 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强d.酸性:

②废弃的含
 的半导体材料可以用浓硝酸溶解,放出
的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为
您最近半年使用:0次
5 . 短周期元素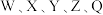 的原子序数依次增大,
的原子序数依次增大, 处于同一主族。
处于同一主族。 的一种同位素在考古研究中用于测定一些文物的年代,
的一种同位素在考古研究中用于测定一些文物的年代, 原子的最外层电子数是内层电子总数的3倍,
原子的最外层电子数是内层电子总数的3倍, 在同周期元素形成的简单离子中半径最小,
在同周期元素形成的简单离子中半径最小, 与
与 能形成
能形成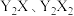 型化合物。
型化合物。
请回答下列问题:
(1) 在元素周期表中的位置为
在元素周期表中的位置为___________ ,W与元素周期表中原子半径最小的原子形成的10电子分子的空间结构为___________ 。
(2) 的原子半径由小到大的顺序是
的原子半径由小到大的顺序是___________ (填元素符号)。
(3) 的最高价氧化物对应的水化物之间反应的离子方程式为
的最高价氧化物对应的水化物之间反应的离子方程式为___________ ; 与
与 的最高价氧化物对应的水化物反应的离子方程式为
的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(4) 与
与 可形成化合物
可形成化合物 ,用电子表示
,用电子表示 的形成过程:
的形成过程:___________ 。
(5) 中的化学键类型为
中的化学键类型为___________ (填“离子键”“极性键”或“非极性键”), 与
与 的最高价氧化物反应常用于呼吸面具,该反应的化学方程式为
的最高价氧化物反应常用于呼吸面具,该反应的化学方程式为___________ 。
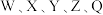 的原子序数依次增大,
的原子序数依次增大, 处于同一主族。
处于同一主族。 的一种同位素在考古研究中用于测定一些文物的年代,
的一种同位素在考古研究中用于测定一些文物的年代, 原子的最外层电子数是内层电子总数的3倍,
原子的最外层电子数是内层电子总数的3倍, 在同周期元素形成的简单离子中半径最小,
在同周期元素形成的简单离子中半径最小, 与
与 能形成
能形成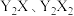 型化合物。
型化合物。请回答下列问题:
(1)
 在元素周期表中的位置为
在元素周期表中的位置为(2)
 的原子半径由小到大的顺序是
的原子半径由小到大的顺序是(3)
 的最高价氧化物对应的水化物之间反应的离子方程式为
的最高价氧化物对应的水化物之间反应的离子方程式为 与
与 的最高价氧化物对应的水化物反应的离子方程式为
的最高价氧化物对应的水化物反应的离子方程式为(4)
 与
与 可形成化合物
可形成化合物 ,用电子表示
,用电子表示 的形成过程:
的形成过程:(5)
 中的化学键类型为
中的化学键类型为 与
与 的最高价氧化物反应常用于呼吸面具,该反应的化学方程式为
的最高价氧化物反应常用于呼吸面具,该反应的化学方程式为
您最近半年使用:0次
名校
6 . 已知A、B、C、D、E、F、G、H是原子序数依次增大的短周期主族元素,已知A的某种原子核内没有中子,A和D,C和G分别为同一主族元素,B原子的最外层电子数比次外层多3,F的最高价氧化物的水化物既可以和强酸反应也可以和强碱溶液反应,G的单质常出现在火山口。
(1)C在元素周期表中的位置是_______ 。
(2)C、D分别形成的简单离子中,半径较大的是______ (填离子符号)。
(3)G和H的最高价氧化物的水化物酸性较强的是______ (填化学式)。
(4)由A、C、D形成的化合物中化学键的类型为_______ ,C、D形成摩尔质量为 的化合物的电子式为
的化合物的电子式为______ ,由A、B形成 化合物的结构式为
化合物的结构式为______ 。
(5)甲烷可与 组成燃料电池,写出用KOH溶液作电解质溶液时正极的电极反应式
组成燃料电池,写出用KOH溶液作电解质溶液时正极的电极反应式_______ 。
(6)D、F的最高价氧化物的水化物相互反应的离子方程式为_______ 。
(7)可用湿润的______ 试纸检验H对应单质,涉及反应的离子方程式为_______ 。
(8)由B、H形成的化合物分子中,B和H原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物,写出反应的化学方程式:________ 。
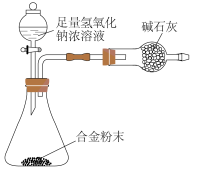
(9)E与F形成的合金是重要的工业材料。某同学仅使用天平和下图所示的装置,粗略测定某些数据即可求出该合金中E元素的含量。(装置中因空气质量引起的误差忽略不计)实验需要测定三个物理量:合金的质量m,反应前装置和药品的总质量a以及反应后装置和药品的总质量b,合金中E元素的质量分数是______ (用含m、a、b的式子表示)。
(1)C在元素周期表中的位置是
(2)C、D分别形成的简单离子中,半径较大的是
(3)G和H的最高价氧化物的水化物酸性较强的是
(4)由A、C、D形成的化合物中化学键的类型为
 的化合物的电子式为
的化合物的电子式为 化合物的结构式为
化合物的结构式为(5)甲烷可与
 组成燃料电池,写出用KOH溶液作电解质溶液时正极的电极反应式
组成燃料电池,写出用KOH溶液作电解质溶液时正极的电极反应式(6)D、F的最高价氧化物的水化物相互反应的离子方程式为
(7)可用湿润的
(8)由B、H形成的化合物分子中,B和H原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物,写出反应的化学方程式:
(9)E与F形成的合金是重要的工业材料。某同学仅使用天平和下图所示的装置,粗略测定某些数据即可求出该合金中E元素的含量。(装置中因空气质量引起的误差忽略不计)实验需要测定三个物理量:合金的质量m,反应前装置和药品的总质量a以及反应后装置和药品的总质量b,合金中E元素的质量分数是
您最近半年使用:0次
2024-04-23更新
|
104次组卷
|
2卷引用:福建省厦门双十中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
7 . 现有部分元素的性质与原子(或分子)结构如下表(T、X、Y、Z都为前20号元素),请回答:
(1)画出元素T的二价阴离子的结构示意图______
(2)上述元素中,非金属性最强的元素在元素周期表中的位置______ ;表中T、X、Y元素的简单氢化物的稳定性由强到弱的顺序为______ (用化学式表示)。
(3)写出X单质与Z的最高价氧化物对应的水化物反应的化学方程式______
(4)镓(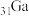 )的化合物砷化镓(GaAs)具有耐高温、耐高电压等特性,可作为第三代半导体材料。废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
)的化合物砷化镓(GaAs)具有耐高温、耐高电压等特性,可作为第三代半导体材料。废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 。写出该反应的化学方程式
。写出该反应的化学方程式______ 。
元素编号 | 元素性质与原子(或分子)结构 |
T | 其二价阴离子核外电子数为18 |
X | 第三周期非金属性最强的元素 |
Y | L层比K层多5个电子 |
Z | 位于第4周期,内层电子数是最外层电子数的9倍 |
(2)上述元素中,非金属性最强的元素在元素周期表中的位置
(3)写出X单质与Z的最高价氧化物对应的水化物反应的化学方程式
(4)镓(
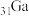 )的化合物砷化镓(GaAs)具有耐高温、耐高电压等特性,可作为第三代半导体材料。废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
)的化合物砷化镓(GaAs)具有耐高温、耐高电压等特性,可作为第三代半导体材料。废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 。写出该反应的化学方程式
。写出该反应的化学方程式
您最近半年使用:0次
名校
解题方法
8 . 某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)反应最剧烈的烧杯中金属是_______(填字母序号);
(2)实验中发现其中两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法_______ (填字母序号)。
A.把烧杯中的冷水换成热水
B.把烧杯中的冷水换成盐酸
C.把烧杯中的冷水换成浓硝酸
(3)甲同学想从下列药品中选择最佳组合,比较Na、Mg、Al的金属性强弱。可供选择的药品有:①NH3·H2O、②NaOH溶液、③Al2(SO4)3溶液、④MgCl2溶液、⑤Na2CO3溶液、⑥NaCl溶液。你认为他所选的药品是_______ (填序号)﹔写出实验过程中Al3+与碱溶液的反应涉及的离子方程式:_______ 、_______ 。
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题,实验装置如图:(已知酸性强弱:亚硫酸>碳酸)_______ ﹔装置E中酸性高锰酸钾溶液的作用是_______ 。
(5)试管F中装有_______ 溶液;其中发生反应的离子方程式为:_______ 。
(6)能否由此得出硫、碳、硅三种元素非金属性的强弱,并说明理由:_______ 。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)反应最剧烈的烧杯中金属是_______(填字母序号);
| A.钠 | B.镁 | C.铝 | D.钾 |
(2)实验中发现其中两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法
A.把烧杯中的冷水换成热水
B.把烧杯中的冷水换成盐酸
C.把烧杯中的冷水换成浓硝酸
(3)甲同学想从下列药品中选择最佳组合,比较Na、Mg、Al的金属性强弱。可供选择的药品有:①NH3·H2O、②NaOH溶液、③Al2(SO4)3溶液、④MgCl2溶液、⑤Na2CO3溶液、⑥NaCl溶液。你认为他所选的药品是
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题,实验装置如图:(已知酸性强弱:亚硫酸>碳酸)
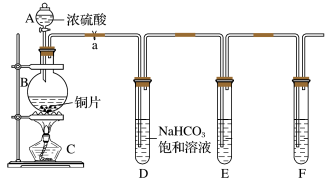
(5)试管F中装有
(6)能否由此得出硫、碳、硅三种元素非金属性的强弱,并说明理由:
您最近半年使用:0次
名校
9 . Ⅰ.A、B、C、D、E五种元素的核电荷数均小于18,且依次增大。A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子最外层电子数之和与C原子的最外层电子数相等;D原子最外层电子数是次外层电子数的3倍,E的最高价氧化物对应水化物的碱性在短周期元素中最强。
(1)B元素原子的结构示意图:_______ 。
(2)甲、乙、丙、丁是由以上部分元素组成的10电子微粒。阳离子甲和阴离子乙在加热条件下生成的丙和丁,请写出该反应的离子方程式_______ 。
(3)化合物W是由元素D和E组成的淡黄色固体,则W的电子式为_______ 。
(4)由元素A、C、D组成的盐M,其中含有的化学键类型有_______ ,属于_______ (共价化合物或离子化合物)。
Ⅱ.最近,德国科学家实现了Rb原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知Rb的原子序数为37,相对原子质量是85。
(5)Rb在元素周期表中的位置为_______ 。下列关于Rb的说法中不正确的是_______ 。
a.与水反应比钠更剧烈
b.Rb2O在空气中易吸收水和二氧化碳
c.Rb2O与水能剧烈反应并释放出O2
d.单质具有很强的氧化性
e.RbOH的碱性比同浓度的NaOH弱
(1)B元素原子的结构示意图:
(2)甲、乙、丙、丁是由以上部分元素组成的10电子微粒。阳离子甲和阴离子乙在加热条件下生成的丙和丁,请写出该反应的离子方程式
(3)化合物W是由元素D和E组成的淡黄色固体,则W的电子式为
(4)由元素A、C、D组成的盐M,其中含有的化学键类型有
Ⅱ.最近,德国科学家实现了Rb原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知Rb的原子序数为37,相对原子质量是85。
(5)Rb在元素周期表中的位置为
a.与水反应比钠更剧烈
b.Rb2O在空气中易吸收水和二氧化碳
c.Rb2O与水能剧烈反应并释放出O2
d.单质具有很强的氧化性
e.RbOH的碱性比同浓度的NaOH弱
您最近半年使用:0次
名校
10 . Ⅰ.下列8种化学符号: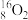 、
、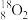 、
、 、
、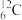 、
、 、
、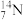 、
、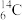 、
、
(1)表示核素的符号共_______ 种。
(2)互为同位素的是_______ 。
(3)质量相同的H216O和D216O所含中子数之比为_______ 。
请回答下列问题:
(4)Y在元素周期表中的位置是_______ 。
(5)X、Z两种元素的气态氢化物稳定性由强到弱的顺序为:_______ 。(化学式表示)
(6)Z、W两种元素的最高价氧化物对应水化物的酸性由强到弱的的顺序为:_______ (用化学式表示)
(7)下列说法能比较出Y与同族的短周期元素Q非金属性强弱的是:_______。
(8)P是W的同族元素,其最高价氧化物可用于制造光导纤维,写出P最高价氧化物与NaOH溶液反应的离子方程式:_______ 。
(9)用电子式表示WY2的形成过程:_______ 。
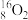 、
、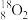 、
、 、
、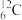 、
、 、
、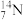 、
、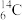 、
、
(1)表示核素的符号共
(2)互为同位素的是
(3)质量相同的H216O和D216O所含中子数之比为
Ⅱ.短周期元素X、Y、Z、W在周期表中的相对位置如下图所示,其中W元素的原子结构示意图为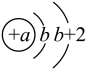 。
。
W | X | Y |
Z |
请回答下列问题:
(4)Y在元素周期表中的位置是
(5)X、Z两种元素的气态氢化物稳定性由强到弱的顺序为:
(6)Z、W两种元素的最高价氧化物对应水化物的酸性由强到弱的的顺序为:
(7)下列说法能比较出Y与同族的短周期元素Q非金属性强弱的是:_______。
| A.Y单质与Q单质发生置换反应 |
| B.Y与Q最高价氧化物对应的水化物的酸性 |
| C.Y、Q形成的化合物中两元素的化合价 |
| D.Y、Q的最简单气态氢化物的沸点 |
(8)P是W的同族元素,其最高价氧化物可用于制造光导纤维,写出P最高价氧化物与NaOH溶液反应的离子方程式:
(9)用电子式表示WY2的形成过程:
您最近半年使用:0次



