名校
1 . 电化学原理在工业生产中发挥着巨大的作用。Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4,下列说法正确的是
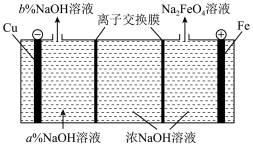

A.阳极的电极反应式为Fe+8OH--6e-=FeO +4H2O +4H2O |
| B.右侧的离子交换膜为阳离子交换膜 |
| C.阴极区a%>b% |
| D.阴极产生的气体是氧气 |
您最近半年使用:0次
2021-05-19更新
|
1310次组卷
|
5卷引用:江苏省(天一中学.海门中学.姜堰中学.淮阴中学)四校2021届高三4月联考化学试题
江苏省(天一中学.海门中学.姜堰中学.淮阴中学)四校2021届高三4月联考化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题(已下线)考点19 电解池-备战2023年高考化学一轮复习考点帮(全国通用)湖南省株洲市第一中学2022-2023学年高二上学期期末考试化学试题(已下线)考点19 电解池(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解题方法
2 . 肼(N2H4)是一种常见的还原剂,设其在酸性溶液中以N2H 形式存在。利用如图电解装置,N2H
形式存在。利用如图电解装置,N2H 可将UO
可将UO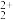 转化为U4+(N2H
转化为U4+(N2H 转化为N2)。下列说法不正确的是
转化为N2)。下列说法不正确的是

 形式存在。利用如图电解装置,N2H
形式存在。利用如图电解装置,N2H 可将UO
可将UO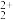 转化为U4+(N2H
转化为U4+(N2H 转化为N2)。下列说法不正确的是
转化为N2)。下列说法不正确的是
A.镀铂钛网上发生的电极反应式为:N2H -4e-=N2↑+5H+ -4e-=N2↑+5H+ |
| B.标准状况下,若生成11.2LN2,则有2molH+从镀铂钛网通过质子交换膜流向钛板 |
| C.电解一段时间后电解质溶液的pH减小 |
D.在该电解装置中,N2H 还原性强于H2O 还原性强于H2O |
您最近半年使用:0次
名校
3 . 海水淡化是解决淡水资源短缺的有效途径之一,其方法主要有蒸馏法、电渗析法和离子交换法等。电渗析法淡化海水的原理如图所示。下列说法正确的是( )
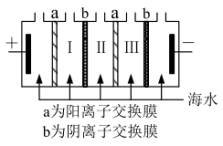

| A.该装置将化学能转化成电能 |
| B.阴极发生的电极反应为2Cl--2e-=Cl2↑ |
| C.Ⅱ室中流出淡水,Ⅰ、Ⅲ室流出液中NaCl浓度变大 |
| D.若将a、b膜的位置互换,则不能获得淡水 |
您最近半年使用:0次
2021-04-01更新
|
826次组卷
|
2卷引用:江苏省吴江汾湖高级中学2020-2021学年高二下学期阶段性教学质量检测化学试题
名校
4 . I. 甲烷和水蒸气催化制氢主要存在如下两个反应:
①CH4(g)+ H2O (g) CO(g)+3H2(g) ∆H= +206kJ•mol-1
CO(g)+3H2(g) ∆H= +206kJ•mol-1
②CO(g)+ H2O (g) CO2 (g)+H2(g) ∆H= —41kJ•mol-1
CO2 (g)+H2(g) ∆H= —41kJ•mol-1
恒定压强为P0时,将n(CH4):n(H2O)=1 :3的混合气体投入反应器中,平衡时各组分的物质的量分数与温度的关系如图所示。
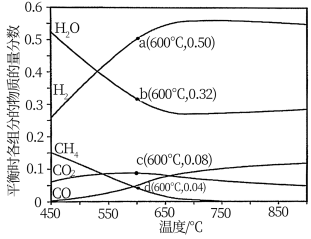
回答下列问题:
(1)写出CH4与CO2生成H2和CO的热化学方程式:___________ 。
(2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是___________ (填字母)。
A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快
B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快
C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
D.加入合适的催化剂,同时降低反应温度,相同时间内的转化率可能不变
(3)恒定压强为P0,投料比n(CH4): n(H2O)=1 :3时,从提高氢气产率角度考虑反应温度应控制在___________ ℃左右。
(4) 600°C时,CH4的平衡转化率为___________ (保留2位有效数字),反应①的平衡常数的计算式为Kp=___________ (Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。
II.我国科学家最近发明了一种Zn-PbO2电池,电解质为K2SO4、H2SO4和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,反应后B中溶液浓度变大,结构示意图如下:

回答下列问题:
(5)电池中,Zn 极上发生的电极反应式为___________ 。
(6)电池放电过程中,每消耗6.5gZn,理论上PbO2电极质量增重___________ g。
①CH4(g)+ H2O (g)
 CO(g)+3H2(g) ∆H= +206kJ•mol-1
CO(g)+3H2(g) ∆H= +206kJ•mol-1②CO(g)+ H2O (g)
 CO2 (g)+H2(g) ∆H= —41kJ•mol-1
CO2 (g)+H2(g) ∆H= —41kJ•mol-1恒定压强为P0时,将n(CH4):n(H2O)=1 :3的混合气体投入反应器中,平衡时各组分的物质的量分数与温度的关系如图所示。

回答下列问题:
(1)写出CH4与CO2生成H2和CO的热化学方程式:
(2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是
A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快
B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快
C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
D.加入合适的催化剂,同时降低反应温度,相同时间内的转化率可能不变
(3)恒定压强为P0,投料比n(CH4): n(H2O)=1 :3时,从提高氢气产率角度考虑反应温度应控制在
(4) 600°C时,CH4的平衡转化率为
II.我国科学家最近发明了一种Zn-PbO2电池,电解质为K2SO4、H2SO4和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,反应后B中溶液浓度变大,结构示意图如下:

回答下列问题:
(5)电池中,Zn 极上发生的电极反应式为
(6)电池放电过程中,每消耗6.5gZn,理论上PbO2电极质量增重
您最近半年使用:0次
2021-03-14更新
|
460次组卷
|
3卷引用:吉林省长春市普通高中2021届高三质量监测(二)(二模)理综化学试题
5 . 电化学脱硫在金属冶炼和废水处理中均有应用。一种电化学脱硫工作原理示意图如图所示。该装置工作时,下列说法正确的是


| A.a为直流电源负极 |
| B.阴极区溶液pH减小 |
| C.Mn2+、Mn3+之间转化可加快电子转移 |
| D.导线中流过4.5mole-同时阳极区溶液质量增加44g |
您最近半年使用:0次
6 . 某研究机构使用Li—SO2Cl2电池作为电源电解制备Ni(H2PO2)2,其工作原理如图所示。已知电池反应为2Li+SO2Cl2=2LiCl+SO2↑,下列说法正确的是


| A.电池的f极连接电解池的h极 |
| B.膜a、c是阴离子交换膜,膜b是阳离子交换膜 |
| C.电池中C电极的电极反应式为SO2Cl2+2e-=2Cl-+SO2↑ |
| D.电解池中不锈钢电极溶解,需要及时更换补充 |
您最近半年使用:0次
名校
7 . 有机物液流电池因其电化学性能可调控等优点而备受关注。南京大学研究团队设计了一种水系分散的聚合物微粒“泥浆”电池(图1)。该电池在充电过程中,聚对苯二酚(图2)被氧化,下列说法错误的是
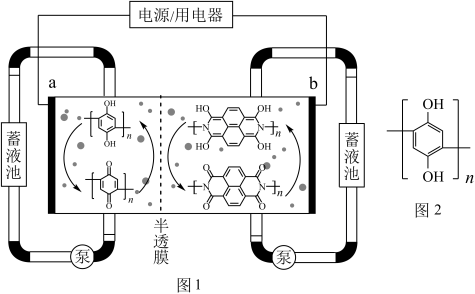

| A.放电时,电流由a电极经外电路流向b电极 |
| B.充电时,a电极附近的pH减小 |
C.充电时,b电极的电极反应方程式为 +4ne-+4nH+= +4ne-+4nH+=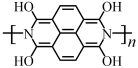 |
| D.电池中间的隔膜为特殊尺寸半透膜,放电时H+从a极区经过半透膜向b极区迁移 |
您最近半年使用:0次
2021-03-01更新
|
2809次组卷
|
16卷引用:江西省重点中学协作体2020-2021学年高三下学期第一次联考理综化学试题
江西省重点中学协作体2020-2021学年高三下学期第一次联考理综化学试题湖南省新高考联盟2021届高三下学期3月提升检测化学(A)试题(已下线)小题18 可充电电池装置 ——备战2021年高考化学经典小题考前必刷(全国通用)河南省实验中学2021届高三5月第四次模拟考试理综化学试题(已下线)【一飞冲天】名家原创卷1(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(浙江专用)河北省石家庄市第二中学2021-2022学年高三上学期九月第四次考试化学试题辽宁省实验中学2021-2022学年度高三上学期第三次阶段测试化学试题(已下线)2022年广东卷高考真题变式题(11-16)四川省成都市成都外国语学校2022届高三下学期第二次诊断性考试理科综合化学试题巩固训练5四川省内江市第六中学2022-2023学年高二下学期第一次月考(创新班)化学试题湖南省娄底市部分学校2022-2023学年高三三模化学试题(已下线)专题九 电化学装置图(讲)广东省广州市中山大学附属中学2021届高三下学期3月月考化学试题
名校
8 . 联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性。都有着广泛的用途。已知反应N2H4(g)+2Cl2(g) N2(g)+4HCl(g),T℃时,向VL恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T℃时,向VL恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
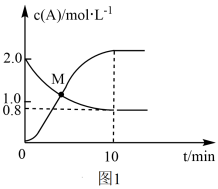
①0~10min内,用N2(g)表示的平均反应速率v(N2)=__ 。
②M点时,N2H4的转化率为__ (精确到0.1)%。
③已知次磷酸钠(NaH2PO2)为正盐,则次磷酸(H3PO2)是__ 元酸。
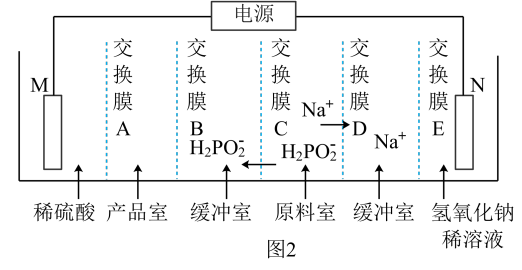
④用次磷酸钠(NaH2PO2)通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于__ (填“阳离子”或“阴离子”)交换膜,电极N的电极反应式为__ ,当电路中流过3.8528×105库仑电量时。制得次磷酸的物质的量为__ (一个电子的电量为1.6×10-19库仑,NA数值约为6.02×1023)。
 N2(g)+4HCl(g),T℃时,向VL恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T℃时,向VL恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
①0~10min内,用N2(g)表示的平均反应速率v(N2)=
②M点时,N2H4的转化率为
③已知次磷酸钠(NaH2PO2)为正盐,则次磷酸(H3PO2)是
④用次磷酸钠(NaH2PO2)通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于

您最近半年使用:0次
9 . 下列有关说法正确 的是
| A.为了减小中和滴定的误差,锥形瓶必须洗净并烘干后才能使用 |
B.向 溶液中滴加过量的 溶液中滴加过量的 溶液得到浊液,过滤得到的滤液中不含 溶液得到浊液,过滤得到的滤液中不含 |
| C.离子交换膜在工业上应用广泛,如氯碱工业中使用阴离子交换膜 |
D.室温下, 的 的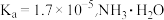 的 的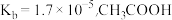 溶液中的 溶液中的 与 与 中的 中的 不一定相等 不一定相等 |
您最近半年使用:0次
2021-01-29更新
|
319次组卷
|
3卷引用:湖北省新高考联考协作体2020-2021学年高二上学期期末考试化学试题
10 . 中国企业华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
 C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是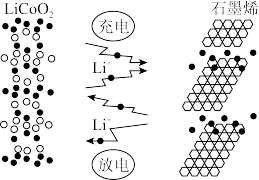
| A.该电池若用隔膜可选用阴离子交换膜 |
| B.充电时,电路中每转移1mole-,石墨烯电极质量增加7g |
| C.放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-=Li1-xCoO2+xLi+ |
| D.对废旧的该电池进行“放电处理”,让Li+嵌入石墨烯中而有利于回收 |
您最近半年使用:0次
2021-01-20更新
|
551次组卷
|
3卷引用:辽宁省锦州市2020-2021学年高二上学期期末考试化学试题



