名校
1 . 某课外活动小组设计实验验证二氧化碳跟过氧化钠反应时需要与水接触。下列说法中正确的是
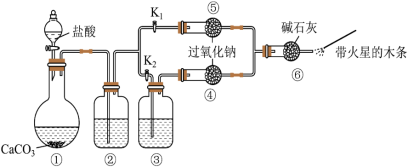

| A.装置①中盐酸不能换成硫酸 |
B.装置②中的试剂是饱和 溶液 溶液 |
C.打开弹簧夹 ,关闭 ,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,木条复燃 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,木条复燃 |
| D.上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应 |
您最近一年使用:0次
2022-12-07更新
|
191次组卷
|
2卷引用:吉林省延边州2022-2023学年高一上学期期末学业质量检测化学试题
解题方法
2 . 某化学兴趣小组同学利用以下装置制备干燥的氯气并对氯气的性质进行探究。
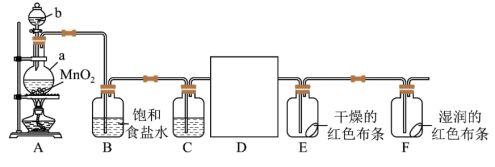
(1)A装置中b仪器名称_____ 。
(2)仪器a中发生反应的离子方程式为_____ ,D为收集干燥的氯气仪器,可以选择_____ (填序号)。

(3)下列有关该实验的说法中不正确的是______ (填字母)。
a.B中饱和食盐水主要作用之一是除去氯气中的氯化氢气体
b.C中试剂是浓硫酸,目的是干燥氯气
c.E中红色布条不褪色,F中红色布条褪色,证明氯气具有漂白性
d.尾气处理时,所用试剂可以选用澄清石灰水
(4)新冠肺炎疫情期间,“84消毒液”被广泛应用于物体表面杀菌消毒。制备“84消毒液”的化学反应方程式为______ 。
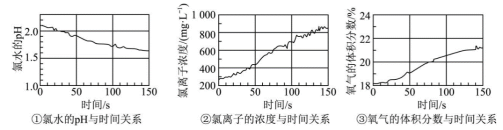
(5)利用数字化实验探究次氯酸的化学性质,用强光照射盛有氯水的密闭广口瓶;并用传感器测定广口瓶中数据,得到如图曲线。请用化学方程式解释曲线中氯离子的浓度和氧气体积分数变化的原因:_____ 。
(6)该兴趣小组在40℃条件下,将一定量的Cl2通入一定量的NaOH溶液中,得到的产物中含有NaCl、NaClO和NaClO3,已知Cl-和ClO-的个数比为8:3,则此过程中氧化剂和还原剂的个数之比为_____ 。

(1)A装置中b仪器名称
(2)仪器a中发生反应的离子方程式为

(3)下列有关该实验的说法中不正确的是
a.B中饱和食盐水主要作用之一是除去氯气中的氯化氢气体
b.C中试剂是浓硫酸,目的是干燥氯气
c.E中红色布条不褪色,F中红色布条褪色,证明氯气具有漂白性
d.尾气处理时,所用试剂可以选用澄清石灰水
(4)新冠肺炎疫情期间,“84消毒液”被广泛应用于物体表面杀菌消毒。制备“84消毒液”的化学反应方程式为
(5)利用数字化实验探究次氯酸的化学性质,用强光照射盛有氯水的密闭广口瓶;并用传感器测定广口瓶中数据,得到如图曲线。请用化学方程式解释曲线中氯离子的浓度和氧气体积分数变化的原因:

(6)该兴趣小组在40℃条件下,将一定量的Cl2通入一定量的NaOH溶液中,得到的产物中含有NaCl、NaClO和NaClO3,已知Cl-和ClO-的个数比为8:3,则此过程中氧化剂和还原剂的个数之比为
您最近一年使用:0次
名校
解题方法
3 . 下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中不正确的是


| A.加热不久就能看到A烧杯的澄清石灰水变浑浊 |
| B.要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球 |
| C.甲为碳酸氢钠,乙为纯碱 |
| D.整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊 |
您最近一年使用:0次
2021-11-09更新
|
932次组卷
|
32卷引用:吉林省汪清县第六中学2021届高三第三次月考模拟化学试题
吉林省汪清县第六中学2021届高三第三次月考模拟化学试题2016届内蒙古鄂尔多斯市西部四校高三上学期期中联考化学试卷2016届内蒙古巴彦淖尔市第一中学高三上期中考试理化学试卷2016届吉林省东北师范大学附属中学高三上第三次模拟化学试卷2015-2016学年江西省南昌八一中学等三校高一上期末联考化学试卷2015-2016学年辽宁省实验中学高一上12月月考化学试卷2016-2017陕西西安长安区一中实验班高一12月考化学卷辽宁省大石桥市第二高级中学2017-2018学年高一12月月考化学试题河南省中原名校(即豫南九校)2017-2018学年高一上学期期末联考化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密内蒙古自治区五原县第一中学2017-2018学年高二期末考试化学试题【全国校级联考】新疆维吾尔自治区昌吉市教育共同体2019届高三上学期9月月考化学试题【全国百强校】吉林省实验中学2018-2019学年高一上学期期末考试化学试题【全国百强校】湖南省长沙市雅礼中学2017-2018学年高一第一学期期末考试化学试题新疆克拉玛依市第十三中学2018-2019学年高一上学期第二次月考化学试题安徽省宿州市萧城一中2020届高三上学期第二次月考化学试题山东省邹平一中2018-2019学年高一第三次阶段性化学考试试题(已下线)【南昌新东方】南昌三中2019-2020 高一(上)期末重庆市巴蜀中学2019-2020学年高一上学期期末考试化学试题人教版(2019)高一必修第一册 第二章 海水中的重要元素 第一节 钠及其化合物 作业帮内蒙古通辽市科左后旗甘旗卡第二高级中学2021届高三9月月考化学试题河南省长葛市第一高级中学2020-2021学年高一上学期阶段性测试试卷化学试题陕西省黄陵中学2021届高三(本部)上学期期中考试化学试题高一必修第一册(苏教2019)专题3 第二单元 金属钠及钠的化合物4吉林省白城市洮南一中2020-2021学年高一上学期期中考试化学试题重庆市第二十九中学2020-2021学年高一上学期半期测试化学试题湖南省长沙市雅礼中学2020-2021学年高一下学期开学考化学试题东北育才中学2020-2021学年高一上学期10月段考化学试题辽宁省东北育才学校科学高中2021-2022学年高一上学期第一次月考化学试题北京市第九中学2021-2022学年高一上学期期中考试化学试题河南省2021-2022学年高三上学期阶段性大联考化学试题(已下线)第07讲 碳酸钠和碳酸氢钠-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)
4 . 随着原子序数的递增,A~G七种短周期元素的最高正价或最低负价与原子序数的关系如图所示。

(1)C元素在周期表中的位置为_____ 。
(2)B元素原子与氢原子组成含10电子的分子的化学式为_____ ,D、E两种元素的离子半径大小关系为_____ (填元素符号)。
(3)E元素的最高价氧化物与氢氧化钠溶液反应的离子方程式是_____ 。
(4)D元素与G元素形成的最简单化合物的电子式为_____ ,所含的化学键类型为_____ 。
(5)下列表述中,能证明B元素比A元素的非金属性强的是_____ (填字母)。
a.B元素的简单气态氢化物的热稳定性比A的强
b.B元素的最高价氧化物对应的水化物的酸性比A的强
c.B元素的最高正价为+5,A元素的最高正价为+4

(1)C元素在周期表中的位置为
(2)B元素原子与氢原子组成含10电子的分子的化学式为
(3)E元素的最高价氧化物与氢氧化钠溶液反应的离子方程式是
(4)D元素与G元素形成的最简单化合物的电子式为
(5)下列表述中,能证明B元素比A元素的非金属性强的是
a.B元素的简单气态氢化物的热稳定性比A的强
b.B元素的最高价氧化物对应的水化物的酸性比A的强
c.B元素的最高正价为+5,A元素的最高正价为+4
您最近一年使用:0次
名校
解题方法
5 . 请用下列装置设计一个实验,证明Cl2的氧化性比I2的氧化性强。
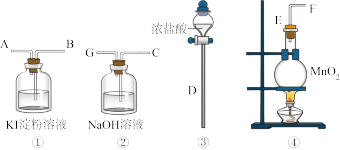
请回答下列问题:
(1)若气流从左到右,则上述仪器的连接顺序为D接E,F接_______ ,________ 接_______ 。若要制得纯净的氯气,则还要先后通过的试剂是_________ ,__________ 。
(2)圆底烧瓶中发生反应的化学方程式为___________ 。
(3)证明Cl2比I2的氧化性强的实验现象是___________ 。
(4)氯气与NaOH溶液反应的离子方程式:________ ,检验Na+的实验名称是_______ ,叙述检验Cl-的操作方法及结论_______ 。

请回答下列问题:
(1)若气流从左到右,则上述仪器的连接顺序为D接E,F接
(2)圆底烧瓶中发生反应的化学方程式为
(3)证明Cl2比I2的氧化性强的实验现象是
(4)氯气与NaOH溶液反应的离子方程式:
您最近一年使用:0次
名校
解题方法
6 . 下列说法正确的是
A.pH<7的溶液:Cu2+、Na+、Mg2+、NO 能大量共存 能大量共存 |
B.滴加酚酞溶液显红色的溶液:Ba2+、NH 、Cl−、NO 、Cl−、NO 能大量共存 能大量共存 |
C.取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO |
| D.H++OH-=H2O可描述所有酸碱中和反应的实质 |
您最近一年使用:0次
2021-08-24更新
|
724次组卷
|
12卷引用:吉林省延边第二中学2020-2021学年高一上学期第一次考试月考化学试题
吉林省延边第二中学2020-2021学年高一上学期第一次考试月考化学试题(已下线)2.1.2 物质的检验 物质性质和变化的探究-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)吉林省长春北师大附属学校2021-2022学年高一上学期第一次月考化学试题黑龙江省哈尔滨市第六中学2021-2022学年高一上学期10月月考化学试题河南省温县第一高级中学2021-2022学年高一上学期9月月考化学试题四川省绵阳东辰国际学校2021-2022学年高一上学期第一次月考试化学试题新疆师范大学附属中学2021-2022学年高一10月月考化学试题新疆乌鲁木齐市第八中学2021-2022学年高一上学期第二次月考化学试题黑龙江省齐齐哈尔市第一中学2021-2022学年高一上学期期中考试化学试题黑龙江省哈尔滨市第六中学校2021-2022学年高一上学期10月月考化学试题安徽师范大学附属中学2022-2023学年高一上学期10月测试化学试题安徽省安庆市安庆七中2023-2024学年高一上学期期中考试化学试卷
名校
解题方法
7 . 证明某溶液只含有Fe2+,而不含有Fe3+的实验方法是
| A.先滴加氯水,再滴加KSCN溶液后显红色 |
| B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色 |
| C.滴加酸性KMnO4溶液 |
| D.只需滴加KSCN溶液 |
您最近一年使用:0次
2020-10-17更新
|
785次组卷
|
11卷引用:吉林省延边第二中学2020-2021学年高一上学期第二次考试月考化学试题
吉林省延边第二中学2020-2021学年高一上学期第二次考试月考化学试题贵州省安顺市普定县第一中学2018-2019学年高一上学期12月份考试化学试题云南省双柏县一中2019-2020学年高二上学期开学考试化学试题(已下线)3.1.1 铁及其化合物练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性鲁科版(2019)高一必修第一册第三章易错疑难集训(一)广东省东莞市2019-2020学年高一上学期期末考试化学试题黑龙江省哈尔滨市宾县第二中学2020-2021学年高一上学期第三次月考化学试题黑龙江省哈尔滨市第一六二中学2021-2022学年高一上学期期末考试化学试题辽宁省锦州市黑山县黑山中学2021-2022学年高一上学期12月月考化学试题
解题方法
8 . 已知实验室制备氯气的化学反应原理:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,为探究氯气的性质,某同学设计了如图所示的实验装置。
MnCl2+Cl2↑+2H2O,为探究氯气的性质,某同学设计了如图所示的实验装置。
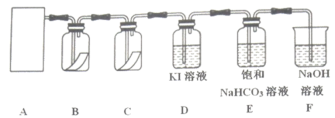
请回答下列问题:
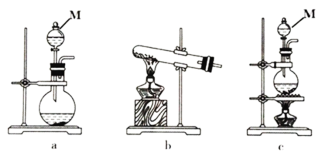
(1)该实验中,在A处用于制取氯气的实验装置是_______ (填字母),仪器M的名称为_______ 。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的红色布条也褪色,其原因可能是_______ ,请提出合理的改进方法_______ 。
(3)写出装置D溶液中反应的离子方程式:_______ 。
(4)氯气通入饱和NaHCO3溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明Cl2与H2O反应的产物中含有_______ (填化学式)。
(5)装置F的作用是_______ ,用化学方程式表示其反应原理:_______ ,验证反应后装置F的溶液中是否存在Cl-的正确操作是_______ 。
 MnCl2+Cl2↑+2H2O,为探究氯气的性质,某同学设计了如图所示的实验装置。
MnCl2+Cl2↑+2H2O,为探究氯气的性质,某同学设计了如图所示的实验装置。
请回答下列问题:
(1)该实验中,在A处用于制取氯气的实验装置是

(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的红色布条也褪色,其原因可能是
(3)写出装置D溶液中反应的离子方程式:
(4)氯气通入饱和NaHCO3溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明Cl2与H2O反应的产物中含有
(5)装置F的作用是
您最近一年使用:0次
名校
解题方法
9 . 现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学向1mol·L-1氯化铁溶液中加入少量的NaOH溶液;
乙同学直接加热煮沸饱和FeCl3溶液;
丙同学向25mL沸水中逐滴加入1~2mLFeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是__ ;若丙同学实验中不停止加热,会看到__ 。
(2)证明有Fe(OH)3胶体生成的实验操作及现象是__ 。
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明__ 。
②向其中加入稀硫酸,产生的现象是___ 。
甲同学向1mol·L-1氯化铁溶液中加入少量的NaOH溶液;
乙同学直接加热煮沸饱和FeCl3溶液;
丙同学向25mL沸水中逐滴加入1~2mLFeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是
(2)证明有Fe(OH)3胶体生成的实验操作及现象是
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明
②向其中加入稀硫酸,产生的现象是
您最近一年使用:0次
2020-08-23更新
|
19次组卷
|
5卷引用:2016-2017学年吉林省汪清六中高一上学期期中化学试卷
2016-2017学年吉林省汪清六中高一上学期期中化学试卷2015-2016学年四川省雅安市天全中学高一上学期期中测试化学试卷(已下线)第05讲 物质的组成、性质和分类(精练)——2021年高考化学一轮复习讲练测(已下线)第2单元 物质的组成分类与性质(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷山东省枣庄市第三中学2022-2023学年高一上学期10月月考化学试题
名校
10 . 二氧化铈CeO2是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末含(SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
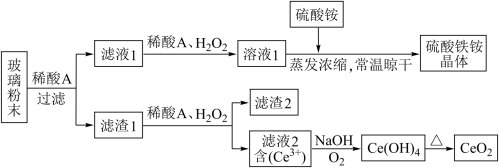
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液
(1)稀酸A的分子式是_____________________ 。
(2)滤液1中加入H2O2溶液的目的是____________________ 。滤渣1中加入稀酸A和H2O2发生反应的离子方程是为______________________ 。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂的化学式为______________ 。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式__________________________________ 。
(5)由滤液2生成Ce(OH)4的离子方程式___________________________ 。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:___________________________ 。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为___________________ (结果保留两位有效数字)。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液
(1)稀酸A的分子式是
(2)滤液1中加入H2O2溶液的目的是
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂的化学式为
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式
(5)由滤液2生成Ce(OH)4的离子方程式
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为
您最近一年使用:0次



