1 . 某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe,充分反应(已知 被还原为NO),最终溶液体积为1L。下列说法正确的是
被还原为NO),最终溶液体积为1L。下列说法正确的是
 被还原为NO),最终溶液体积为1L。下列说法正确的是
被还原为NO),最终溶液体积为1L。下列说法正确的是A.所得溶液中c( )=2.75 mol·L-1 )=2.75 mol·L-1 |
| B.所得溶液中c(Fe2+):c(Fe3+)=1:2 |
| C.反应后生成NO的体积为33.6 L(标准状况下) |
| D.所得溶液中的溶质只有FeSO4 |
您最近一年使用:0次
2019-02-20更新
|
4954次组卷
|
16卷引用:【全国百强校】湖南省长沙市雅礼中学2017-2018学年高二下学期期末考试化学试题
【全国百强校】湖南省长沙市雅礼中学2017-2018学年高二下学期期末考试化学试题湖南省衡阳市第一中学2019-2020学年高一下学期入学考试化学试题【全国百强校】江西省南昌市第二中学2017-2018学年高一下学期第二次月考化学试题【校级联考】天津市六校(静海一中、宝坻一中、杨村一中等)2018-2019学年高一上学期期末考试化学试题福建省莆田第六中学2018-2019学年高一(实验班)下学期期中考试化学试题福建省莆田第六中学2018-2019学年高一下学期期中考试化学试题江西省新余市第一中学2019-2020学年高一下学期第一次月考化学试题黑龙江省鸡西市第一中学2019-2020学年高一下学期期中考试化学试题浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(5-6班)化学试题广东省大联考2021-2022学年高一下学期期中检测化学试题山西省太原市山西现代双语学校2021-2022学年高一下学期5月月考化学试题浙江省湖州中学2022-2023学年高一下学期3月第一次检测化学试题湖北省武汉市第二中学2023-2024学年高一下学期化学周练A卷(1)试卷 湖北省武汉市第十二中学2023-2024学年高一下学期3月月考化学试题河北省石家庄市河北正定中学2023-2024学年高一下学期第一次月考(3月)化学试题安徽省淮南市第二中2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
2 . 某试液中只可能含有K+、NH 、Fe2+、Al3+、Cl-、SO
、Fe2+、Al3+、Cl-、SO 、CO
、CO 、AlO
、AlO 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:下列说法正确的是
中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:下列说法正确的是
 、Fe2+、Al3+、Cl-、SO
、Fe2+、Al3+、Cl-、SO 、CO
、CO 、AlO
、AlO 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:下列说法正确的是
中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:下列说法正确的是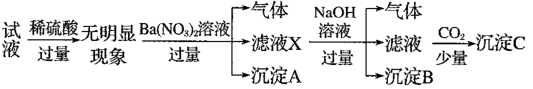
A.无法确定原试液中是否含有SO |
B.滤液X中大量存在的阳离子有NH 、Fe2+和Ba2+ 、Fe2+和Ba2+ |
| C.沉淀C为Al(OH)3 |
| D.原试液中一定不含有K+ |
您最近一年使用:0次
2020-12-17更新
|
1749次组卷
|
6卷引用:湖南省湘西州吉首市2022年基础教育综合实践改革成果展示活动检测高二化学试题
名校
解题方法
3 . Cl2O又称为次氯酸酐,是强氧化剂,易溶于水且与水反应,受热时容易燃烧、高浓度时容易爆炸。其熔沸点分别为-116℃和3.8℃;Cl2的沸点是-34.6℃。现利用HgO和Cl2以及以下装置制备Cl2O:

回答下列问题:
(1)仪器A的名称:___________ 。用酸性高锰酸钾制备Cl2应采用气体发生装置:___________ (填“甲”或“乙”)
(2)②、③中盛放的试剂分别是___________ 、___________ 。
(3)写出HgO和Cl2制备Cl2O的化学方程式:___________ 。
(4)通入干燥空气的目的是___________ 。
(5)实验装置存在一些不足,请指出___________ 。
(6)要想进一步分离得到Cl2O,采用的操作方法是:___________ 。

回答下列问题:
(1)仪器A的名称:
(2)②、③中盛放的试剂分别是
(3)写出HgO和Cl2制备Cl2O的化学方程式:
(4)通入干燥空气的目的是
(5)实验装置存在一些不足,请指出
(6)要想进一步分离得到Cl2O,采用的操作方法是:
您最近一年使用:0次
2021-07-14更新
|
811次组卷
|
7卷引用:湖南省长沙市长郡中学2021-2022学年高二上学期入学考试化学试题
9-10高三·湖北荆州·阶段练习
4 . 有一混合溶液,其中只含有Fe2+、Cl-、Br-、I- (忽略水的电离),Cl-、Br-、I- 的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为
| A.7:4 | B.7:3 | C.7:2 | D.7:1 |
您最近一年使用:0次
2020-08-20更新
|
1247次组卷
|
33卷引用:湖南省长沙市湖南师范大学附属中学2019-2020学年高二上学期入学考试化学试题
湖南省长沙市湖南师范大学附属中学2019-2020学年高二上学期入学考试化学试题湖南师范大学附属中学2019-2020学年高二上学期入学考试化学试题(已下线)2010~2011学年河北省唐山一中高二下学期期末考试化学黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题(已下线)2010年湖北省监利县一中2011届高三八月月考化学试题(已下线)2011届年山东省淄博市重点中学高三上学期期中考试化学试卷(已下线)2012届河北省唐山一中高三上学期期中考试化学试卷(已下线)2012届辽宁省铁岭中学高三上学期第三次月考化学试卷2014届河北省衡水中学高三上学期一调考试化学试卷(已下线)2014届江西省师大附中高三上学期期中考试化学试卷(已下线)2014届江西省师大附中高三上学期期中考试化学试卷2015届辽宁省丹东市高三总复习质量测试(一)理综化学试卷2016届甘肃省天水市第一中学高三上学期期中测试化学试卷2017届江西省鹰潭一中高三上学期第二次月考化学试卷2017届甘肃省天水一中高三上学期12月月考化学卷2017届甘肃省天水一中高三上12月月考化学试卷江西省鹰潭市2017-2018学年高一上学期期末质量检测化学试题【全国百强校】山东省济南市历城第二中学2019届高三上学期11月调研检测化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第2讲 氯及其化合物 (题型专练)山西省晋中市平遥县第二中学2020届高三10月月考化学试题江苏省常州市第一中学2019-2020学年高一上学期期中考试化学试题河南省鹤壁市淇滨高级中学2019-2020学年高一上学期期中考试化学试题江西省宜春九中(外国语学校)2019-2020学年高一上学期第二次月考化学试题2020届高考化学知识点必练——氧化还原反应的规律夯基提能2020届高三化学选择题对题专练——氧化还原反应的综合分析(基础过关)黑龙江省哈尔滨市第六中学校2021届高三上学期开学考试化学试题天津市南开中学2020届高三第二次月考化学试题吉林省白城市洮南市第一中学2021届高三上学期第一次月考化学试题(已下线)江西省宜丰中学2018_2019学年高一化学上学期期末考试试卷黑龙江省大庆中学2021届高三10月月考化学试题安徽省池州市第一中学2021届高三上学期9月月考化学试题江西省九江市柴桑区第一中学2021-2022学年高三上学期第二次月考化学试题河南省鹤壁高中2021-2022学年高三上学期一轮复习第二次质量检测化学试题
名校
5 . 某小组研究溶液中 与
与 (亚硝酸根)、
(亚硝酸根)、 的反应。
的反应。
资料: 在溶液中呈棕色。
在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用_______ 溶液检出溶液中含有 ,现象是
,现象是_______ 。
②甲认为是 氧化了溶液中的
氧化了溶液中的 .乙对比a、b的实验现象认为
.乙对比a、b的实验现象认为 不是主要原因,理由是
不是主要原因,理由是_______ 。另行设计实验Ⅱ进行验证,确认是酸性条件下 与
与 反应生成了
反应生成了 和NO。写出该反应的离子方程式
和NO。写出该反应的离子方程式_______ 。
(2)研究现象a中的棕色溶液。
提出假设:现象a中溶液变为棕色可能是NO与溶液中的 或
或 发生了反应。进行实实验Ⅲ,证实溶液呈棕色只是因为
发生了反应。进行实实验Ⅲ,证实溶液呈棕色只是因为 与NO发生了反应。
与NO发生了反应。
①实验Ⅲ的操作和现象是_______ 。
②写出该反应的离子方程式_______ 。
(3)研究酸性条件下,溶液中 与
与 、
、 的反应。
的反应。
ⅲ中出现棕色的原因是_______ 。
(4)实验结论:_______ (至少写出两条)
 与
与 (亚硝酸根)、
(亚硝酸根)、 的反应。
的反应。| 实验Ⅰ | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 |   溶液 溶液(  ) ) |   溶液 溶液(  ) ) | a.逐滴加入 溶液至1mL,溶液先变黄,后变为棕色。2小时后,无明显变化 溶液至1mL,溶液先变黄,后变为棕色。2小时后,无明显变化 |
  溶液(加NaOH溶液至 溶液(加NaOH溶液至 ) ) | b.逐滴加入 溶液至1mL,无明显变化。 溶液至1mL,无明显变化。 | ||
 在溶液中呈棕色。
在溶液中呈棕色。(1)研究现象a中的黄色溶液。
①用
 ,现象是
,现象是②甲认为是
 氧化了溶液中的
氧化了溶液中的 .乙对比a、b的实验现象认为
.乙对比a、b的实验现象认为 不是主要原因,理由是
不是主要原因,理由是 与
与 反应生成了
反应生成了 和NO。写出该反应的离子方程式
和NO。写出该反应的离子方程式(2)研究现象a中的棕色溶液。
提出假设:现象a中溶液变为棕色可能是NO与溶液中的
 或
或 发生了反应。进行实实验Ⅲ,证实溶液呈棕色只是因为
发生了反应。进行实实验Ⅲ,证实溶液呈棕色只是因为 与NO发生了反应。
与NO发生了反应。①实验Ⅲ的操作和现象是
②写出该反应的离子方程式
(3)研究酸性条件下,溶液中
 与
与 、
、 的反应。
的反应。| 序号 | 操作 | 现象 |
| ⅰ | 取 的 的 溶液0.5mL,加醋酸调至体积为1mL,且 溶液0.5mL,加醋酸调至体积为1mL,且 ,再加入 ,再加入  溶液1mL 溶液1mL | 溶液立即变为棕色 |
| ⅱ | 取 的 的 溶液0.5mL,加醋酸调至体积为1mL,且 溶液0.5mL,加醋酸调至体积为1mL,且 ,再加入 ,再加入  溶液1mL 溶液1mL | 无明显变化 |
| ⅲ | 分别取1mL  的 的 溶液与1mL 溶液与1mL  的 的 溶液混合,再加入一滴浓硫酸(混合后溶液 溶液混合,再加入一滴浓硫酸(混合后溶液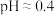 ) ) | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
(4)实验结论:
您最近一年使用:0次
2022-04-04更新
|
688次组卷
|
4卷引用:湖南省长沙市实验中学2022-2023学年高二上学期入学考试化学试题
湖南省长沙市实验中学2022-2023学年高二上学期入学考试化学试题湖南省五市十校教研教改共同体2021-2022学年高一下学期期末考试化学试题北京市一零一中学2021-2022学年高一上学期期末考试化学试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)
名校
解题方法
6 . 2022年1月10日上午10时15分,一辆装载76桶、共计22吨硫酰氯(SO2Cl2)的箱式危化品车在杭金衢高速衢向K328处发生事故,导致4桶破损,部分硫酰氯流出,与潮湿空气接触后,现场散发出刺鼻性的烟雾,情况十分危急。硫酰氯是一种重要的化工试剂,常温下为无色液体,熔点为-54.1℃,沸点为69.1℃。如今,氯化法是合成硫酰氯的常用方法。实验室合成硫酰氯的实验装置如图所示(部分夹持装置未画出]:

已知:①

②100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。回答下列问题:
(1)硫酰氯(SO2Cl2)中S的化合价为_______ 。
(2)实验室常用高锰酸钾和浓盐酸来制备氯气,请写出装置A中制氯气的离子方程式_______ 。
(3)装置B盛装的试剂为_______ ;装置F的作用为_______ 。
(4)二氧化硫是合成硫酰氯的关键试剂之一,下列有关 的描述正确的是_______。
的描述正确的是_______。
(5)合成的硫酰氯在空气中不稳定,能与空气中的水蒸气生成两种常见的强酸,并产生白雾。请写出相应的化学方程式_______ 。
(6)若装置A中排出氯气4.48L(已折算成标准状况),用仪器检测到装置D中放出12kJ的热量,则氯气的转化率为_______ 。

已知:①


②100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。回答下列问题:
(1)硫酰氯(SO2Cl2)中S的化合价为
(2)实验室常用高锰酸钾和浓盐酸来制备氯气,请写出装置A中制氯气的离子方程式
(3)装置B盛装的试剂为
(4)二氧化硫是合成硫酰氯的关键试剂之一,下列有关
 的描述正确的是_______。
的描述正确的是_______。A.实验室常用稀硫酸和亚硫酸钠溶液反应来制备 |
| B.二氧化硫是一种酸性氧化物,与水反应生成硫酸,是造成酸雨的主要原因 |
| C.二氧化硫能够抑制细菌和真菌的滋生,因此,某些食品也可以用二氧化硫来防腐 |
| D.二氧化硫具有漂白性,能使湿润的蓝色石蕊试纸先变红后褪色 |
(6)若装置A中排出氯气4.48L(已折算成标准状况),用仪器检测到装置D中放出12kJ的热量,则氯气的转化率为
您最近一年使用:0次
2022-11-05更新
|
155次组卷
|
3卷引用:湖南省三湘联考2022-2023学年高二上学期期中联考化学试题
名校
7 . 四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述的判断正确的是( )
| A.a-b=n-m |
| B.元素的原子序数a>b>c>d |
| C.最高价氧化物对应水化物的碱性X>Y |
| D.离子半径r(Rm-)>r(Zn-)>r(Yn+)>r(Xm+) |
您最近一年使用:0次
2020-09-12更新
|
324次组卷
|
3卷引用:湖南省长沙市长郡中学2020-2021学年高二上学期入学考试化学试题
湖南省长沙市长郡中学2020-2021学年高二上学期入学考试化学试题湖南省湖南师范大学附属中学2020-2021学年高二上学期入学考试化学试题(已下线)第1章 原子结构与元素性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)
解题方法
8 . 某铝土矿中主要含有Al2O3、Al(OH)3还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如图所示:

请回答下列问题:
(1)粉碎后的铝土矿碱浸时应在较高温度下进行,其目的是____________________ 。滤渣1的主要成分为________________ 。
(2)Al2O3与NaOH溶液反应的离子方程式为____________________________________ 。
(3)加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的_________ 气体的方法来代替。(已知:通入该气体后,其产物之一可用来做发酵粉)。
(4)焙烧过程中发生的化学方程式为_________________________________ 。
(5)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化(即与少量熟石灰反应)反应除去,写出苛化反应的化学方程式:_________________________________________________ 。
(6)该生产流程能实现____________________ (填化学式)的循环利用。

请回答下列问题:
(1)粉碎后的铝土矿碱浸时应在较高温度下进行,其目的是
(2)Al2O3与NaOH溶液反应的离子方程式为
(3)加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的
(4)焙烧过程中发生的化学方程式为
(5)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化(即与少量熟石灰反应)反应除去,写出苛化反应的化学方程式:
(6)该生产流程能实现
您最近一年使用:0次
2020-01-17更新
|
301次组卷
|
2卷引用:湖南省娄底市娄星区2020-2021学年高二下学期期中考试化学试题
名校
解题方法
9 . 2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢(HCN)气体。氰化氢的沸点只有26 ℃,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题:
(1)写出氰化钠遇水产生氰化氢气体的离子方程式_________________________
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式________________________________ 。
(3)爆炸残留在废水中的CN-可以用Cr2O 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
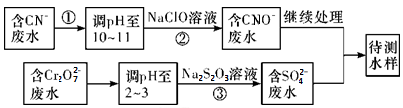
①上述处理废水流程中主要使用的方法是____________
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为_________________ ;
③步骤③中,每处理0.4 mol Cr2O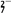 时转移电子2.4 mol,该反应的离子方程式
时转移电子2.4 mol,该反应的离子方程式_________ ;
(1)写出氰化钠遇水产生氰化氢气体的离子方程式
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式
(3)爆炸残留在废水中的CN-可以用Cr2O
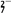 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
①上述处理废水流程中主要使用的方法是
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为
③步骤③中,每处理0.4 mol Cr2O
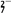 时转移电子2.4 mol,该反应的离子方程式
时转移电子2.4 mol,该反应的离子方程式
您最近一年使用:0次
2017-12-13更新
|
624次组卷
|
2卷引用:湖南省浏阳一中、醴陵一中、南方中学2017-2018学年高二12月联考化学试题
名校
10 . 工业上用锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如图:

已知:生成氢氧化物沉淀的pH如表所示:
注:金属离子的起始浓度为0.1mol/L,回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是____ ,盐酸溶解MnCO3的化学方程式是___ 。
(2)向溶液1中加入双氧水时,反应的离子方程式是___ 。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是___ 。
(4)将MnCl2转化为MnO2的另一种方法是电解法。
①阳极生成MnO2的电极反应式是____ 。
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2,检验Cl2的操作是___ 。
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是___ 。

已知:生成氢氧化物沉淀的pH如表所示:
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是
(2)向溶液1中加入双氧水时,反应的离子方程式是
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是
(4)将MnCl2转化为MnO2的另一种方法是电解法。
①阳极生成MnO2的电极反应式是
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2,检验Cl2的操作是
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是
您最近一年使用:0次



