贵州省六盘水市第七中学2018-2019学年高一上学期期末考试化学试题
贵州
高一
期末
2020-01-24
193次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、化学实验基础、认识化学科学
贵州省六盘水市第七中学2018-2019学年高一上学期期末考试化学试题
贵州
高一
期末
2020-01-24
193次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、化学实验基础、认识化学科学
一、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
1. 化学与生活密切相关。下列说法正确的是
| A.医用消毒酒精中乙醇的浓度(体积分数)为95% |
| B.硅胶可用作瓶装药品、袋装食品的干燥剂 |
| C.化石燃料完全燃烧不会造成大气污染 |
| D.铁比铜金属性强,FeCl3腐蚀Cu刻制印刷电路板 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
2. 下列有关实验操作的叙述错误的是
| A.CCl4萃取碘水中的I2,先从分液漏斗下口放出有机层,后从上口倒出水层 |
| B.制备蒸馏水时向蒸馏烧瓶中加入碎瓷片,防止暴沸 |
| C.金属钠着火时,立即使用泡沫灭火器灭火 |
| D.用试管加热碳酸氢钠固体时,使试管口微向下倾斜 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
3. 下列有关实验的操作正确的是
| 实验目的 | 实验操作 | |
| A | 配制浓度为0.010 的KMnO4溶液 的KMnO4溶液 | 用托盘天平称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
| B | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
| C | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| D | 排水法收集KMnO4分解产生的O2 | 先移出导管,后熄灭酒精灯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
4. 设NA表示阿伏加 德罗常数,下列叙述正确的是
| A.常温常压下,22gCO2含有的氧原子数为NA |
| B.标准状况下,2.24 L CCl4含有的分子数为0.1NA |
| C.常温常压下,0.1mol•L-1的MgCl2溶液中含Cl-数为0.2NA |
| D.常温常压下,5.6g铁与足量Cl2完全反应,转移电子数为0.2NA |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
5. 根据胶体的相关性质,下列叙述错误的是
| A.当光束通过Fe(OH)3胶体时,可以看到一条光亮的“通路” |
| B.制备Fe(OH)3胶体,将NaOH浓溶液滴加到饱和的FeCl3溶液中 |
| C.存在于污水中的胶体物质,则常用投明矾、硫酸铁等电解质的方法进行处理 |
| D.胶体化学的应有很广,是制备纳米材料的有效方法之一 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
6. 下列关于离子共存或离子反应的说法正确的是
| A.某无色溶液中可能大量存在Fe3+、H+、I-、MnO4- |
| B.与Al反应能放出H2的溶液中:Fe2+、K+、ClO-、SO42- |
| C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O |
| D.向Na2SiO3溶液中通入过量CO2:SiO32—+ CO2+ H2O=H2SiO3↓+CO32— |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
7. 化学与生活密切相关,下列应用中利用了物质氧化性的是
| A.漂白粉用于生活用水的消毒 | B.氢氧化铝用于中和过多胃酸 |
| C.食醋用于除水垢 | D.氢氟酸用于刻蚀玻璃 |
您最近一年使用:0次
2020-01-17更新
|
148次组卷
|
2卷引用:贵州省六盘水市第七中学2018-2019学年高一上学期期末考试化学试题
单选题
|
适中(0.65)
8. 下列变化中,气体被还原的是
| A.CO2使Na2O2固体变白 | B.Cl2使KBr溶液变黄 |
| C.一定条件下H2能使CuO固体变红 | D.NH3使AlCl3溶液产生白色沉淀 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
9. 下列有关叙述不正确 的是
| A.钠燃烧时生成氧化钠 | B.钠燃烧时发出黄色的火焰 |
| C.铝是地壳里含量最多的金属元素 | D.在常温下,铝与氧气作用生成致密氧化膜 |
【知识点】 钠与氧气等非金属的反应解读 铝制品日常使用的注意事项解读
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
11. 将足量固体或气体加入溶液中,反应后溶液的质量减少的是
| A.将Al粉投入NaOH溶液 | B.将Fe粉投入CuSO4溶液 |
| C.将Cl2通入澄清石灰水中 | D.将Fe粉投入FeCl3溶液 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
12. 下列叙述正确的是
| A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 |
| B.Cl2是一种有毒气体,不可用于自来水的杀菌消毒 |
| C.SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
| D.Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
13. 有一包白色粉末,为鉴别其成分进行如下实验:
(Ⅰ)将部分白色粉末加入水中,振荡,有白色沉淀生成;
(Ⅱ)向(Ⅰ)的悬浊液中加入过量的稀硝酸,白色沉淀全部消失,并有气泡产生;
(Ⅲ)取少量(Ⅱ)的溶液滴入稀硫酸,有白色沉淀生成。
(Ⅰ)将部分白色粉末加入水中,振荡,有白色沉淀生成;
(Ⅱ)向(Ⅰ)的悬浊液中加入过量的稀硝酸,白色沉淀全部消失,并有气泡产生;
(Ⅲ)取少量(Ⅱ)的溶液滴入稀硫酸,有白色沉淀生成。
| A.NaHCO3、NaOH | B.AgCl、NaNO3 | C.K2CO3、Ba(NO3)2 | D.KOH、CuSO4 |
您最近一年使用:0次
2020-01-17更新
|
50次组卷
|
2卷引用:贵州省六盘水市第七中学2018-2019学年高一上学期期末考试化学试题
单选题
|
适中(0.65)
解题方法
14. 下列除杂(括号内为杂质)方案不正确 的是
| 选项 | 待提纯的物质 | 选用的试剂 | 操作的方法 |
| A. | NaCl(HCl) | — | 蒸发 |
| B. | Cu(CuO) | 稀硫酸 | 溶解、过滤、洗涤 |
| C. | SiO2(Al2O3) | 稀盐酸 | 溶解、过滤、洗涤 |
| D. | FeCl2(FeCl3) | 氢氧化钠溶液 | 溶解、过滤、洗涤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
15. 下列各组物质中,X既能与Y反应又能与Z反应的是
| Y | X | Z | |
| ① | H2O(g) | Fe | ZnSO4溶液 |
| ② | KOH溶液 | Al | 稀硫酸 |
| ③ | Si | Cl2 | H2 |
| ④ | 酸性高锰酸钾溶液 | Fe2+(aq) | 漂白液 |
| A.①③ | B.①④ | C.②③④ | D.②③ |
您最近一年使用:0次
单选题
|
适中(0.65)
16. 下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+具有氧化性 | Fe3+遇KSCN溶液变红 |
| B | Si是半导体材料 | 可用Si制备光导纤维 |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | 二氧化氯(ClO2)具有氧化性 | 可用ClO2代替Cl2作为自来水新型消毒剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
解题方法
17. 食盐是日常生活的必需品,也是重要的化工原料。粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提纯NaCl的流程如下:
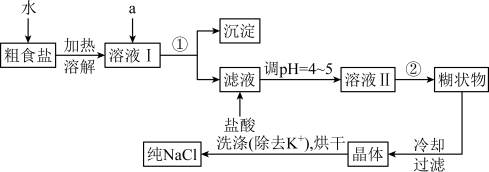
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇。
(1)在过滤过程中所需要的玻璃仪器有________________________________________ 。
(2)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42—,选出a所代表的试剂,按滴加顺序依次为_______ (只填化学式)。
(3)用于沉淀的试剂需过量,否则不能将杂质除尽,检验过滤的滤液中是否含有Fe3+的方法__________ ,过滤所得沉淀需要洗涤,洗涤沉淀的方法__________________ 。
(4)用提纯的NaCl配制成480ml 0.2mol•L-1的NaCl溶液,用托盘天平称取___________ g纯的NaCl晶体,用蒸馏水在_______________ 中溶解,完全溶解后,全部转移至________________ 中,加蒸馏水至______________________ 。

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇。
(1)在过滤过程中所需要的玻璃仪器有
(2)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42—,选出a所代表的试剂,按滴加顺序依次为
(3)用于沉淀的试剂需过量,否则不能将杂质除尽,检验过滤的滤液中是否含有Fe3+的方法
(4)用提纯的NaCl配制成480ml 0.2mol•L-1的NaCl溶液,用托盘天平称取
您最近一年使用:0次
解答题-工业流程题
|
较难(0.4)
解题方法
18. 某铝土矿中主要含有Al2O3、Al(OH)3还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如图所示:

请回答下列问题:
(1)粉碎后的铝土矿碱浸时应在较高温度下进行,其目的是____________________ 。滤渣1的主要成分为________________ 。
(2)Al2O3与NaOH溶液反应的离子方程式为____________________________________ 。
(3)加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的_________ 气体的方法来代替。(已知:通入该气体后,其产物之一可用来做发酵粉)。
(4)焙烧过程中发生的化学方程式为_________________________________ 。
(5)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化(即与少量熟石灰反应)反应除去,写出苛化反应的化学方程式:_________________________________________________ 。
(6)该生产流程能实现____________________ (填化学式)的循环利用。

请回答下列问题:
(1)粉碎后的铝土矿碱浸时应在较高温度下进行,其目的是
(2)Al2O3与NaOH溶液反应的离子方程式为
(3)加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的
(4)焙烧过程中发生的化学方程式为
(5)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化(即与少量熟石灰反应)反应除去,写出苛化反应的化学方程式:
(6)该生产流程能实现
您最近一年使用:0次
2020-01-17更新
|
301次组卷
|
2卷引用:贵州省六盘水市第七中学2018-2019学年高一上学期期末考试化学试题
19. 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜发生反应的化学方程式:______________________ 。
(2)某工程师为了从使用过的腐蚀废液(主要含CuCl2、FeCl3溶液等)中回收铜,并重新获得纯净的FeCl3溶液,准备采用如图所示流程:(已知:加过量①为Fe;加过量④为稀盐酸;通入⑥为Cl2)
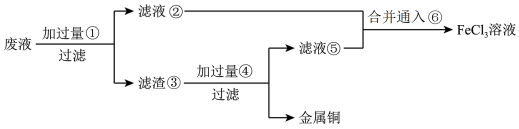
①上述实验中滤渣③的主要物质为___________________ (填化学式),写出向②⑤的合并液中通入⑥的离子方程式:______________________________ 。
②配制并保存FeCl2溶液时,需加入铁屑,其目的是_______________________________ 。
③要证明FeCl3溶液是否含有Fe2+,可选择下列选项中的______________ (已知:加入该物质后,生成蓝色沉淀)。
A.加入 K3[Fe(CN)6]溶液 B.加入NaOH溶液 C.加入KSCN溶液
(3)现有1.2 L含3 mol FeCl2的酸性溶液恰好与0.6 mol HIO3完全反应,还原产物为_______ (填化学式,已知该物质遇淀粉溶液变蓝),该反应离子方程式为___________________________________ 。
(1)写出FeCl3溶液与金属铜发生反应的化学方程式:
(2)某工程师为了从使用过的腐蚀废液(主要含CuCl2、FeCl3溶液等)中回收铜,并重新获得纯净的FeCl3溶液,准备采用如图所示流程:(已知:加过量①为Fe;加过量④为稀盐酸;通入⑥为Cl2)

①上述实验中滤渣③的主要物质为
②配制并保存FeCl2溶液时,需加入铁屑,其目的是
③要证明FeCl3溶液是否含有Fe2+,可选择下列选项中的
A.加入 K3[Fe(CN)6]溶液 B.加入NaOH溶液 C.加入KSCN溶液
(3)现有1.2 L含3 mol FeCl2的酸性溶液恰好与0.6 mol HIO3完全反应,还原产物为
您最近一年使用:0次
解答题-实验探究题
|
较难(0.4)
解题方法
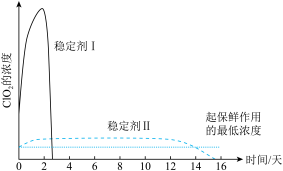
20. ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。(已知:装置C的作用是吸收Cl2)

(1)仪器B的名称是________ 。安装F中导管时,应选用图2中的_________________ 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O.为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜_______________ (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,NaClO2中Cl的化合价为______ 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为__________ 。
(5)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应离子方程式为___________________ 。(已知:在酸性条件下SO32-被ClO3-氧化为SO42-)
(6)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是__________ ,原因是________________ 。


(1)仪器B的名称是
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O.为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,NaClO2中Cl的化合价为
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(5)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应离子方程式为
(6)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、化学与STSE、化学实验基础、认识化学科学
试卷题型(共 20题)
题型
数量
单选题
16
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 硅酸的物理性质 Fe3+与其他物质氧化性强弱关系 乙醇的工业制法及用途 大气污染来源及危害 | |
| 2 | 0.65 | 化学实验基础操作 蒸馏与分馏 萃取和分液 | |
| 3 | 0.65 | 氯气的实验室制法 化学实验基础操作 配制一定物质的量浓度的溶液的步骤、操作 | |
| 4 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 依据物质的量浓度公式的基础计算 | |
| 5 | 0.65 | 胶体的定义及分类 胶体的性质和应用 胶体的制备 | |
| 6 | 0.65 | 离子反应的发生条件 离子方程式的书写 离子方程式的正误判断 限定条件下的离子共存 | |
| 7 | 0.65 | 氧化还原反应的几组概念 漂白粉和漂粉精的用途 二氧化硅的化学性质 氢氧化铝的物理性质及用途 | |
| 8 | 0.65 | 氧化还原反应的几组概念 氯气与还原性化合物的反应 过氧化钠和二氧化碳反应 氢氧化铝的制备 | |
| 9 | 0.85 | 钠与氧气等非金属的反应 铝制品日常使用的注意事项 | |
| 10 | 0.65 | 硅酸钠与酸液反应 碳酸钠与盐酸的反应 | |
| 11 | 0.65 | 氯气与碱溶液反应 铝与强碱溶液反应 铁与铁离子反应 | |
| 12 | 0.65 | 氯气的用途 二氧化硅的化学性质 硅酸钠的俗名和用途 碳酸钠与碳酸氢钠性质的比较 | |
| 13 | 0.65 | 离子反应在化合物组成的分析、鉴定的应用 常见阴离子的检验 | |
| 14 | 0.65 | 物质分离、提纯的常见化学方法 物质分离、提纯综合应用 | |
| 15 | 0.65 | 氯气与非金属单质的反应 铝与酸溶液反应 铝与强碱溶液反应 Fe2+的还原性 | |
| 16 | 0.65 | 二氧化硅的用途 碳酸钠与碳酸氢钠性质的比较 铁盐的检验 Fe3+与其他物质氧化性强弱关系 | |
| 二、解答题 | |||
| 17 | 0.65 | 配制一定物质的量浓度的溶液的步骤、操作 物质分离、提纯的常见化学方法 物质分离、提纯综合应用 过滤 | 实验探究题 |
| 18 | 0.4 | 氧化铝与碱溶液反应 偏铝酸钠与二氧化碳的反应 铝土矿提取铝的综合考查 物质分离、提纯综合应用 | 工业流程题 |
| 19 | 0.4 | 有关铁及其化合物转化的流程题型 Fe2+的鉴别及其应用 亚铁盐溶液的配制与保存 物质分离、提纯综合应用 | 实验探究题 |
| 20 | 0.4 | 离子方程式的书写 氯气与碱溶液反应 物质性质的探究 物质制备的探究 | 实验探究题 |



