名校
1 . 根据元素周期表和元素周期律判断下列结论正确的是( )
| A.氧化性:C12>S>Se>Te |
| B.离子的还原性:S2->C1->Br->I- |
| C.酸性:H2SO4>HClO4>H2SeO4 |
| D.离子半径:K+>Ca2+>C1->S2- |
您最近一年使用:0次
2020-07-12更新
|
227次组卷
|
5卷引用:贵州省思南中学2019-2020学年高二下学期期末考试化学试题
解题方法
2 . 磷酸二氢钾(KH2PO4)是一种重要的化工产品,工业上常用作缓冲剂和培养剂;农业上常用作复合肥料。以氟磷灰石[主要成分为Ca5F(PO4)3还含有少量的Fe2O3、Al2O3等杂质]为原料制备KH2PO4晶体的一种流程如下:

回答下列问题:
(1)已知“酸浸”时的一个反应为Ca5F(PO4)3+ 5H2SO4(浓)= 5CaSO4+3H3PO4 + HF↑,该反应利用浓硫酸的_______ (填“氧化性”“还原性”“强酸性”或“难挥发性" );“酸浸"过程所用的仪器不能采用二氧化硅陶瓷材料,其主要原因是(用化学方程式表示)__ ;
(2)已知物质A为CaCO3,则“废渣I”的主要成分为______ ;
(3)“反应II”的化学方程式为_____ ;
(4)将经过一系列除杂后得到的KH2PO4滤液加热浓缩,边加热边搅拌,待____ 时停止加热,冷却结晶,____ 、洗涤、干燥 ,得到KH2PO4晶体。
(5)常温下,H3PO4的电离平衡常数:Ka1=7.1 x10-3,Ka2 =6.3 x10-8 , Ka3=4.5x10-13。常温下,KH2PO4水溶液显酸性,请通过计算说明其原因_______ ;
(6)用电解法制取KH2PO4的装置如图所示。该电解装置中,a区属于___ (填“阳极"或“阴极")区,阳极区的电极反应式为__ 。


回答下列问题:
(1)已知“酸浸”时的一个反应为Ca5F(PO4)3+ 5H2SO4(浓)= 5CaSO4+3H3PO4 + HF↑,该反应利用浓硫酸的
(2)已知物质A为CaCO3,则“废渣I”的主要成分为
(3)“反应II”的化学方程式为
(4)将经过一系列除杂后得到的KH2PO4滤液加热浓缩,边加热边搅拌,待
(5)常温下,H3PO4的电离平衡常数:Ka1=7.1 x10-3,Ka2 =6.3 x10-8 , Ka3=4.5x10-13。常温下,KH2PO4水溶液显酸性,请通过计算说明其原因
(6)用电解法制取KH2PO4的装置如图所示。该电解装置中,a区属于

您最近一年使用:0次
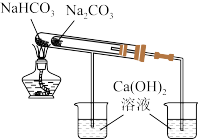
3 . 实验是学习化学的重要途径。下列装置或操作能达到实验目的的是
A | B | C | D |
|
|
|
|
比较 和 和 的热稳定性 的热稳定性 | 验证浓硫酸的脱水性、强氧化性 的漂白性、还原性 的漂白性、还原性 | 制取并收集干燥纯净的 | 用氢氧化钠标准液测定盐酸的浓度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-29更新
|
138次组卷
|
2卷引用:贵州省黔东南苗族侗族自治州)2021-2022学年高二下学期期末联考化学试题
解题方法
4 . 硼位于IIIA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
查阅资料:①BCl3的沸点为12.5℃,熔点为-107.3℃;②2B+6HCl 2BCl3↑+3H2↑。
2BCl3↑+3H2↑。
设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼:

请回答下列问题:
(1)装置A盛装浓盐酸的仪器名称为_______ 。
(2)A中主要反应的化学方程式为:______ 。
(3)E装置的作用_____ ,装置F的作用是______ 、______ 。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:_____ 。
(5)装置B中若采用玻璃管,则制得的BCl3中常含有SiCl4(SiCl4)的熔点为-70℃,沸点为57.6℃)等杂质,可采用____ 的方法提纯BCl3。
查阅资料:①BCl3的沸点为12.5℃,熔点为-107.3℃;②2B+6HCl
 2BCl3↑+3H2↑。
2BCl3↑+3H2↑。设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼:

请回答下列问题:
(1)装置A盛装浓盐酸的仪器名称为
(2)A中主要反应的化学方程式为:
(3)E装置的作用
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:
(5)装置B中若采用玻璃管,则制得的BCl3中常含有SiCl4(SiCl4)的熔点为-70℃,沸点为57.6℃)等杂质,可采用
您最近一年使用:0次
5 . 下列变化规律中正确的是
| A.金属Na、Mg、A1熔、沸点由高到低 |
| B.HCl、HBr、HI的还原性由强到弱 |
| C.H+、Li+、H﹣的半径由小到大 |
| D.同浓度的硫酸钠、醋酸钠、碳酸钠溶液的碱性由强到弱 |
您最近一年使用:0次
6 . 草酸亚铁晶体( FeC2O4·2H2O)是一种淡黄色粉末,可用作照相显影剂。某课外小组利用如下实验装置对草酸亚铁晶体分解产物进行探究,并设计实验测定草酸亚铁晶体样品纯度。
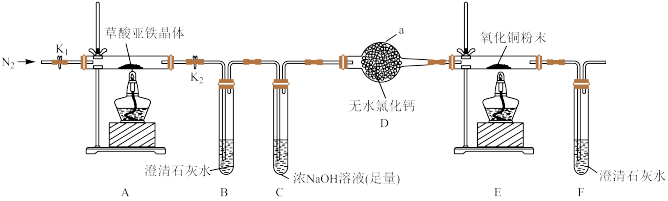
回答下列问题:
(1)仪器a的名称为_____ ;装置B中澄清石灰水变浑浊,说明气体分解产物中含有_____ ;
(2)实验前先通一段时间N2目的是________ ;装置C中浓NaOH溶液的作用是______ ;
(3)证明草酸亚铁晶体分解产物中含有CO的实验现象是______ ;
(4)充分反应后,将装置A硬质玻璃管中的残留固体溶于足量的稀硫酸中,无气泡产生,滴加几滴KSCN溶液,溶液不变红,说明固体分解产物是______ (填化学式);根据上述实验现象写出草酸亚铁晶体分解的化学方程式_______ ;
(5)所给实验装置存在明显的设计缺陷,该缺陷是______ ;
(6)草酸亚铁晶体样品纯度的测定:准确称取12. 000 g某草酸亚铁晶体样品,在一定条件下溶于稍过量的硫酸中,配成250 mL溶液。取25.00 mL上述溶液,用0.100 mol/L KMnO4标准溶液滴定,达到滴定终点时, 消耗35.00 mL KMnO4标准溶液,滴定反应为:FeC2O4·2H2O + KMnO4+ H2SO4→Fe2(SO4)3+CO2↑+ MnSO4 + K2SO4 + H2O(未配平)。则该草酸亚铁晶体样品的纯度为________ (已知该草酸亚铁晶体样品中不含其他与高锰酸钾反应的还原性杂质)。

回答下列问题:
(1)仪器a的名称为
(2)实验前先通一段时间N2目的是
(3)证明草酸亚铁晶体分解产物中含有CO的实验现象是
(4)充分反应后,将装置A硬质玻璃管中的残留固体溶于足量的稀硫酸中,无气泡产生,滴加几滴KSCN溶液,溶液不变红,说明固体分解产物是
(5)所给实验装置存在明显的设计缺陷,该缺陷是
(6)草酸亚铁晶体样品纯度的测定:准确称取12. 000 g某草酸亚铁晶体样品,在一定条件下溶于稍过量的硫酸中,配成250 mL溶液。取25.00 mL上述溶液,用0.100 mol/L KMnO4标准溶液滴定,达到滴定终点时, 消耗35.00 mL KMnO4标准溶液,滴定反应为:FeC2O4·2H2O + KMnO4+ H2SO4→Fe2(SO4)3+CO2↑+ MnSO4 + K2SO4 + H2O(未配平)。则该草酸亚铁晶体样品的纯度为
您最近一年使用:0次
解题方法
7 . “氯水是浅黄绿色的液体”,且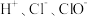 的水溶液均为无色,下列说法中正确的是
的水溶液均为无色,下列说法中正确的是
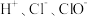 的水溶液均为无色,下列说法中正确的是
的水溶液均为无色,下列说法中正确的是A.氯水中的反应可表示为: |
| B.将氯水滴入KI溶液中,溶液变为棕黄色 |
C.氯水的漂白性是 的氧化性所致 的氧化性所致 |
| D.氯水在实验室中可以长期保存 |
您最近一年使用:0次
名校
解题方法
8 . A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。在短周期中A元素原子半径最小,D元素原子半径最大,B的简单氢化物的水溶液呈碱性,C、E同主族,形成的化合物为EC2、EC3。回答下列问题:
(1)E在元素周期表中的位置为_____________________________ 。
(2)比较B与C简单氢化物的热稳定性:_____ > 。(填化学式)
(3)D,C两元素组成的化合物D2C2的电子式为_____________________ ,D2C2与水反应的化学方程式为 ______________________________________________ 。
(4)下列事实能说明元素F的非金属性比元素E的非金属性强的是______ 。
A.元素F形成的单质比元素E形成的单质的熔点低
B.F和E两元素的简单氢化物受热分解,前者的分解温度高
C.F2通入到D2E的溶液中出现浑浊
D.F氢化物的酸性比E氢化物的酸性强
(1)E在元素周期表中的位置为
(2)比较B与C简单氢化物的热稳定性:
(3)D,C两元素组成的化合物D2C2的电子式为
(4)下列事实能说明元素F的非金属性比元素E的非金属性强的是
A.元素F形成的单质比元素E形成的单质的熔点低
B.F和E两元素的简单氢化物受热分解,前者的分解温度高
C.F2通入到D2E的溶液中出现浑浊
D.F氢化物的酸性比E氢化物的酸性强
您最近一年使用:0次
2018-10-29更新
|
367次组卷
|
3卷引用:贵州省思南中学2019-2020学年高二下学期期末考试化学试题
名校
9 . X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表:
(1)Q在元素周期表中的位置是______ .
(2)Y与R相比,非金属性较强的是________ (用元素符号表示),下列事实能证明这一结论的是______ (填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:HR>YH4
c.Y与R形成的化的中Y呈正价
(3)根据表中数据推测,Y的原子半径的最小范围是______ .
(4)甲、乙是上述某些元素的最高价氧化物对应的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是______ .
(5)已知1molXM2(g)被氧化为1molXM3(g)的△H=﹣99kJ/mol.写出由XM2生成XM3的热化学反应方程式________ 。
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.099 | 0.186 | 0.074 | 0.143 | ||
| 主要化合价 | +4,-4 | -2 | -1,+7 | +3 | ||
| 其他 | 常温下为黄色固体 | 无机非金属材料的主角 | 颜色反应为黄色 | 其氧化物可做耐火材料 |
(2)Y与R相比,非金属性较强的是
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:HR>YH4
c.Y与R形成的化的中Y呈正价
(3)根据表中数据推测,Y的原子半径的最小范围是
(4)甲、乙是上述某些元素的最高价氧化物对应的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是
(5)已知1molXM2(g)被氧化为1molXM3(g)的△H=﹣99kJ/mol.写出由XM2生成XM3的热化学反应方程式
您最近一年使用:0次
2017-07-21更新
|
314次组卷
|
2卷引用:贵州省思南中学2016-2017学年高二下学期期末考试化学试题
13-14高一下·全国·课时练习
10 . 下列叙述中能表明金属甲的活动性比金属乙的活动性强的是( )
| A.在氧化还原反应中,甲失电子数比乙多 |
| B.同价态阳离子甲比乙氧化性强 |
| C.甲与盐酸缓慢反应放出氢气,而乙能与冷水剧烈反应放出氢气 |
| D.甲、乙与硫酸溶液形成原电池,乙上冒气泡 |
您最近一年使用:0次
2016-12-09更新
|
1387次组卷
|
6卷引用:贵州省剑河县二中2018-2019学年高二上学期期末考试化学试题