名校
1 . 2021年《科学》杂志刊登了用 为原料,不依赖光合作用,可人工合成淀粉,其前两步的合成路线如下。用
为原料,不依赖光合作用,可人工合成淀粉,其前两步的合成路线如下。用 表示阿伏加德罗常数值,下列说法正确的是。
表示阿伏加德罗常数值,下列说法正确的是。

 为原料,不依赖光合作用,可人工合成淀粉,其前两步的合成路线如下。用
为原料,不依赖光合作用,可人工合成淀粉,其前两步的合成路线如下。用 表示阿伏加德罗常数值,下列说法正确的是。
表示阿伏加德罗常数值,下列说法正确的是。
A. 中含有σ键的数目为 中含有σ键的数目为 |
B. 的甲醇水溶液中含有的 的甲醇水溶液中含有的 数为 数为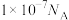 |
C.步骤Ⅱ中每消耗 转移的电子数为 转移的电子数为 |
D.90g甲醛和葡萄糖的混合物中含有的氧原子数为 |
您最近一年使用:0次
2023-02-03更新
|
479次组卷
|
2卷引用:广东省茂名市第一中学2022-2023学年高三上学期期末化学诊断检测题
名校
解题方法
2 . 内酯Y可由X通过电解合成,并在一定条件下转化为Z,转化路线如图:


下列说法正确的是


下列说法正确的是
| A.X苯环上的一氯代物一定有9种 |
| B.X→Y的反应类型为还原反应 |
| C.X、Y、Z都能与碳酸氢钠溶液反应. |
| D.X、Y、Z分子中均至少有9个碳原子共面 |
您最近一年使用:0次
2022-08-20更新
|
674次组卷
|
6卷引用:陕西省咸阳市2022届高考模拟检测(二模)理科综合化学试题
陕西省咸阳市2022届高考模拟检测(二模)理科综合化学试题(已下线)化学-2022年高考考前押题密卷(江苏卷)山西省太原市第五中学校2022-2023学年高三上学期期末考试化学试题(已下线)狂飙卷 03 -【热题狂飙】2023年高考化学样卷(全国卷专用)湖南衡阳名校2024届高三一轮复习12月第2周周练 化学试题福建省泉州市永春第一中学2021-2022学年高二下学期4月线上考试化学试题
2021高三·全国·专题练习
名校
解题方法
3 . 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理___________ (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是___________ ,反应的离子方程式为___________ 。
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是___________ (填化学式)。该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由:___________ 。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是
您最近一年使用:0次
2023高三·全国·专题练习
4 . 以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:
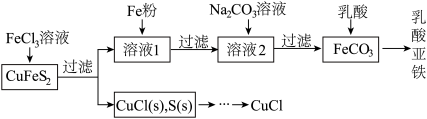
FeCl3溶液与黄铜矿发生反应的离子方程式为___________

FeCl3溶液与黄铜矿发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 三氯化六氨合钴(III)([Co(NH3)6]Cl3,钴为+3价)在钴化合物的合成中是重要原料。实验室以CoCl2为原料制备[Co(NH3)6]Cl3,步骤如下:
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。
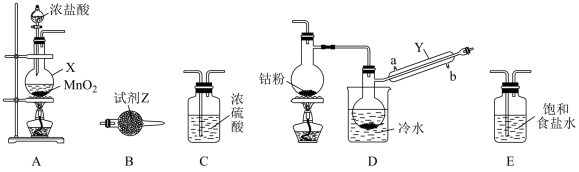
(1)仪器X的名称为____ 。
(2)X中发生反应的离子方程式为____ 。
(3)装置的连接顺序为A→____ →B;反应开始前应先点燃A处的酒精灯,其目的是___ 。
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是____ 。
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为____ 。
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
则该氧化还原滴定指示剂为____ ,该样品中钴元素的质量分数为____ 。
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。

(1)仪器X的名称为
(2)X中发生反应的离子方程式为
(3)装置的连接顺序为A→
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O
 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。则该氧化还原滴定指示剂为
您最近一年使用:0次
2022-09-20更新
|
246次组卷
|
2卷引用:河南省确山县第二高级中学2021-2022学年高三上学期期中考试化学试题
解题方法
6 . 镍是一种常用的有机合成催化剂。某工厂以含镍废料(主要成分含NiO,还含少量Fe3O4、SiO2、CaO和Al2O3等)原料制备镍的流程如下:

回答下列问题:
(1)“酸浸”选30%硫酸,滤渣1的主要成分是___________ (填化学式)。
(2)“氧化”过程中加入NaClO或H2O2,发现达到等量氧化效率,实际用量m(H2O2)>m(NaClO),可能的原因是___________ 。
(3)“滤渣2”经一系列操作可获得AlC13∙6H2O,将AlCl3∙6H2O和SOCl2共热可得到无水AlCl3,写出总反应的化学方程式___________ 。
(4)“调pH”的合适试剂是___________ (填字母序号)。
a.NaOH b.NiO c.NH3∙H2O d.Ni(OH)2
(5)检验滤液2是否含Fe3+的简易方法:___________ 。
(6)“还原”过程使用试剂为NaOH和N2H4,氧化产物为N2,.N2H4的电子式为___________ ;还原过程中发生反应的离子方程式为___________ 。
(7)测定镍样品纯度:取mg镍样品完全溶于稀硫酸中,加入V1 mLc mol∙L−1的EDTA溶液,使Ni2+完全络合,煮沸,加入6滴PAN作指示剂,趁热用c mol∙L−1 CuSO4溶液滴定过量的EDTA,当滴定至溶液呈紫红色时,到达滴定终点,消耗CuSO4溶液为V2 mL(假设杂质不参与反应)。该镍样品纯度为___________ %。已知滴定反应:Ni2++ EDTA =EDTA-Ni2+,Cu2++EDTA =EDTA-Cu2+。如果滴定管没有用待装溶液润洗,测定结果___________ (填“偏高”‘偏低”或“无影响”)。

回答下列问题:
(1)“酸浸”选30%硫酸,滤渣1的主要成分是
(2)“氧化”过程中加入NaClO或H2O2,发现达到等量氧化效率,实际用量m(H2O2)>m(NaClO),可能的原因是
(3)“滤渣2”经一系列操作可获得AlC13∙6H2O,将AlCl3∙6H2O和SOCl2共热可得到无水AlCl3,写出总反应的化学方程式
(4)“调pH”的合适试剂是
a.NaOH b.NiO c.NH3∙H2O d.Ni(OH)2
(5)检验滤液2是否含Fe3+的简易方法:
(6)“还原”过程使用试剂为NaOH和N2H4,氧化产物为N2,.N2H4的电子式为
(7)测定镍样品纯度:取mg镍样品完全溶于稀硫酸中,加入V1 mLc mol∙L−1的EDTA溶液,使Ni2+完全络合,煮沸,加入6滴PAN作指示剂,趁热用c mol∙L−1 CuSO4溶液滴定过量的EDTA,当滴定至溶液呈紫红色时,到达滴定终点,消耗CuSO4溶液为V2 mL(假设杂质不参与反应)。该镍样品纯度为
您最近一年使用:0次
7 . 亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为 -5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
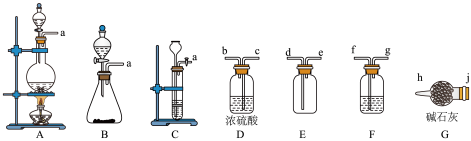
(1)制备 Cl2的发生装置可以选用_________ (填字母代号)装置,发生反应的离子方程式为________________________________________ 。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→_______ →______ → _____ →________ →_______ →______ →______ →______ 。(按气流方向,用小写字母表示,根据需要填,可以不填满,也可补充)。
(3)实验室可用下图示装置制备亚硝酰氯。其反应原理为:Cl2+2NO=2ClNO

①实验室也可用 B 装置制备 NO , X 装置的优点为___________________ 。
②检验装置气密性并装入药品,打开 K2,然后再打开 K3,通入一段时间气体,其目的是___________________ ,然后进行其他操作,当 Z 中有一定量液体生成时,停止实验。
(4)已知:ClNO 与 H2O 反应生成 HNO2和 HCl。
①设计实验证明 HNO2是弱酸:_________________________________________ 。(仅提供的试剂:1 mol•L-1盐酸、 1 mol•L-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO 样品的纯度。取 Z 中所得液体m g 溶于水,配制成 250 mL 溶液;取出 25.00 mL 样品溶于锥形瓶中,以 K2CrO4溶液为指示剂,用 c mol•L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 20.00mL。滴定终点的现象是_____ 亚硝酰氯(ClNO)的质量分数为 _________ 。(已知: Ag2CrO4 为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)

(1)制备 Cl2的发生装置可以选用
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→
(3)实验室可用下图示装置制备亚硝酰氯。其反应原理为:Cl2+2NO=2ClNO

①实验室也可用 B 装置制备 NO , X 装置的优点为
②检验装置气密性并装入药品,打开 K2,然后再打开 K3,通入一段时间气体,其目的是
(4)已知:ClNO 与 H2O 反应生成 HNO2和 HCl。
①设计实验证明 HNO2是弱酸:
②通过以下实验测定ClNO 样品的纯度。取 Z 中所得液体m g 溶于水,配制成 250 mL 溶液;取出 25.00 mL 样品溶于锥形瓶中,以 K2CrO4溶液为指示剂,用 c mol•L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 20.00mL。滴定终点的现象是
您最近一年使用:0次
2020-03-29更新
|
639次组卷
|
9卷引用:【区级联考】湖北省武汉市武昌区2019届高三下学期五月调研考试理科综合化学试题
名校
8 . 碳酸锰(MnCO3)是生产电讯器材用铁氧体的原料。利用软锰矿(主要成分为MnO2,还含有少量Al2O3和SiO2等杂质)合成碳酸锰的流程如下:

下列说法错误的是

下列说法错误的是
| A.“滤液1”的成分为NaAlO2、Na2SiO3和NaOH |
B.“沉锰”时发生的离子方程式为:Mn2++ =MnCO3+H+ =MnCO3+H+ |
| C.取最后一次洗涤液少许,滴加氯化钡可检验产品是否洗涤干净 |
| D.实验室中“过滤、洗涤”操作均用到漏斗 |
您最近一年使用:0次
9 . 氯化亚硝酰(NOC1,沸点为-5.5 °C )是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2 + HNO3 =AgNO3+ HNO2。
(1)将5g在300°C下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002 mol NO2。反应12~36 min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为____________ , 氯化钾需要“干燥”的原因是_____________ 。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。
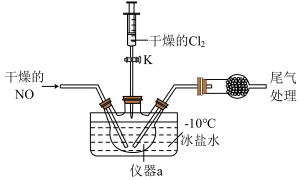
①仪器a的名称为__________ 。
②干燥管中盛放的试剂为____________ 。
③生成NOCl的化学方程式为________________ 。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
(1)将5g在300°C下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002 mol NO2。反应12~36 min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。

①仪器a的名称为
②干燥管中盛放的试剂为
③生成NOCl的化学方程式为
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
| 步骤 | 实验现象或反应的化学方程式 |
| ①取5ml三颈烧瓶中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O发应的化学方程式 |
| ②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为 |
| ③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为 |
您最近一年使用:0次
10 . 硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施_____ (写出两条)。
(2)利用_____ 的磁性,可将其从“浸渣”中分离。
(3)“净化除杂”需先加H2O2溶液,作用是___ 。
(4)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______ 。

回答下列问题:
(1)为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施
(2)利用
(3)“净化除杂”需先加H2O2溶液,作用是
(4)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为
您最近一年使用:0次



