1 . 配方是 Minecraft 中重要的组成部分。定义工作台的九宫格为3*3的二维矩阵,每一格记为Box[X][Y],其中X、Y∈[0,2]且X、Y为整数,设左上角是Box[0][0]。同时定义三种配方模型:“铁块模型”、“台阶模型”和“石砖模型”,已知三种模型如下图所示(红色填充表示选中),若配方中有超过50%的物质能够与相邻物质反应,则认为此配方为“无效配方”,反之为“有效配方”。则在下列各组配方中,是“无效配方”的是
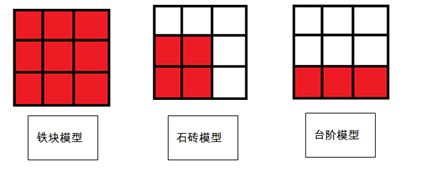

| A.台阶模型: Box[2][0]=KCl Box[2][1]=CO  Box[2][2]=NaOH Box[2][2]=NaOH |
| B.石砖模型: Box[1][0]=Fe2+ Box[1][1]=HNO3 Box[2][0]=SCN- Box[2][1]=Cu2+ |
| C.铁块模型: Box[0][0]=石蕊溶液 Box[0][1]=Ca2+ Box[0][2]=H2O2 Box[1][0]=SO  Box[1][1]=Ba2+ Box[1][2]=SO Box[1][1]=Ba2+ Box[1][2]=SO Box[2][0]=OH- Box[2][1]=CO  Box[2][2]=K+ Box[2][2]=K+ |
| D.石砖模型: Box[1][0]=OH- Box[1][1]=Al(OH)3 Box[2][0]=酚酞溶液 Box[2][1]=HCO  |
您最近半年使用:0次
名校
解题方法
2 . 已知:将Cl2通入适量NaOH溶液中,反应会放热,当温度升高后会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O。则Cl2通入NaOH溶液的产物中可能有NaCl、NaClO、NaClO3中的两种或三种,且 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是| A.与碱的反应中,Cl2既是氧化剂又是还原剂 |
| B.参加反应的Cl2物质的量为0.5a mol |
C.若某温度下,反应后 =6,则溶液中 =6,则溶液中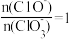 |
D.改变温度,反应中转移电子的物质的量可能为 mol mol |
您最近半年使用:0次
2022-10-24更新
|
2057次组卷
|
12卷引用:江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题
江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题山东省实验中学2022-2023学年高一上学期11月期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题北京市第八中学2022-2023学年高一上学期12月月考化学试题陕西省榆林中学2022-2023学年高一上学期期末考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
名校
解题方法
3 . 经实验发现,溶液几乎都有丁达尔效应(粒子对光的散射现象),且丁达尔现象随其浓度升高逐渐增强,胶体的丁达尔现象比溶液的强。现用以下装置区别 溶液和
溶液和 胶体,下列说法不正确的是。
胶体,下列说法不正确的是。

 溶液和
溶液和 胶体,下列说法不正确的是。
胶体,下列说法不正确的是。
| A.溶液靠近光源时,溶液和胶体均有明显的丁达尔现象 |
| B.胶体靠近光源时,胶体有明显的丁达尔现象,溶液无明显现象 |
| C.通过溶液、胶体互换位置,出现二次丁达尔现象的为溶液,只出现一次丁达尔现象的为胶体 |
| D.通过溶液、胶体互换位置,只出现一次丁达尔现象的为溶液,出现二次丁达尔现象的为胶体 |
您最近半年使用:0次
2022-10-19更新
|
1066次组卷
|
3卷引用:江苏省赣榆高级中学2022-2023学年高三上学期10月学情检测化学试题
4 . Ⅰ.某废水中可能大量含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、 、
、 、
、 、
、 、
、 。现进行如下实验:
。现进行如下实验:
①取少量溶液,加入KSCN溶液,无明显变化
②另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
③向②中所得溶液中加入BaCl2溶液,有白色沉淀生成
④向②中所得溶液中加入过量浓氨水,仅有红褐色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
请回答下列问题:
(1)该废水一定含有的阳离子是_______ ;
(2)实验Ⅱ中无色气体遇空气变成红棕色的化学方程式是_______ ;
(3)过滤除去Ⅳ中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为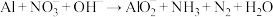 (未配平)。若除去1mol
(未配平)。若除去1mol ,消耗铝
,消耗铝_______ g。
Ⅱ.某混合液中,可能大量含有的离子如下表:
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入的物质的量的关系分别如图所示:
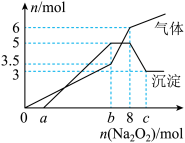
(4)写出加入 与水反应的离子方程式
与水反应的离子方程式_______ 。
(5)该溶液中一定含有的阳离子是_______ ,其对应物质的量浓度之比为_______ ,溶液中可能大量存在的阴离子是_______ 。
 、
、 、
、 、
、 、
、 。现进行如下实验:
。现进行如下实验:①取少量溶液,加入KSCN溶液,无明显变化
②另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
③向②中所得溶液中加入BaCl2溶液,有白色沉淀生成
④向②中所得溶液中加入过量浓氨水,仅有红褐色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
请回答下列问题:
(1)该废水一定含有的阳离子是
(2)实验Ⅱ中无色气体遇空气变成红棕色的化学方程式是
(3)过滤除去Ⅳ中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为
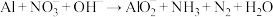 (未配平)。若除去1mol
(未配平)。若除去1mol ,消耗铝
,消耗铝Ⅱ.某混合液中,可能大量含有的离子如下表:
| 阳离子 | 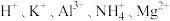 |
| 阴离子 |  |

(4)写出加入
 与水反应的离子方程式
与水反应的离子方程式(5)该溶液中一定含有的阳离子是
您最近半年使用:0次
2022-10-09更新
|
727次组卷
|
3卷引用:江西省上饶市、景德镇市六校2022-2023学年高三上学期10月联考化学试题
解题方法
5 . 一种测定黄铁矿(主要成分为FeS2,杂质不含硫)中硫含量的实验原理及步骤如下:

已知:I.2FeS2+15Na2O2 Fe2(SO4)3+Na2SO4+14Na2O;
Fe2(SO4)3+Na2SO4+14Na2O;
II.Pb2++ =PbSO4↓;
=PbSO4↓;
III.Pb2++H2Y2-=PbY2-+2H+。
回答下列问题:
(1)“氧化焙烧”时,每1molFeS2被完全氧化,转移电子的物质的量为_______ mol。
(2)已知KClO3氧化FeS2的反应速率更快,化学方程式为2FeS2+6KClO3 Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为
Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为_______ 。
(3)为保证黄铁矿充分氧化,“氯化焙烧”前需要采取的措施是_______ 。
(4)滴定分析步骤如下:
步骤1.浊液A静置后,取上层清液10.00mL,放入锥形瓶中,加适量水稀释;
步骤2.用硝酸调整其pH为3~4,滴入0.05mol·L-1的Pb(NO3)2标准溶液20.00mL,加热至充分反应;
步骤3.冷却、过滤、洗涤,将洗涤液与滤液合并;
步骤4.控制滤液pH约为5,加入指示剂,用cmol·L-1的H2Y2-(EDTA溶液)标准溶液滴定过量的Pb2+,滴定至终点时,消耗H2Y2-标准溶液VmL。
①在规格为50.00mL的滴定管中盛装H2Y2-溶液滴定时,若某一时刻的读数为15.00mL,此时滴定管中H2Y2-溶液的体积为_______ (填字母)。
a.15.00mL b.小于15.00mL c.35.00mL d.大于35.00mL
②黄铁矿中硫的质量分数为_______ (用含c、V的代数式表示)。
③下列情形下会使测得的硫的质量分数偏大的是_______ (填字母)。
a.步骤1锥形瓶洗净后,内部有少量蒸馏水
b.步骤2控制的pH较大,产生了少量碱式碳酸铅沉淀
c.步骤3沉淀未用蒸馏水充分洗涤
d.步骤4起始读数时平视。终点时仰视

已知:I.2FeS2+15Na2O2
 Fe2(SO4)3+Na2SO4+14Na2O;
Fe2(SO4)3+Na2SO4+14Na2O;II.Pb2++
 =PbSO4↓;
=PbSO4↓;III.Pb2++H2Y2-=PbY2-+2H+。
回答下列问题:
(1)“氧化焙烧”时,每1molFeS2被完全氧化,转移电子的物质的量为
(2)已知KClO3氧化FeS2的反应速率更快,化学方程式为2FeS2+6KClO3
 Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为
Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为(3)为保证黄铁矿充分氧化,“氯化焙烧”前需要采取的措施是
(4)滴定分析步骤如下:
步骤1.浊液A静置后,取上层清液10.00mL,放入锥形瓶中,加适量水稀释;
步骤2.用硝酸调整其pH为3~4,滴入0.05mol·L-1的Pb(NO3)2标准溶液20.00mL,加热至充分反应;
步骤3.冷却、过滤、洗涤,将洗涤液与滤液合并;
步骤4.控制滤液pH约为5,加入指示剂,用cmol·L-1的H2Y2-(EDTA溶液)标准溶液滴定过量的Pb2+,滴定至终点时,消耗H2Y2-标准溶液VmL。
①在规格为50.00mL的滴定管中盛装H2Y2-溶液滴定时,若某一时刻的读数为15.00mL,此时滴定管中H2Y2-溶液的体积为
a.15.00mL b.小于15.00mL c.35.00mL d.大于35.00mL
②黄铁矿中硫的质量分数为
③下列情形下会使测得的硫的质量分数偏大的是
a.步骤1锥形瓶洗净后,内部有少量蒸馏水
b.步骤2控制的pH较大,产生了少量碱式碳酸铅沉淀
c.步骤3沉淀未用蒸馏水充分洗涤
d.步骤4起始读数时平视。终点时仰视
您最近半年使用:0次
6 . 为研究二氧化碳与氢氧化钠溶液的反应,某同学利用压强传感器和 传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)
传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)

(1)设计实验乙的目的是_______ 。
(2)图丙中曲线_______ (选填“Ⅰ”或“Ⅱ”)表示 和NaOH溶液的反应。
和NaOH溶液的反应。
(3)两烧瓶中的压强在开始阶段均增大的原因是_______ 。
该同学利用下图所示装置测定上述实验甲中反应后烧瓶内溶液中碳酸钠的质量分数。
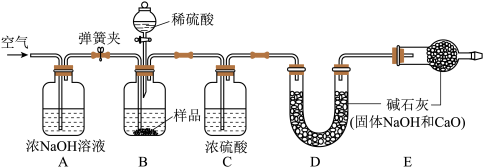
(4)实验需要以下步骤:
①称量装置D的质量为304.6g;
②取10g实验甲烧瓶内反应后的溶液装入装置B中;
③连接装置,检查装置气密性;
④打开弹簧夹,缓缓鼓入一段时间空气:
⑤再次称量D的质量为307.9g;
⑥打开弹簧夹a,再次缓缓鼓入一段时间空气;
⑦关闭弹簧夹a,滴加稀硫酸使其发生反应,直至不再产生气泡为止;
写出以上步骤的正确顺序_______ (用步骤编号表示)。
(5)E装置的作用是_______ 。
(6)打开弹簧夹a,再次缓缓鼓入一段时间空气的目的是_______ 。
(7)根据相关数据,图甲反应后烧瓶内溶液中碳酸钠的质量分数为_______ 。
 传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)
传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)
(1)设计实验乙的目的是
(2)图丙中曲线
 和NaOH溶液的反应。
和NaOH溶液的反应。(3)两烧瓶中的压强在开始阶段均增大的原因是
该同学利用下图所示装置测定上述实验甲中反应后烧瓶内溶液中碳酸钠的质量分数。

(4)实验需要以下步骤:
①称量装置D的质量为304.6g;
②取10g实验甲烧瓶内反应后的溶液装入装置B中;
③连接装置,检查装置气密性;
④打开弹簧夹,缓缓鼓入一段时间空气:
⑤再次称量D的质量为307.9g;
⑥打开弹簧夹a,再次缓缓鼓入一段时间空气;
⑦关闭弹簧夹a,滴加稀硫酸使其发生反应,直至不再产生气泡为止;
写出以上步骤的正确顺序
(5)E装置的作用是
(6)打开弹簧夹a,再次缓缓鼓入一段时间空气的目的是
(7)根据相关数据,图甲反应后烧瓶内溶液中碳酸钠的质量分数为
您最近半年使用:0次
解题方法
7 . W、X、Y、Z元素的原子序数依次增大,W、Y的最外层电子数之和等于X的内层电子数,W、Z的质子数之和与X、Y的质子数之和的差等于X的最外层电子数;W、Z形成的单质是生产、生活中应用最广的两种金属。回答下列问题:
(1)Z元素在元素周期表中的位置为_______ 。
(2)Z形成的单质与水蒸气在高温下反应,生成的固体产物与W形成的单质在高温下也可反应,则后一个反应的还原剂与还原产物的物质的量之比为_______ 。
(3)用电子式表示X形成化合物H2X的过程:_______ 。
(4)Z形成的最高价含氧酸盐具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是
,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是_______ 。
(5)写出能体现X、Y金属性或非金属性强弱的方法:_______ (用化学方程式表示)。
(1)Z元素在元素周期表中的位置为
(2)Z形成的单质与水蒸气在高温下反应,生成的固体产物与W形成的单质在高温下也可反应,则后一个反应的还原剂与还原产物的物质的量之比为
(3)用电子式表示X形成化合物H2X的过程:
(4)Z形成的最高价含氧酸盐具有强氧化性,在酸性或中性溶液中快速产生
 ,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是
,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是(5)写出能体现X、Y金属性或非金属性强弱的方法:
您最近半年使用:0次
2022-09-29更新
|
885次组卷
|
2卷引用:河南省豫北名校普高联考2022-2023学年上学期高三测评(一)化学试题
8 . 铬是硬度最高的金属,常用于制造不锈钢和仪器仪表的金属表面镀铬,其化合物也有广泛应用。实验室模拟一种从铬铁矿(主要含Fe(CrO2)2、MgO、Al2O3)中提取铬的流程如图:
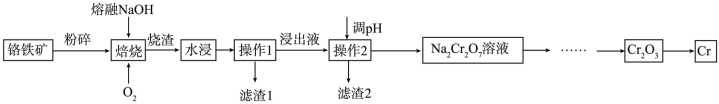
注:焙烧可将Al2O3转化为NaAlO2,滤渣1中有红棕色固体。
(1)铬铁矿经“粉碎”处理的目的是____ 。
(2)已知“浸出液”的主要成分为Na2CrO4,则“焙烧”过程被氧化的元素是___ (填元素符号)。
(3)滤渣1的主要成分有____ (填化学式)。
(4)“调pH”采取了通入CO2气体的方式,反应后滤渣2中有Al(OH)3和NaHCO3生成,则此过程中生成Na2Cr2O7的离子方程式为____ 。若用生成的NaHCO3替换焙烧过程中的NaOH使用,则此时焙烧阶段主要反应的化学方程式为____ 。
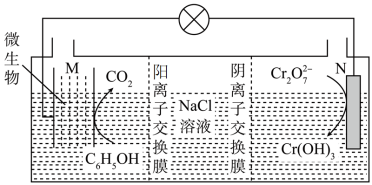
(5)一定温度下,利用Cr2O 可实现含苯酚废水的有效处理,工作原理如图所示,负极电极反应式为
可实现含苯酚废水的有效处理,工作原理如图所示,负极电极反应式为____ ,一段时间后N极附近溶液pH____ (填“增大”、“减小”或“不变”)。

注:焙烧可将Al2O3转化为NaAlO2,滤渣1中有红棕色固体。
(1)铬铁矿经“粉碎”处理的目的是
(2)已知“浸出液”的主要成分为Na2CrO4,则“焙烧”过程被氧化的元素是
(3)滤渣1的主要成分有
(4)“调pH”采取了通入CO2气体的方式,反应后滤渣2中有Al(OH)3和NaHCO3生成,则此过程中生成Na2Cr2O7的离子方程式为
(5)一定温度下,利用Cr2O
 可实现含苯酚废水的有效处理,工作原理如图所示,负极电极反应式为
可实现含苯酚废水的有效处理,工作原理如图所示,负极电极反应式为
您最近半年使用:0次
名校
解题方法
9 . 固体盐X由四种常见元素组成,其中仅含一种金属元素,有如图转化关系:
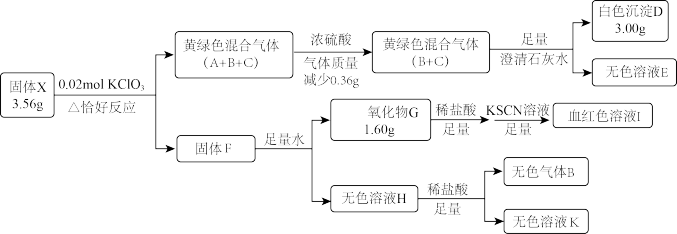
已知:H中溶质仅为一种常见正盐。黄绿色气体C密度为相同条件下H2的33.75倍。
请回答:
(1)X的组成元素为_______ ,固体F成分为_______ 。
(2)固体X在水中也可反应生成气体B,同时生成一种的相对较稳定的白色沉淀,请写出该反应化学方程式_______ 。
(3)气体C的化学式为_______ 。将气体C通入KOH溶液,微热,恰好完全反应,生成两种物质的量之比1∶5的盐,写出这两种盐的化学式_______ ,设计定量实验方案验证上述比例关系_______ 。(已知AgClO3溶于水,NaNO2能将ClO3-还原为Cl-)

已知:H中溶质仅为一种常见正盐。黄绿色气体C密度为相同条件下H2的33.75倍。
请回答:
(1)X的组成元素为
(2)固体X在水中也可反应生成气体B,同时生成一种的相对较稳定的白色沉淀,请写出该反应化学方程式
(3)气体C的化学式为
您最近半年使用:0次
22-23高一上·全国·课后作业
名校
解题方法
10 . 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL1mol·L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是
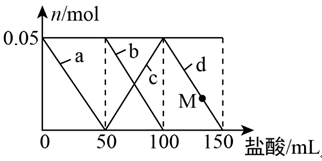
A.b曲线表示的离子方程式为:AlO +H++H2O=Al(OH)3↓ +H++H2O=Al(OH)3↓ |
| B.d和c曲线表示的离子反应是相同的 |
| C.M点时Al(OH)3的质量等于3.9g |
D.原混合溶液中的 与AlO 与AlO 的物质的量之比为1︰2 的物质的量之比为1︰2 |
您最近半年使用:0次



