解题方法
1 . 化学镀镍法得到的镀层均匀性,硬度等性能都较好,一种化学镀工艺流程如图所示:
②Ni(OH)2难溶于水;
③NaOH能稳定NaBH4,降低其水解率,NaBH4的水解反应:NaBH4+4H2O=Na[B(OH)4]+4H2;
若有3.0molNaBH4参与反应时,生成标准状况下8.96LH2,则理论上镀层增重
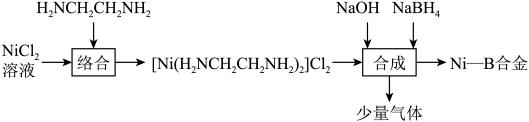
②Ni(OH)2难溶于水;
③NaOH能稳定NaBH4,降低其水解率,NaBH4的水解反应:NaBH4+4H2O=Na[B(OH)4]+4H2;
若有3.0molNaBH4参与反应时,生成标准状况下8.96LH2,则理论上镀层增重
| A.498.4g | B.684.4g | C.460g | D.515.6g |
您最近半年使用:0次
2 . 实验室用废铁屑制取无水氯化铁并测其纯度。实验方案如下:
Ⅰ. 制备
制备
①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)用NaOH溶液洗涤废铁屑的目的是_______ 。
(2)控制温度在40~50℃的原因是_______ 。
(3)滴加10%双氧水时,滴加速率过快会产生气泡。该气体为_______ 。
Ⅱ.无水 制备
制备
已知 熔点―156℃,沸点77℃,易水解生成
熔点―156℃,沸点77℃,易水解生成 和HCl。
和HCl。
(4)按图装置进行实验。锥形瓶中生成无水 的总化学方程式为
的总化学方程式为_______ ;仪器A的作用是_______ 。
(5)称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用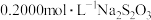 溶液滴定(
溶液滴定(
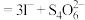 ),经三次平行实验,平均消耗
),经三次平行实验,平均消耗 溶液19.00ml。
溶液19.00ml。
①所制产品的纯度为_______ (以无水 质量分数表示,保留三位有效数字);
质量分数表示,保留三位有效数字);
②所制产品中可能含有 杂质,检验
杂质,检验 的试剂为
的试剂为_______ (填化学式)溶液;产生 的原因可能是
的原因可能是_______ 。
Ⅰ.
 制备
制备①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)用NaOH溶液洗涤废铁屑的目的是
(2)控制温度在40~50℃的原因是
(3)滴加10%双氧水时,滴加速率过快会产生气泡。该气体为
Ⅱ.无水
 制备
制备已知
 熔点―156℃,沸点77℃,易水解生成
熔点―156℃,沸点77℃,易水解生成 和HCl。
和HCl。(4)按图装置进行实验。锥形瓶中生成无水
 的总化学方程式为
的总化学方程式为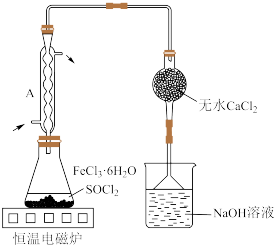
(5)称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用
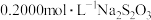 溶液滴定(
溶液滴定(
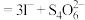 ),经三次平行实验,平均消耗
),经三次平行实验,平均消耗 溶液19.00ml。
溶液19.00ml。①所制产品的纯度为
 质量分数表示,保留三位有效数字);
质量分数表示,保留三位有效数字);②所制产品中可能含有
 杂质,检验
杂质,检验 的试剂为
的试剂为 的原因可能是
的原因可能是
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
3 . 探究pH对 溶液的配制和保存的影响。
溶液的配制和保存的影响。
I. 溶液的配制
溶液的配制
将 分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
II. 溶液的保存
溶液的保存
将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
(1)①中的浑浊主要是FeOOH,用离子方程式表示其生成过程_______ 。
(2)该实验的初步结论:保存 溶液的最佳pH是
溶液的最佳pH是_______ 。
(3)进一步探究pH对 变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后:
变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后: 接近2mol/L,电流没有明显变化;
接近2mol/L,电流没有明显变化;
ii.向右池滴加等量浓硫酸,电流明显增大。
已知:电流增大表明化学反应速率加快,在该实验条件下与物质的氧化性(还原性)增强有关。
a.结合电极反应式分析ii中电流增大的原因_______ 。
b.依据实验i和ii推断:③比②中 更易变质的原因是
更易变质的原因是_______ 。
c.按上述原理进行实验,证实①中 更易变质的主要原因是
更易变质的主要原因是 的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,_______ 。
 溶液的配制和保存的影响。
溶液的配制和保存的影响。I.
 溶液的配制
溶液的配制将
 分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:| 编号 | 溶剂 | 溶液性状 | |
| ① | 蒸馏水 | 浅黄色澄清溶液 |  ;滴加1mol/LKSCN溶液无明显变化 ;滴加1mol/LKSCN溶液无明显变化 |
| ② |  | 无色澄清溶液 |  ;滴加1mol/LKSCN溶液微微变红 ;滴加1mol/LKSCN溶液微微变红 |
| ③ |  | 无色澄清溶液 | 滴加1mol/LKSCN溶液微微变红 |
 溶液的保存
溶液的保存将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
| 编号 | 溶液性状 | |
| ① | 橙色浑浊 | 用 酸化后,浊液变澄清,再滴加1mol/LKSCN溶液后变深红 酸化后,浊液变澄清,再滴加1mol/LKSCN溶液后变深红 |
| ② | 无色溶液 | 滴加1mol/L的KSCN溶液后显浅红色 |
| ③ | 无色溶液 | 滴加1mol/L的KSCN溶液后显红色,颜色比②略深 |
(2)该实验的初步结论:保存
 溶液的最佳pH是
溶液的最佳pH是(3)进一步探究pH对
 变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后:
变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后: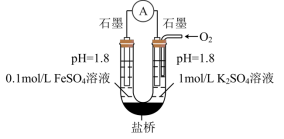
 接近2mol/L,电流没有明显变化;
接近2mol/L,电流没有明显变化;ii.向右池滴加等量浓硫酸,电流明显增大。
已知:电流增大表明化学反应速率加快,在该实验条件下与物质的氧化性(还原性)增强有关。
a.结合电极反应式分析ii中电流增大的原因
b.依据实验i和ii推断:③比②中
 更易变质的原因是
更易变质的原因是c.按上述原理进行实验,证实①中
 更易变质的主要原因是
更易变质的主要原因是 的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
您最近半年使用:0次
4 . 连二硫酸锰(MnS2O6,其中Mn为+2价)是一种常用的果蔬保鲜剂,易溶于水,室温下其水溶液在pH为2.8~3.5时最稳定。回答下列问题:
Ⅰ.制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。
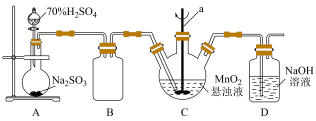
(1)仪器a的名称为________ ,装置B的作用是________ 。
(2)装置C中的反应温度需要控制在0℃左右,控制温度的方法是_______ 。实验时需要向C中通入稍过量的SO2,目的是________ 。
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为_______ ,判断反应完成的现象是_______ ,待反应结束后经除杂、减压蒸发浓缩、结晶可得产品MnS2O6•nH2O。
Ⅱ.测定产品中Mn的质量分数
称取ag产品充分加热使其分解为MnSO4,然后加水溶解,用cmol•L-1的KMnO4溶液进行滴定(Mn元素均转化为MnO2)。
(4)滴定时,发生反应的离子方程式为_______ ;若滴定消耗KMnO4溶液的体积为VmL,则产品中Mn的质量分数为_______ 。
(5)下列操作会使得测定结果偏大的是_______ 。
Ⅰ.制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。

(1)仪器a的名称为
(2)装置C中的反应温度需要控制在0℃左右,控制温度的方法是
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为
Ⅱ.测定产品中Mn的质量分数
称取ag产品充分加热使其分解为MnSO4,然后加水溶解,用cmol•L-1的KMnO4溶液进行滴定(Mn元素均转化为MnO2)。
(4)滴定时,发生反应的离子方程式为
(5)下列操作会使得测定结果偏大的是
| A.滴定前锥形瓶用蒸馏水洗后未用待测MnSO4溶液润洗 |
| B.滴定前平视读数,滴定结束俯视读数 |
| C.滴定前滴定管中尖嘴处有气泡,滴定后气泡消失 |
| D.对连二硫酸锰产品进行加热操作时加热不充分 |
您最近半年使用:0次
5 . 某校化学兴趣小组研究学校附近的空气质量,遇到了下列问题,请你帮助他们。
(1)甲组同学设计了如图所示的实验装置,对悬浮颗粒物、空气中 含量进行测定。A装置的名称为
含量进行测定。A装置的名称为___________ 。
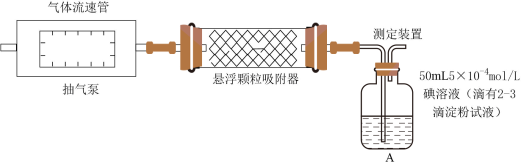
注:气体流速管是用来测量单位时间内通过气体的体积的装置
①用上述装置定量测定空气中的 和可吸入颗粒的含量,除测定气体流速(单位:cm3∙min-1)和反应所需时间外还需要的数据是
和可吸入颗粒的含量,除测定气体流速(单位:cm3∙min-1)和反应所需时间外还需要的数据是___________ 。
②已知:碘单质微溶于水, 可以增大碘在水中的溶解度。请你协助甲组同学完成
可以增大碘在水中的溶解度。请你协助甲组同学完成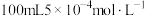 碘溶液的配制:
碘溶液的配制:
a.将容量瓶置于水平台面上,加入蒸馏水至距容量瓶刻度线1~2cm时,改用胶头滴管逐滴滴加,直至液体凹液面与刻度线相平。
b.用电子天平准确称取1.27g碘单质加入烧杯中,同时加入少量碘化钾固体,加水溶解后转入容量瓶中。
c.从上一步所得溶液中取出10.00mL溶液倒入烧杯中,加水稀释至100mL。
d.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液转入到1000mL容量瓶中。
合理的步骤顺序是___________ 。
(2)乙组同学拟用如图简易装置测定空气中的 含量:
含量:
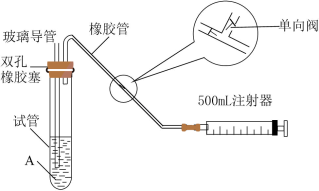
①检查该装置的气密性时,先在试管中装入适量的水(保证玻璃管的下端浸没在水中)。然后___________ (填写操作方法及实验现象),则证明该装置的气密性良好。
②测定指定地点空气中的 含量时,准确移取
含量时,准确移取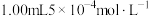 碘溶液,注入如图所示试管中。用适量的蒸馏水稀释后,再加2~3滴淀粉溶液,配制成溶液A.甲、乙两组同学分别使用如图所示相同的实验装置和溶液A,在同一地点、同时推拉注射器的活塞,反复抽气,直到溶液的蓝色全部褪尽为止停止抽气,记录抽气次数如下(假设每次抽气500mL)。
碘溶液,注入如图所示试管中。用适量的蒸馏水稀释后,再加2~3滴淀粉溶液,配制成溶液A.甲、乙两组同学分别使用如图所示相同的实验装置和溶液A,在同一地点、同时推拉注射器的活塞,反复抽气,直到溶液的蓝色全部褪尽为止停止抽气,记录抽气次数如下(假设每次抽气500mL)。
我国环境空气质量标准对空气质量测定中 的最高浓度限值如下表:
的最高浓度限值如下表:
经老师和同学们分析,甲组测定结果更为准确,则该地点的空气中 的含量为
的含量为___________ 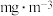 (保留2位有效数字),属于
(保留2位有效数字),属于___________ (填汉字)级标准。请你分析乙组实验结果产生较大偏差的原因是(两个小组所用装置和药品均无问题)___________ 。
(1)甲组同学设计了如图所示的实验装置,对悬浮颗粒物、空气中
 含量进行测定。A装置的名称为
含量进行测定。A装置的名称为
注:气体流速管是用来测量单位时间内通过气体的体积的装置
①用上述装置定量测定空气中的
 和可吸入颗粒的含量,除测定气体流速(单位:cm3∙min-1)和反应所需时间外还需要的数据是
和可吸入颗粒的含量,除测定气体流速(单位:cm3∙min-1)和反应所需时间外还需要的数据是②已知:碘单质微溶于水,
 可以增大碘在水中的溶解度。请你协助甲组同学完成
可以增大碘在水中的溶解度。请你协助甲组同学完成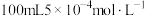 碘溶液的配制:
碘溶液的配制:a.将容量瓶置于水平台面上,加入蒸馏水至距容量瓶刻度线1~2cm时,改用胶头滴管逐滴滴加,直至液体凹液面与刻度线相平。
b.用电子天平准确称取1.27g碘单质加入烧杯中,同时加入少量碘化钾固体,加水溶解后转入容量瓶中。
c.从上一步所得溶液中取出10.00mL溶液倒入烧杯中,加水稀释至100mL。
d.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液转入到1000mL容量瓶中。
合理的步骤顺序是
(2)乙组同学拟用如图简易装置测定空气中的
 含量:
含量:
①检查该装置的气密性时,先在试管中装入适量的水(保证玻璃管的下端浸没在水中)。然后
②测定指定地点空气中的
 含量时,准确移取
含量时,准确移取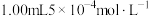 碘溶液,注入如图所示试管中。用适量的蒸馏水稀释后,再加2~3滴淀粉溶液,配制成溶液A.甲、乙两组同学分别使用如图所示相同的实验装置和溶液A,在同一地点、同时推拉注射器的活塞,反复抽气,直到溶液的蓝色全部褪尽为止停止抽气,记录抽气次数如下(假设每次抽气500mL)。
碘溶液,注入如图所示试管中。用适量的蒸馏水稀释后,再加2~3滴淀粉溶液,配制成溶液A.甲、乙两组同学分别使用如图所示相同的实验装置和溶液A,在同一地点、同时推拉注射器的活塞,反复抽气,直到溶液的蓝色全部褪尽为止停止抽气,记录抽气次数如下(假设每次抽气500mL)。| 分组 | 甲组 | 乙组 |
| 抽气次数 | 110 | 145 |
| 实验时长(min) | 6.5 | 4 |
 的最高浓度限值如下表:
的最高浓度限值如下表:最高浓度限值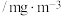 | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
 的含量为
的含量为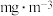 (保留2位有效数字),属于
(保留2位有效数字),属于
您最近半年使用:0次
名校
6 . 实验室用图1装置(夹持、搅拌、尾气处理装置已省略)制备氢化铝钠( )。
)。

简要步骤如下:
Ⅰ.在瓶A中分别加入50mL含3.84gNaH的四氢呋喃悬浮液、少量NaCl固体和0.20g 固体搅拌,接通冷凝水。
固体搅拌,接通冷凝水。
Ⅱ.滴加50mL含5.34g 的四氢呋喃溶液,反应,有白色固体析出。
的四氢呋喃溶液,反应,有白色固体析出。
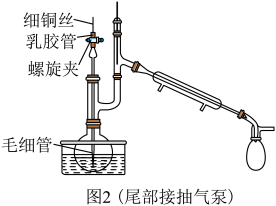
Ⅲ.待物料加完后,充分搅拌1h,放置沉降,分离出固体和清液,在图2装置中蒸馏,再纯化。
已知:所有操作在真空手套操作箱中完成,且对所有试剂去水、去氧处理。
 在室温干燥空气中能稳定存在,遇水易燃烧爆炸,易溶于四氢呋喃(
在室温干燥空气中能稳定存在,遇水易燃烧爆炸,易溶于四氢呋喃(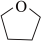 ,缩写为THF),难溶于甲苯、戊烷等烃类有机溶剂。常压下,
,缩写为THF),难溶于甲苯、戊烷等烃类有机溶剂。常压下, 熔点178℃,THF沸点66℃。
熔点178℃,THF沸点66℃。
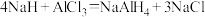
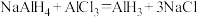

请回答:
(1)A瓶中冷凝水的通水方向是______ 进______ 出(填“a”或“b”)。
(2)请结合化学方程式说明 遇水产生燃烧爆炸现象的原因
遇水产生燃烧爆炸现象的原因______ 。
(3)下列说法正确的是______。
(4)步骤Ⅰ中,如果不加少量NaCl固体,反应速率逐渐减慢,在未完全滴加 的四氢呋喃溶液前反应停止,请解释原因
的四氢呋喃溶液前反应停止,请解释原因______ 。
(5)若称量纯化后的 质量为1.82g,计算该反应的产率为
质量为1.82g,计算该反应的产率为______ 。
(6)产品分析:分别取粗产品和纯化后的产品测定XDR,实验所测定的X射线衍射图谱如图3、图4所示,纯化后的产品的X射线衍射图谱是______ (填“图3”或“图4”)。

 )。
)。
简要步骤如下:
Ⅰ.在瓶A中分别加入50mL含3.84gNaH的四氢呋喃悬浮液、少量NaCl固体和0.20g
 固体搅拌,接通冷凝水。
固体搅拌,接通冷凝水。Ⅱ.滴加50mL含5.34g
 的四氢呋喃溶液,反应,有白色固体析出。
的四氢呋喃溶液,反应,有白色固体析出。Ⅲ.待物料加完后,充分搅拌1h,放置沉降,分离出固体和清液,在图2装置中蒸馏,再纯化。

已知:所有操作在真空手套操作箱中完成,且对所有试剂去水、去氧处理。
 在室温干燥空气中能稳定存在,遇水易燃烧爆炸,易溶于四氢呋喃(
在室温干燥空气中能稳定存在,遇水易燃烧爆炸,易溶于四氢呋喃( ,缩写为THF),难溶于甲苯、戊烷等烃类有机溶剂。常压下,
,缩写为THF),难溶于甲苯、戊烷等烃类有机溶剂。常压下, 熔点178℃,THF沸点66℃。
熔点178℃,THF沸点66℃。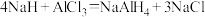
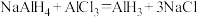

请回答:
(1)A瓶中冷凝水的通水方向是
(2)请结合化学方程式说明
 遇水产生燃烧爆炸现象的原因
遇水产生燃烧爆炸现象的原因(3)下列说法正确的是______。
A.由于THF有一定毒性,所以图1中 的主要作用是尾气吸收 的主要作用是尾气吸收 |
B.步骤Ⅱ中,滴加 的四氢呋喃溶液速率越快,得到沉淀颗粒更小 的四氢呋喃溶液速率越快,得到沉淀颗粒更小 |
| C.蒸馏时,缓慢加热,收集66℃左右馏分 |
D.根据物质结构推测,在室温下NaH在THF中的溶解度比 在THF中溶解度小 在THF中溶解度小 |
(4)步骤Ⅰ中,如果不加少量NaCl固体,反应速率逐渐减慢,在未完全滴加
 的四氢呋喃溶液前反应停止,请解释原因
的四氢呋喃溶液前反应停止,请解释原因(5)若称量纯化后的
 质量为1.82g,计算该反应的产率为
质量为1.82g,计算该反应的产率为(6)产品分析:分别取粗产品和纯化后的产品测定XDR,实验所测定的X射线衍射图谱如图3、图4所示,纯化后的产品的X射线衍射图谱是

您最近半年使用:0次
解题方法
7 . 锆是一种重要的战略金属,在国民经济中的地位举足轻重。中国科学院工程研究所研发了以锆英矿(主要成分为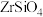 ,含少量
,含少量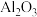 、
、 杂质)制氧氯化锆的工艺如下:
杂质)制氧氯化锆的工艺如下: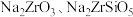 均不溶于水
均不溶于水
(1)在 下碱熔,
下碱熔,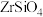 全部转化为
全部转化为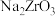 ,该反应的化学方程式为
,该反应的化学方程式为______ 。
(2)“滤液1”中的溶质除含有 外,还含有
外,还含有______ (化学式)。
(3)当碱熔的温度高于 时,
时,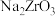 中含有少量的
中含有少量的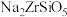 杂质,“转型”的主要目的是将
杂质,“转型”的主要目的是将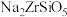 转化
转化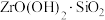 ,则“滤液2”中主要溶质为
,则“滤液2”中主要溶质为______ 。
(4)“酸分解”目的是将锆的化合物转化为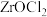 ,温度或盐酸浓度对“酸分解”的影响如下图所示:
,温度或盐酸浓度对“酸分解”的影响如下图所示:______  ,采用盐酸浓度为
,采用盐酸浓度为______  。
。
加入“絮凝剂”的目的是______ 。
(5)“操作1”的主要步骤为______ 、______ 。
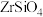 ,含少量
,含少量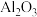 、
、 杂质)制氧氯化锆的工艺如下:
杂质)制氧氯化锆的工艺如下:
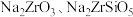 均不溶于水
均不溶于水(1)在
 下碱熔,
下碱熔,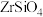 全部转化为
全部转化为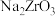 ,该反应的化学方程式为
,该反应的化学方程式为(2)“滤液1”中的溶质除含有
 外,还含有
外,还含有(3)当碱熔的温度高于
 时,
时,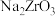 中含有少量的
中含有少量的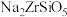 杂质,“转型”的主要目的是将
杂质,“转型”的主要目的是将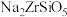 转化
转化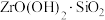 ,则“滤液2”中主要溶质为
,则“滤液2”中主要溶质为(4)“酸分解”目的是将锆的化合物转化为
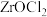 ,温度或盐酸浓度对“酸分解”的影响如下图所示:
,温度或盐酸浓度对“酸分解”的影响如下图所示: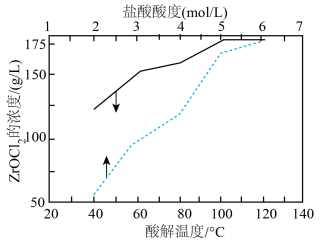
 ,采用盐酸浓度为
,采用盐酸浓度为 。
。加入“絮凝剂”的目的是
(5)“操作1”的主要步骤为
您最近半年使用:0次
名校
解题方法
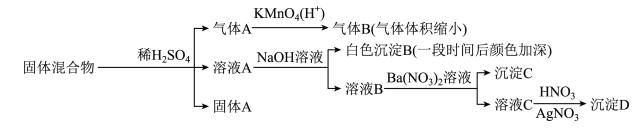
8 . 某固体混合物可能由 、
、 、FeS、
、FeS、 、
、 、
、 中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
 、
、 、FeS、
、FeS、 、
、 、
、 中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
A.气体A中一定含有 | B.固体A中一定含有S和 |
C.该固体混合物至少含 和FeS中的一种 和FeS中的一种 | D.该固体混合物中一定含有 、 、 、 、 |
您最近半年使用:0次
2023-09-27更新
|
637次组卷
|
5卷引用:河北省邢台市五岳联盟2023-2024学年高三上学期9月月考化学试题
9 . 将1.95gNa2O2加入水中,反应后配成50mL溶液A,进行如下实验。下列说法错误的是
| 编号 | ① | ② | ③ | ④ |
| 操作 | 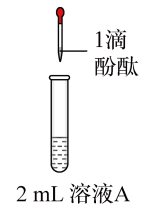 | 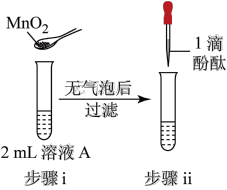 |  | 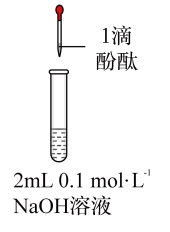 |
| 现象 | 溶液变红色,20秒后褪色 | ⅰ.产生大量使带火星的木条复燃的气体 ⅱ.溶液变红色,10分钟后褪色 | ⅰ.溶液变红色,10分钟后溶液褪色 ⅱ.溶液变红色 | 溶液变红色,2小时后无明显变化 |
| A.由实验可知,Na2O2与水反应有H2O2生成 |
B.②、③溶液褪色与 浓度较大有关 浓度较大有关 |
C.若向①褪色后的溶液中滴加5滴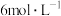 盐酸,溶液将变红 盐酸,溶液将变红 |
D.若向④中继续滴加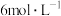 盐酸或 盐酸或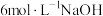 溶液,溶液均可能褪色 溶液,溶液均可能褪色 |
您最近半年使用:0次
2023-07-07更新
|
997次组卷
|
6卷引用:重庆市万州第二高级中学2023-2024学年高三上学期8月月考化学试题
解题方法
10 . 在温度为300K,压力为750mmHg的条件下有1.5L He和另一种气体的混合物,质量共5.0g。另一种气体在270K下即凝固。若在15K下气体混合物的压力为8mmHg(在相同体积下),则另一种气体的相对分子质量是
| A.103.8 | B.4.0 | C.495 | D.82.24 |
您最近半年使用:0次



