名校
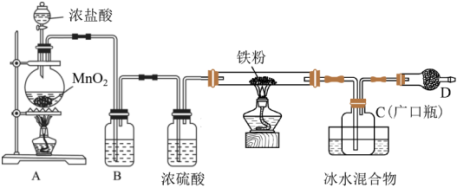
1 . 铁有两种氯化物,都是重要的化工试剂。某化学活动小组用如图所示的装置 夹持装置略去
夹持装置略去 模拟工业生产制备无水氯化铁。请回答下列问题:
模拟工业生产制备无水氯化铁。请回答下列问题:
查阅有关资料如下:
①氯化铁熔点为306℃,沸点为305℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)B装置所盛溶液的作用_______ ,A中发生反应的化学方程式为 _______ 。
(2)C中的产物为_______ (填化学式),D中装的药品是碱石灰,其作用是 _______ 。
(3)该小组在实验中发现稀盐酸与MnO2混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
猜想一:是由于c(H+)低所致。
猜想二:是由于_______ 所致。
小组设计了以下实验方案进行验证:
a.稀盐酸滴入 MnO2中,然后通入HCl气体加热
b.稀盐酸滴入 MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入 MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想_______ 成立。
(4)如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取4.60g产物溶于过量的稀盐酸中;
②加入足量H2O2溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该产物中铁元素的质量分数为_______ %(结果精确到小数点后两位)。
(5)若ClO2和Cl2在消毒时均被还原为Cl-,则等质量的ClO2和Cl2消毒过程中得到电子数目之比为_______ 。(结果精确到小数点后两位)
 夹持装置略去
夹持装置略去 模拟工业生产制备无水氯化铁。请回答下列问题:
模拟工业生产制备无水氯化铁。请回答下列问题:
查阅有关资料如下:
①氯化铁熔点为306℃,沸点为305℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)B装置所盛溶液的作用
(2)C中的产物为
(3)该小组在实验中发现稀盐酸与MnO2混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
猜想一:是由于c(H+)低所致。
猜想二:是由于
小组设计了以下实验方案进行验证:
a.稀盐酸滴入 MnO2中,然后通入HCl气体加热
b.稀盐酸滴入 MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入 MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想
(4)如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取4.60g产物溶于过量的稀盐酸中;
②加入足量H2O2溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该产物中铁元素的质量分数为
(5)若ClO2和Cl2在消毒时均被还原为Cl-,则等质量的ClO2和Cl2消毒过程中得到电子数目之比为
您最近一年使用:0次
名校
2 . 某容器中发生一个化学反应,反应过程中存在Fe2+、 、Fe3+、
、Fe3+、 、H+和H2O六种粒子,在反应过程中测得Fe3+、
、H+和H2O六种粒子,在反应过程中测得Fe3+、 的质量分数(w)随时间变化的曲线如图所示,下列有关判断中错误的是
的质量分数(w)随时间变化的曲线如图所示,下列有关判断中错误的是

 、Fe3+、
、Fe3+、 、H+和H2O六种粒子,在反应过程中测得Fe3+、
、H+和H2O六种粒子,在反应过程中测得Fe3+、 的质量分数(w)随时间变化的曲线如图所示,下列有关判断中错误的是
的质量分数(w)随时间变化的曲线如图所示,下列有关判断中错误的是
A.在反应中 被还原,发生还原反应 被还原,发生还原反应 |
B.还原性:Fe2+> |
| C.该反应中Fe2+被还原为Fe3+ |
| D.在反应中参加反应的还原剂与氧化剂的个数之比为8:1 |
您最近一年使用:0次
2021-09-12更新
|
600次组卷
|
9卷引用:新疆乌鲁木齐市第101中学2023-2024学年高三上学期8月月考化学试题
新疆乌鲁木齐市第101中学2023-2024学年高三上学期8月月考化学试题微专题(四) 氧化还原反应的简单规律及应用陕西省西安市碑林区教育局2023-2024学年高一上学期期中教育质量监测化学试题河北省石家庄市第二十三中学2020-2021学年高一上学期期中考试化学试题河北省衡水市武强中学2021-2022学年高一上学期第一次月考化学试题辽宁省葫芦岛市第八高级中学2022届高三上学期10月月考化学试题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期开学考试化学试题浙江省北斗联盟2022-2023学年高一上学期期中考试化学试题云南省富宁县第一中学2021-2022学年高一下学期开学考试化学试题
名校
解题方法
3 . 高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、_________ 、_________ 。
②下列关于“容量瓶及其使用”的叙述中正确的是_________ (填序号)。
A.使用前必须检查是否漏水 B.能配制一定体积准确浓度的标准溶液
C.可用来长期贮存溶液 D.能用作溶解固体、稀释浓溶液的容器
③下列操作对实验结果的影响偏高的是_________ (填序号)。
A.加水定容时俯视刻度线
B.未洗涤溶解后的烧杯和玻璃棒
C.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
D.未经冷却趁热将溶液注入容量瓶中并进行定容
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和__________________ 。该反应中还原剂与氧化剂的物质的量之比为_________ 。
(3)维生素C的水溶液能使高锰酸钾溶液褪色,根据这一原理,常用高锰酸钾测定蔬菜或水果中的维生素C的含量。上述实验原理体现了维生素C具有_____ (填氧化性、还原性)。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、
②下列关于“容量瓶及其使用”的叙述中正确的是
A.使用前必须检查是否漏水 B.能配制一定体积准确浓度的标准溶液
C.可用来长期贮存溶液 D.能用作溶解固体、稀释浓溶液的容器
③下列操作对实验结果的影响偏高的是
A.加水定容时俯视刻度线
B.未洗涤溶解后的烧杯和玻璃棒
C.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
D.未经冷却趁热将溶液注入容量瓶中并进行定容
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和
(3)维生素C的水溶液能使高锰酸钾溶液褪色,根据这一原理,常用高锰酸钾测定蔬菜或水果中的维生素C的含量。上述实验原理体现了维生素C具有
您最近一年使用:0次
2023-01-06更新
|
208次组卷
|
2卷引用:新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题
名校
解题方法
4 . 我国规定所有销售的食品包装标签配料表上,食品添加剂应使用规定的产品名称或种类名称,其中甜味剂、防腐剂、着色剂应注明。下面标签注明的添加剂中属于着色剂的是
浓缩菠萝汁配料:水、浓缩菠萝汁、蔗糖、柠檬酸、黄原胶、甜味素、维生素C、柠檬黄、日落黄、山梨酸钾果汁含量:≥80%
①柠檬酸②山梨酸钾③甜味素④菠萝香精⑤柠檬黄⑥日落黄
浓缩菠萝汁配料:水、浓缩菠萝汁、蔗糖、柠檬酸、黄原胶、甜味素、维生素C、柠檬黄、日落黄、山梨酸钾果汁含量:≥80%
①柠檬酸②山梨酸钾③甜味素④菠萝香精⑤柠檬黄⑥日落黄
| A.①②⑤ | B.②⑤⑥ | C.③④ | D.⑤⑥ |
您最近一年使用:0次
2023-06-22更新
|
94次组卷
|
3卷引用:新疆乌鲁木齐市第四中学2022-2023学年高一下学期期末阶段性诊断测试化学试题
名校
解题方法
5 . 短周期主族元素X、Y、Z、W的原子序数依次增大。X的原子半径小于Y的原子半径,Y是地壳中含量最高的元素,Z与X同主族,W的最外层电子数等于Y与Z的最外层电子数之和。下列有关说法错误的是
| A.由Y、Z、W形成的化合物中溶于水可能有漂白性 |
| B.原子半径的大小顺序为W>Y>Z>X |
| C.Y、Z可以形成电子层结构相同的离子,且离子半径前者大于后者 |
| D.仅由X、Y两种元素可形成分别含有10e-和18e-的化合物 |
您最近一年使用:0次
名校
6 . 金属元素钫(Fr)在自然界中含量极少。它的21个已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是
| A.在已知碱金属元素中具有最大的原子半径 |
| B.在空气中燃烧时生成氧化物Fr2O |
| C.氧化物对应的水化物是极强的碱 |
| D.其单质的熔点比金属钠的熔点低 |
您最近一年使用:0次
2022-11-04更新
|
130次组卷
|
2卷引用:新疆乌鲁木齐市第六十九中学2022-2023学年高一下学期3月质量检测化学试题
名校
7 . ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2的实验装置如图甲所示。

已知:①2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O。
②ClO2的熔点为- 59℃,沸点为11℃,H2O2的沸点为150℃;
③当温度低于38℃时,NaClO2饱和溶液中析出的晶体是NaClO2●3H2O;当温度在38~ 60℃时,析出NaClO2;温度高于60℃时,NaClO2分解。
请回答下列问题:
(1)当仪器组装完毕后,有同学认为:关闭弹簧夹K1和K2,取下X上端的玻璃塞,加入一定量的水后塞上玻璃塞,再打开X下端的活塞。可以检查装置的气密性。请判断该方法能否检查装置气密性,并说明理由:________ 。
(2)Cl-对ClO2的生成有一定催化作用。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率会大大提高,并产生微量氯气。该过程经两步反应完成,将其补充完整。
①______ (用离子方程式表示);
②H2O2+Cl2=2Cl-+O2+2H+;
(3)C中将装置浸入冰水浴中的作用是_______ 。
(4)若实验室采用如图乙所示的装置从C中的溶液中获得NaClO2晶体,则需要在该装置的Y处增加一个设备。
①采用上述装置浓缩NaClO2溶液的操作称为_____ 。
②水浴加热的温度最好控制在________ ℃左右(填序号)。
A 40 B 55 C 70 D 100
③装置中毛细玻璃管的作用是_____ 。
④当蒸馏烧瓶中出现大量晶体后,_____ (填操作),用38~60°C热水洗涤晶体,干燥后得到产品。
(5)产品纯度的测定:称取m g产品配成250 mL溶液,取25. 00 mL溶液.加入足量的KI和稀H2SO4),充分反应后加入指示剂,用c mol/LNa2S2O3标准溶液滴定至终点(I2+2S2O =2I-+S4O62-),平均消耗标准溶液的体积为V mL,则产品中NaClO2的质量分数是
=2I-+S4O62-),平均消耗标准溶液的体积为V mL,则产品中NaClO2的质量分数是______ %。

已知:①2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O。
②ClO2的熔点为- 59℃,沸点为11℃,H2O2的沸点为150℃;
③当温度低于38℃时,NaClO2饱和溶液中析出的晶体是NaClO2●3H2O;当温度在38~ 60℃时,析出NaClO2;温度高于60℃时,NaClO2分解。
请回答下列问题:
(1)当仪器组装完毕后,有同学认为:关闭弹簧夹K1和K2,取下X上端的玻璃塞,加入一定量的水后塞上玻璃塞,再打开X下端的活塞。可以检查装置的气密性。请判断该方法能否检查装置气密性,并说明理由:
(2)Cl-对ClO2的生成有一定催化作用。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率会大大提高,并产生微量氯气。该过程经两步反应完成,将其补充完整。
①
②H2O2+Cl2=2Cl-+O2+2H+;
(3)C中将装置浸入冰水浴中的作用是
(4)若实验室采用如图乙所示的装置从C中的溶液中获得NaClO2晶体,则需要在该装置的Y处增加一个设备。
①采用上述装置浓缩NaClO2溶液的操作称为
②水浴加热的温度最好控制在
A 40 B 55 C 70 D 100
③装置中毛细玻璃管的作用是
④当蒸馏烧瓶中出现大量晶体后,
(5)产品纯度的测定:称取m g产品配成250 mL溶液,取25. 00 mL溶液.加入足量的KI和稀H2SO4),充分反应后加入指示剂,用c mol/LNa2S2O3标准溶液滴定至终点(I2+2S2O
 =2I-+S4O62-),平均消耗标准溶液的体积为V mL,则产品中NaClO2的质量分数是
=2I-+S4O62-),平均消耗标准溶液的体积为V mL,则产品中NaClO2的质量分数是
您最近一年使用:0次
2020-09-12更新
|
634次组卷
|
6卷引用:新疆生产建设兵团第二师八一中学2023届高三上学期开学考试化学试题
新疆生产建设兵团第二师八一中学2023届高三上学期开学考试化学试题新疆第二师八一中学2022-2023学年高三上学期开学考试化学试题(已下线)第四章 非金属及其化合物 第18练 氯及其化合物重庆市巴蜀中学2020届“一诊”模拟测试理综化学试题(已下线)第10讲 氯及其化合物(练) — 2022年高考化学一轮复习讲练测(新教材新高考)湖南省衡阳市第八中学2021-2022学年高三下学期开学考试(第六次月考)化学试题
名校
8 . 四种短周期元素在元素周期表中的位置如图所示,T是地壳中含量最高的金属元素。下列说法不正确的是
Q | |||
T | R | W |
| A.W的氢化物比R的氢化物稳定 |
| B.T的最高价氧化物对应的水化物可能为强碱 |
| C.Q的原子半径比T的小 |
| D.W和Q的原子序数相差10 |
您最近一年使用:0次
2022-01-07更新
|
448次组卷
|
6卷引用:新疆生产建设兵团第二中学2022-2023学年高一上学期期末考试化学试题
新疆生产建设兵团第二中学2022-2023学年高一上学期期末考试化学试题甘肃省民勤县第一中学2022-2023学年 高一下学期开学考试化学试题甘肃省武威市民勤县第一中学2023-2024学年高二上学期开学考试化学试题甘肃省兰州市教育局第四片区2021-2022学年高一上学期期末考试化学试题(已下线)专题33 元素的综合推断-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)4.2.2 元素周期表和元素周期律的应用-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)
名校
解题方法
9 . 短周期主族元素X、Y、Z、W的原子序数依次增大。X的单质在空气中所占体积分数最大,Y是地壳中含量最多的金属元素,Z与X位于同一主族,W原子的最外层有7个电子。下列说法正确的是
| A.Y位于元素周期表中第3周期第Ⅲ族 |
B.原子半径: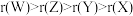 |
| C.W的简单气态氢化物的热稳定性比Z的强 |
| D.Z的最高价氧化物对应水化物的酸性比X的强 |
您最近一年使用:0次
2022-06-30更新
|
244次组卷
|
2卷引用:新疆乌鲁木齐市第四中学2022-2023学年高一下学期期末阶段性诊断测试化学试题
名校
解题方法
10 . “绿水青山就是金山银山”,化学与环境密切相关。下列说法正确的是( )
| A.PM2.5是指大气中直径小于或等于与2.5微米的颗粒物,这些颗粒分散在空气中都会形成胶体 |
| B.C、N、S的氧化物会使雨水的pH<7,因此我们把pH<7的雨水称之为酸雨 |
| C.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染 |
| D.为了减少煤燃烧废气中SO2的含量,可以加入适量的石灰石 |
您最近一年使用:0次
2020-04-04更新
|
212次组卷
|
3卷引用:新疆克孜勒苏柯尔克孜自治州第二中学2022-2023学年高一下学期期末考试化学试题



