名校
解题方法
1 . 用下图所示装置及药品进行实验,能达到对应实验目的的是
 |  |  |  |
| A.检查装置的气密性 | B.实验室制取氯气 | C.配制一定物质的量浓度的硫酸 | D.制备 胶体 胶体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-21更新
|
325次组卷
|
4卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高三上学期12月月考化学试卷
名校
2 . 铁有两种氯化物,都是重要的化工试剂。某化学活动小组用如图所示的装置 夹持装置略去
夹持装置略去 模拟工业生产制备无水氯化铁。请回答下列问题:
模拟工业生产制备无水氯化铁。请回答下列问题:
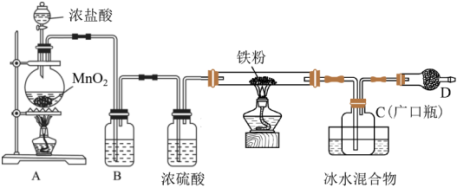
查阅有关资料如下:
①氯化铁熔点为306℃,沸点为305℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)B装置所盛溶液的作用_______ ,A中发生反应的化学方程式为 _______ 。
(2)C中的产物为_______ (填化学式),D中装的药品是碱石灰,其作用是 _______ 。
(3)该小组在实验中发现稀盐酸与MnO2混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
猜想一:是由于c(H+)低所致。
猜想二:是由于_______ 所致。
小组设计了以下实验方案进行验证:
a.稀盐酸滴入 MnO2中,然后通入HCl气体加热
b.稀盐酸滴入 MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入 MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想_______ 成立。
(4)如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取4.60g产物溶于过量的稀盐酸中;
②加入足量H2O2溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该产物中铁元素的质量分数为_______ %(结果精确到小数点后两位)。
(5)若ClO2和Cl2在消毒时均被还原为Cl-,则等质量的ClO2和Cl2消毒过程中得到电子数目之比为_______ 。(结果精确到小数点后两位)
 夹持装置略去
夹持装置略去 模拟工业生产制备无水氯化铁。请回答下列问题:
模拟工业生产制备无水氯化铁。请回答下列问题:
查阅有关资料如下:
①氯化铁熔点为306℃,沸点为305℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)B装置所盛溶液的作用
(2)C中的产物为
(3)该小组在实验中发现稀盐酸与MnO2混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
猜想一:是由于c(H+)低所致。
猜想二:是由于
小组设计了以下实验方案进行验证:
a.稀盐酸滴入 MnO2中,然后通入HCl气体加热
b.稀盐酸滴入 MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入 MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想
(4)如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取4.60g产物溶于过量的稀盐酸中;
②加入足量H2O2溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该产物中铁元素的质量分数为
(5)若ClO2和Cl2在消毒时均被还原为Cl-,则等质量的ClO2和Cl2消毒过程中得到电子数目之比为
您最近一年使用:0次
名校
3 . 实验室用下图装置制备干燥的 并研究其性质。其中,a为湿润的淀粉
并研究其性质。其中,a为湿润的淀粉 试纸,b、c分别为湿润和干燥的红纸条,d为湿润的蓝色石蕊试纸。
试纸,b、c分别为湿润和干燥的红纸条,d为湿润的蓝色石蕊试纸。

下列关于实验现象及 性质的说法中,
性质的说法中,不正确 的是
 并研究其性质。其中,a为湿润的淀粉
并研究其性质。其中,a为湿润的淀粉 试纸,b、c分别为湿润和干燥的红纸条,d为湿润的蓝色石蕊试纸。
试纸,b、c分别为湿润和干燥的红纸条,d为湿润的蓝色石蕊试纸。
下列关于实验现象及
 性质的说法中,
性质的说法中,| A.一段时间后,观察到a变蓝 | B.b褪色,说明 具有漂白性 具有漂白性 |
C.b褪色而c不褪色,说明 能与水反应 能与水反应 | D.d先变红,一段时间后褪色 |
您最近一年使用:0次
2023-01-05更新
|
452次组卷
|
5卷引用:新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题
名校
4 . 亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。

Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
(1)仪器b的名称为___________ ,作用是 ___________ 。
(2)装置A中生成NaClO2的离子方程式为:___________ 。
(3)若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有减压蒸发浓缩、___________ 、过滤、___________ 干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)B中现象为___________ 。
(5)实验完成后,再次打开止水夹①,从进气口又通入一段时间的空气目的是:___________ 。

Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
(1)仪器b的名称为
(2)装置A中生成NaClO2的离子方程式为:
(3)若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有减压蒸发浓缩、
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)B中现象为
(5)实验完成后,再次打开止水夹①,从进气口又通入一段时间的空气目的是:
您最近一年使用:0次
2022-03-02更新
|
186次组卷
|
3卷引用:新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高三上学期第一次月考 化学试题
名校
5 . 根据实验目的,下列操作、现象及结论都正确的是
| 选项 | 目的 | 操作及现象 | 结论 |
| A | 检验 的性质 的性质 | 向试管中加入3mL稀 酸性溶液,再通入 酸性溶液,再通入 气体,紫红色褪去 气体,紫红色褪去 |  具有漂白性 具有漂白性 |
| B | 检验补铁口服液中是否含有 | 加入KSCN溶液无明显现象,再滴加少量氯水,溶液立即变为红色 | 含有 |
| C | 检验 固体是否变质 固体是否变质 | 溶解后,滴加硝酸酸化的硝酸钡溶液,产生白色沉淀 | 已变质 |
| D | 检验某溶液中是否含有 | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 不含 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-27更新
|
254次组卷
|
3卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高三上学期11月月考化学试题
名校
6 . 侯氏制碱法原理为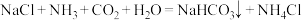 。下列有关模拟侯氏制碱法的实验原理和装置能达到实验目的的是
。下列有关模拟侯氏制碱法的实验原理和装置能达到实验目的的是
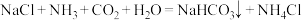 。下列有关模拟侯氏制碱法的实验原理和装置能达到实验目的的是
。下列有关模拟侯氏制碱法的实验原理和装置能达到实验目的的是A.制取氨气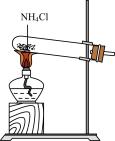 | B.制NaHCO3 |
C.分离NaHCO3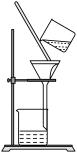 | D.制Na2CO3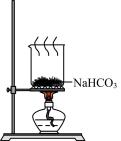 |
您最近一年使用:0次
2023-06-27更新
|
894次组卷
|
27卷引用:新疆阿克苏市第四高级中学2023-2024学年高三上学期第二次月考化学试卷
新疆阿克苏市第四高级中学2023-2024学年高三上学期第二次月考化学试卷山东省淄博实验中学2022-2023学年高一下学期3月月考化学试题江苏省南通市通州区2022-2023学年高一下学期第一次月考化学试题(已下线)【2023】【高一下】【其他】【余高1】【高中化学】【刘尼尼收集】(已下线)化学-2023年高考押题预测卷03(上海卷)(含考试版、全解全析、参考答案、答题卡)江苏省宿迁地区2022-2023学年高一下学期期中考试化学试题江苏省苏州市2022-2023学年高一下学期期末应考化学试题(已下线)第二章 单元测试卷浙江省绍兴市第一中学2023-2024学年高三首考模拟考试化学试题江苏省泗阳县实验高级中学2023-2024学年高一上学期第二次调研测试化学试卷江苏苏州市2021届高三下学期期初学业质量阳光指标调研化学试题江苏省苏州市2021届高三月考化学试卷江苏省连云港市赣榆智贤中学2020-2021学年高二3月月考化学试题江苏省邗江中学2020-2021学年高二(2019级新疆班)下学期期中化学试题广东省广州市真光中学2020-2021学年高一下学期3月月考化学试题(已下线)【镇江新东方】高二下期中21高二期中校级联考江苏省苏州市2022届高考考前模拟化学试卷题湖南省株洲市第二中学2021-2022学年高二下学期期末考试化学试题(已下线)第06讲 钠及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)江苏省苏州市2021-2022学年高一下学期期末学业质量阳光指标调研(延期到8月)化学试题江苏省盐城市三校2022-2023学年高三上学期第一次联考化学试题广东省汕尾市龙山中学 2021-2022学年高一下学期第一次月考化学试题河南省南阳市第一中学校2023届高三上学期第二次阶段考试化学试题(已下线)易错点05 钠及其化合物-备战2023年高考化学考试易错题重庆市西南大学附属中学校2022-2023学年高三上学期11月期中考试化学试题17 2024年苏州昆山周市高级中学高一3月月考(已下线)压轴题03 物质的制备检验分离与提纯(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
解题方法
7 . 氯气及其化合物在生产、生活中应用广泛。实验室常用浓盐酸与 共热[或用
共热[或用 (s)与浓盐酸混合]制取氯气,实验室制取氯气并探究其性质,下列装置
(s)与浓盐酸混合]制取氯气,实验室制取氯气并探究其性质,下列装置不能 达到相应实验目的的是
 共热[或用
共热[或用 (s)与浓盐酸混合]制取氯气,实验室制取氯气并探究其性质,下列装置
(s)与浓盐酸混合]制取氯气,实验室制取氯气并探究其性质,下列装置| A | B | C | D |
 |  |  |  |
| 制取氯气 | 验证氧化性 | 验证漂白性 | 吸收尾气 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-22更新
|
1055次组卷
|
8卷引用:新疆维吾尔自治区乌鲁木齐市实验学校2023-2024学年高三上学期1月月考化学试题
新疆维吾尔自治区乌鲁木齐市实验学校2023-2024学年高三上学期1月月考化学试题江苏省百校大联考2021-2022学年高三下学期第四次考试化学试题(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题(已下线)第05练 氯及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第05练 氯及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)2022年江苏卷高考真题变式题1-13江苏省淮安市钦工中学2022-2023学年高三上学期第一次月考化学试题江苏省徐州市第七中学2022-2023学年高三上学期9月摸底学情调研化学试题
名校
8 . 下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.4000 mol·L-1的NaOH溶液 | 称取8.0 g固体NaOH置于500 mL容量瓶中,加水溶解并定容 |
B | 除去H2SO4中的HCl | 向溶液中加入适量的AgNO3溶液,过滤 |
C | 除去KNO3固体中少量的NaCl | 将固体溶解后,蒸发浓缩,冷却结晶,过滤、洗涤、干燥 |
D | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-16更新
|
347次组卷
|
3卷引用:新疆阿克苏地区等2地新疆生产建设兵团第一师第二高级中学等2校2022-2023学年高三下学期2月月考化学试题
名校
解题方法
9 . I.某化学自主实验小组利用如图所示装置探究 能否被
能否被 还原
还原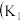 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。________ 。 装置发生的化学反应方程式为
装置发生的化学反应方程式为_________ 。
(2)甲、乙分别是___________  填标号
填标号 。
。
a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下: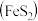 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:___________ 。
(6)写出催化反应室中SO2被氧化为SO3的化学方程式___________ 。
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用___________ 吸收。
 能否被
能否被 还原
还原 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
 装置发生的化学反应方程式为
装置发生的化学反应方程式为(2)甲、乙分别是
 填标号
填标号 。
。a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若
 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:(4)此实验装置存在一个明显的缺陷是
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
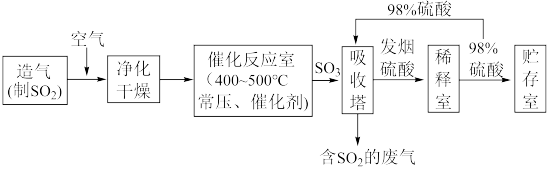
 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:(6)写出催化反应室中SO2被氧化为SO3的化学方程式
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用
您最近一年使用:0次
2024-02-24更新
|
745次组卷
|
5卷引用:新疆克孜勒苏柯尔克孜自治州第二中学2022-2023学年高一下学期期末考试化学试题
新疆克孜勒苏柯尔克孜自治州第二中学2022-2023学年高一下学期期末考试化学试题安徽省合肥市第一中学2023-2024学年高一下学期月考化学试题(一)广东省广州市黄广中学2023-2024学年高一下学期3月月考化学试题河南省三门峡市渑池县第二高级中学2023-2024学年高一下学期4月期中考试化学试题(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)
10 . 溴化亚铜(CuBr)微溶于水,不溶于乙醇,可用作有机合成中的催化剂。实验室可利用无水硫酸铜、溴化钠为主要原料制备溴化亚铜,流程如图:

已知:产率 =(实际产量/理论产量)×100%
(1)制备CuBr的反应在装置乙中进行,向其中加入32 g CuSO4和23 g NaBr配制成150 mL水溶液,然后通入足量的SO2(部分夹持及加热装置已略去)。
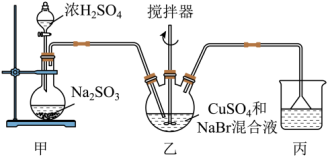
①装置甲中,不能采用稀硫酸,一般采用70%左右的浓硫酸,其原因是___________ 。
②写出装置乙中发生反应的离子方程式:___________ ,该反应需保持反应液在60℃,最佳加热方式为___________ 。
(2)洗涤CuBr沉淀时采用SO2的水溶液而不采用蒸馏水,其目的是___________ 。
(3)最后经洗涤、干燥得到24.48 g产品,则该实验的产率是___________ 。(保留两位有效数字)

已知:产率 =(实际产量/理论产量)×100%
(1)制备CuBr的反应在装置乙中进行,向其中加入32 g CuSO4和23 g NaBr配制成150 mL水溶液,然后通入足量的SO2(部分夹持及加热装置已略去)。

①装置甲中,不能采用稀硫酸,一般采用70%左右的浓硫酸,其原因是
②写出装置乙中发生反应的离子方程式:
(2)洗涤CuBr沉淀时采用SO2的水溶液而不采用蒸馏水,其目的是
(3)最后经洗涤、干燥得到24.48 g产品,则该实验的产率是
您最近一年使用:0次



