解题方法
1 . 砷 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
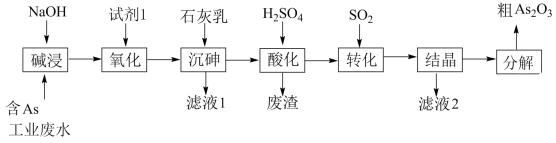
已知:
①含 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;
② 微溶于水,
微溶于水, 难溶于水。
难溶于水。
回答下列问题:
(1)砷元素在元素周期表中的位置为_______ 。
(2)“碱浸”中发生反应的离子方程式为_______ 。
(3)从绿色化学角度考虑,“试剂1”可以选择_______ (填化学式)。
(4)“沉砷”在流程中的目的是_______ ;“沉砷”的最佳温度是 ,温度高于
,温度高于 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是_______ 。
(5)“废渣”的主要成分是_______ ,“转化”中发生反应的化学方程式为_______ 。
(6)从综合利用的角度考虑“滤液2”可返回_______ 步骤中循环再利用。
 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
已知:
①含
 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;②
 微溶于水,
微溶于水, 难溶于水。
难溶于水。回答下列问题:
(1)砷元素在元素周期表中的位置为
(2)“碱浸”中发生反应的离子方程式为
(3)从绿色化学角度考虑,“试剂1”可以选择
(4)“沉砷”在流程中的目的是
 ,温度高于
,温度高于 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是(5)“废渣”的主要成分是
(6)从综合利用的角度考虑“滤液2”可返回
您最近一年使用:0次
名校
解题方法
2 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经一百多年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
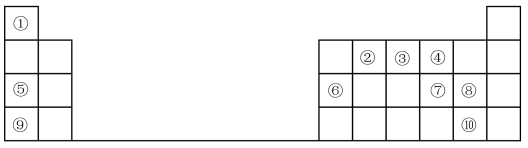
(1)元素②在周期表中的位置___________
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是___________ (填化学式)。
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程:___________ 。
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是___________ (用离子符号表示),
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为:___________ 。
(6)元素的非金属性⑩___________ ⑧(填“>”或“<”);下列事实不能 证明上述结论的是___________ 。
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱

(1)元素②在周期表中的位置
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程:
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为:
(6)元素的非金属性⑩
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱
您最近一年使用:0次
2024-02-13更新
|
155次组卷
|
2卷引用:天津市重点校2023-2024学年高一上学期期末联考化学试题
名校
3 . 下列说法正确的是( )
A.单质 氧化物 氧化物 酸或碱 酸或碱 盐,铁单质可以按上述关系进行转化 盐,铁单质可以按上述关系进行转化 |
B.若a、b、c分别为S、SO3、H2SO4,则可以通过一步反应实现如图所示的转化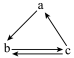 |
| C.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 |
| D.单质硅常用于制造光导纤维 |
您最近一年使用:0次
2020-04-02更新
|
113次组卷
|
2卷引用:云南省普洱市第一中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
4 . 下表列出了①~⑪11种元素在元素周期表中的位置:
(1)写出元素③形成单质的电子式___________ ②的最高价氧化物的结构式为___________ ;⑩的最高价氧化物的水化物的化学式为___________ 。
(2)画这11种元素中,非金属性最强的元素的原子结构示意图___________ 。
(3)写出⑧的氧化物与⑥的最高价氧化物的水化物反应的离子方程式___________ 。
(4)请从原子结构的角度解释,解释元素⑩的非金属性比元素⑪强的原因___________ 。
(5)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为___________ 。
②下列推断正确的是___________ (填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,写出Y的原子序数b与a可能存在的所有的关系___________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | ⑪ |
(2)画这11种元素中,非金属性最强的元素的原子结构示意图
(3)写出⑧的氧化物与⑥的最高价氧化物的水化物反应的离子方程式
(4)请从原子结构的角度解释,解释元素⑩的非金属性比元素⑪强的原因
(5)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为
②下列推断正确的是
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,写出Y的原子序数b与a可能存在的所有的关系
您最近一年使用:0次
2024-01-21更新
|
86次组卷
|
2卷引用:浙江省宁波市效实中学2023-2024学年高一上学期期末化学模拟卷
名校
解题方法
5 . 如图是部分短周期主族元素原子半径与原子序数的关系图。
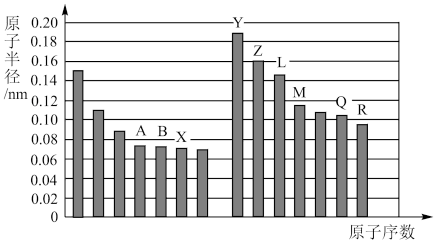
回答下列问题(对应的微粒均用相应的元素符号表示):
(1)写出A在元素周期表中的位置__________ 。比较Z、Q两种元素的简单离子半径大小__________ ;
M的原子结构示意图为__________ ;B单质的电子式为__________ ,B的氢化物空间构型为__________
(2)图中最活泼的金属是__________ ,将其单质在氧气中加热,生成的产物为__________ 。
(3)比较Q、R两种元素的简单气态氢化物的沸点高低__________ ,并从原子结构角度解释其原因________________ ;
(4)B的氢化物在常温下跟R的氢化物混合发生反应的化学方程式为__________ ;现象为__________ 。
(5)设计一个实验方案,比较X、Q单质氧化性的强弱:________ (注明操作、现象及结论)

回答下列问题(对应的微粒均用相应的元素符号表示):
(1)写出A在元素周期表中的位置
M的原子结构示意图为
(2)图中最活泼的金属是
(3)比较Q、R两种元素的简单气态氢化物的沸点高低
(4)B的氢化物在常温下跟R的氢化物混合发生反应的化学方程式为
(5)设计一个实验方案,比较X、Q单质氧化性的强弱:
您最近一年使用:0次
名校
解题方法
6 . X、V、Z、M、Q、R皆为周期表中前20号元素,其原子半径与主要化合价的关系如图所示。
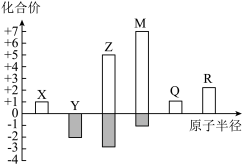
(1)已知X位于第一周期,则 电子式为
电子式为___________ 。
(2)比较Y和Z的简单氢化物,更稳定的是___________ (填化学式)。
(3)已知Q位于第三周期,则R在元素周期表中的位置是___________ 。
(4)下列推断正确的是___________ 。
a.简单离子半径: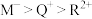
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式___________ ;比较 和M的阴离子,还原性更强的是
和M的阴离子,还原性更强的是___________ (填离子符号),从原子结构的角度解释原因___________ 。

(1)已知X位于第一周期,则
 电子式为
电子式为(2)比较Y和Z的简单氢化物,更稳定的是
(3)已知Q位于第三周期,则R在元素周期表中的位置是
(4)下列推断正确的是
a.简单离子半径:
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式
 和M的阴离子,还原性更强的是
和M的阴离子,还原性更强的是
您最近一年使用:0次
2023-07-12更新
|
259次组卷
|
3卷引用:北京市丰台区2022-2023学年高一下学期期末考试化学试题
7 . 下表是元素周期表中前四周期的部分元素,表中所列字母分别代表一种元素。
回答下列问题:
(1)i在元素周期表中的位置是__________ 。
(2)a、e、g、l形成的简单离子其半径由大到小的顺序为__________ (填写离子符号)。
(3)n与o形成的化合物为__________ (填写化学式),将该化合物进行焰色试验,火焰呈__________ 色。
(4)用电子式表示g和m形成化合物的过程__________ 。
(5)将足量d的氢化物溶于水,再取少量 的水溶液滴入其中,反应的离子方程式为
的水溶液滴入其中,反应的离子方程式为__________ 。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
实验操作:取已除去氧化膜且表面积相等的镁条和铝条,分别投入 盐酸中。
盐酸中。
实验现象:镁与盐酸反应比铝更剧烈。
①比较金属性:
______  (选填“>”或“<”);
(选填“>”或“<”);
②利用元素周期律对上述实验结论进行解释__________ 。
(7)向 的碱性溶液中通入m单质,可得到
的碱性溶液中通入m单质,可得到 ,反应的离子方程式为:
,反应的离子方程式为:__________ 。
a | b | |||||||
c | d | e | f | |||||
g | h | i | j | k | l | m | ||
o | n | |||||||
(1)i在元素周期表中的位置是
(2)a、e、g、l形成的简单离子其半径由大到小的顺序为
(3)n与o形成的化合物为
(4)用电子式表示g和m形成化合物的过程
(5)将足量d的氢化物溶于水,再取少量
 的水溶液滴入其中,反应的离子方程式为
的水溶液滴入其中,反应的离子方程式为(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
实验操作:取已除去氧化膜且表面积相等的镁条和铝条,分别投入
 盐酸中。
盐酸中。实验现象:镁与盐酸反应比铝更剧烈。
①比较金属性:

 (选填“>”或“<”);
(选填“>”或“<”);②利用元素周期律对上述实验结论进行解释
(7)向
 的碱性溶液中通入m单质,可得到
的碱性溶液中通入m单质,可得到 ,反应的离子方程式为:
,反应的离子方程式为:
您最近一年使用:0次
2023-02-17更新
|
196次组卷
|
3卷引用:四川省眉山市2022-2023学年高一上学期期末考试化学试题
名校
解题方法
8 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
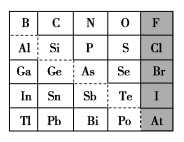
(1)元素 在元素周期表中的位置为第
在元素周期表中的位置为第______ 周期第______ 族。
(2) 的最高化合价为
的最高化合价为______ , 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为______ , 的最高价氧化物为
的最高价氧化物为______ 。
(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是______ 元素(填元素符号)。
②酸性:
______ (填“>”“<”或“=”,下同) 。
。
③氢化物的还原性:
______  。
。
④原子半径:
______  。
。
(4)可在图中分界线(虚线)附近寻找______ (填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较 、
、 的非金属性强弱:
的非金属性强弱:______ 。(可供选择的药品有 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)

(1)元素
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)
 的最高化合价为
的最高化合价为 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为 的最高价氧化物为
的最高价氧化物为(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是
②酸性:

 。
。③氢化物的还原性:

 。
。④原子半径:

 。
。(4)可在图中分界线(虚线)附近寻找
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较
 、
、 的非金属性强弱:
的非金属性强弱: 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)
您最近一年使用:0次
2020-09-08更新
|
1569次组卷
|
6卷引用:内蒙古通辽市开鲁县第一中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
9 . 元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
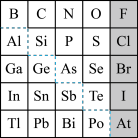
(1)元素Ga在元素周期表中的位置为:第_____ 周期第____ 族。
(2)Sn的最高正价为____ ,Cl的最高价氧化物对应水化物的化学式为___ ,Bi的最高价氧化物为_____ 。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是______ 元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4______ H2SeO4(填“>”“<”或“=”)。
③氢化物的还原性:H2O______ H2S(填“>”“<”或“=”)。
④原子半径比较:N______ Si(填“>”“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找______ (填序号)。
A.优良的催化剂 B.半导体材料C.合金材料 D.农药
(5)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)________ 。

(1)元素Ga在元素周期表中的位置为:第
(2)Sn的最高正价为
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
③氢化物的还原性:H2O
④原子半径比较:N
(4)可在图中分界线(虚线部分)附近寻找
A.优良的催化剂 B.半导体材料C.合金材料 D.农药
(5)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)
您最近一年使用:0次
2020-02-08更新
|
311次组卷
|
4卷引用:山东省淄博市淄川中学2022-2023学年高一上学期期末学情自测化学试题
名校
解题方法
10 . X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是( )
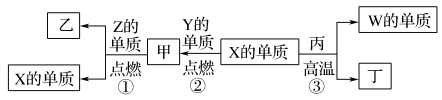

| A.反应③可用于工业上制取W的单质 | B.X位于元素周期表第二周期ⅣA族 |
| C.甲、丙、丁均为酸性化合物 | D.工业上可以用乙来作耐火材料 |
您最近一年使用:0次
2020-01-17更新
|
1245次组卷
|
6卷引用:江西省宁冈中学2022-2023学年高一下学期6月期末化学试题



