1 . a.有下列物质:①氢氧化钡 ②KHSO4 ③液态HCl ④稀硫酸 ⑤二氧化碳 ⑥铜 ⑦碳酸钠 ⑧蔗糖
请回答下列问题:
(1)属于电解质的有___________ (填序号)
(2)属于非电解质的有___________ (填序号)
b.某同学用如下实验探究 、
、 的性质。请回答下列问题:
的性质。请回答下列问题:
(3)在FeCl3溶液中需加入少量铁屑,发生反应的化学方程式为___________ 。FeCl3溶液,加入1滴___________ 溶液,溶液变___________ 。
(4)FeCl2溶液与氯水反应的化学方程式为___________ 。
(5)某同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程___________ 。
c.请回答下列问题:
(6)0.5 mol H2O含有H的物质的量___________ mol。含有O数目___________ 。
(7)100 mL 0.2 mol/L Na2SO4溶液中 的物质的量浓度为
的物质的量浓度为___________ 。
(8)标准状况下11.2 L的CO2的物质的量是___________ mol。
请回答下列问题:
(1)属于电解质的有
(2)属于非电解质的有
b.某同学用如下实验探究
 、
、 的性质。请回答下列问题:
的性质。请回答下列问题:(3)在FeCl3溶液中需加入少量铁屑,发生反应的化学方程式为
(4)FeCl2溶液与氯水反应的化学方程式为
(5)某同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程
c.请回答下列问题:
(6)0.5 mol H2O含有H的物质的量
(7)100 mL 0.2 mol/L Na2SO4溶液中
 的物质的量浓度为
的物质的量浓度为(8)标准状况下11.2 L的CO2的物质的量是
您最近一年使用:0次
解题方法
2 . 下列离子的检验方法中合理的是
A.向某溶液中滴入H2O2溶液产生气泡,说明不含 |
B.用酸性KMnO4溶液检验FeSO4溶液中是否含有 |
C.向某溶液中加入NaOH溶液,直接得到红褐色沉淀,说明溶液中含有 |
D.向某溶液中加入NaOH溶液得到白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有 ,不含有 ,不含有 |
您最近一年使用:0次
名校
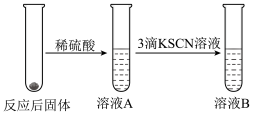
3 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)甲组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为___________ 。(写出一条即可)

(2)乙组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:
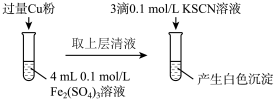
①Fe3+与Cu反应的离子方程式为___________ 。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN的化学性质与I-相似;
iii.2Cu2++4I-=2CuI↓+I2。
实验方案:
Cu2+与SCN-反应的离子方程式为 ___________ 。
(3)市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称猜测该糖浆中含有Fe2+,设计方案进行验证。
①方案ⅰ预期现象与实际现象相同,并不能证明补贴口服液中一定含有Fe2+,猜想理由是:___________ 。
②方案ⅱ中实验现象是___________ ,证明补铁口服液中含有Fe2+。
(1)甲组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为

(2)乙组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:

①Fe3+与Cu反应的离子方程式为
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN的化学性质与I-相似;
iii.2Cu2++4I-=2CuI↓+I2。
实验方案:
| 实验方案 | 现象 |
| 步骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液 | 无明显现象 |
| 步骤2:取4mL 0.1 mol/L的CuSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液 | 产生白色沉淀 |
(3)市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称猜测该糖浆中含有Fe2+,设计方案进行验证。
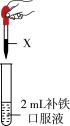 | 方案 | 试剂X |
| 方案ⅰ | 1mL 1mol/L酸性KMnO4溶液 | |
| 方案ⅱ | 依次加入5滴KSCN溶液、1mL新制氯水 |
②方案ⅱ中实验现象是
您最近一年使用:0次
名校
解题方法
4 . 进行化学实验时应强化安全意识,下列做法正确的是
| A.金属钠着火时使用泡沫灭火器灭火 |
| B.浓硫酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处 |
| C.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉 |
| D.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
您最近一年使用:0次
2024-01-25更新
|
92次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市第101中学2023-2024学年高一上学期1月期末化学试题
名校
5 . 电子工业中,人们常用FeCl3溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
(1)请用化学方程式表示制造印刷电路板的反应原理_________________ 。
为了从腐蚀废液中回收铜并重新获得FeCl3溶液,可采用以下步骤:
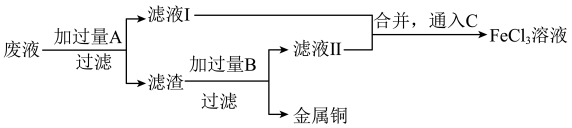
(2)写出回收铜并重新获得FeCl3溶液的过程中加入的有关物质的化学式:
A________ ,B________ ,C________ 。
(3)滤液Ⅰ中的阳离子既有氧化性又有还原性,判断的依据是_________________ 。为检验该金属阳离子,可设计的实验操作及实验现象为_________________ (可选择的试剂为“锌片”、KSCN溶液、“酸性H2O2”、“酸性KMnO4溶液”或“NaOH溶液”),且该过程发生的氧化还原反应离子方程式为_______________ 。
(4)上述步骤中,通入C发生反应的离子方程式为___________________ 。
(1)请用化学方程式表示制造印刷电路板的反应原理
为了从腐蚀废液中回收铜并重新获得FeCl3溶液,可采用以下步骤:

(2)写出回收铜并重新获得FeCl3溶液的过程中加入的有关物质的化学式:
A
(3)滤液Ⅰ中的阳离子既有氧化性又有还原性,判断的依据是
(4)上述步骤中,通入C发生反应的离子方程式为
您最近一年使用:0次
2024-01-09更新
|
67次组卷
|
2卷引用:新疆乌鲁木齐市实验学校2023-2024学年高一上学期1月期末化学试题
名校
解题方法
6 . 磷酸亚铁[ ]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以
]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以 、
、 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为
 。合成磷酸亚铁的装置如图。
。合成磷酸亚铁的装置如图。

回答下列问题:
(1)仪器A的名称为___________ 。
(2)实验中需要210 0.1
0.1
 溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有
溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有___________ ,需要称量的绿矾( )的质量为
)的质量为___________ g。
(3)实验中应使用煮沸并冷却的蒸馏水配制酸性 溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为
溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为___________ 。
(4)实验时,在仪器A中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入 与
与 混合溶液至
混合溶液至 ,再滴入
,再滴入 溶液,最终维持
溶液,最终维持 。用抗坏血酸稀溶液作底液的作用是
。用抗坏血酸稀溶液作底液的作用是___________ 。
(5)生成的 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是___________ 。
(6)某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠(含 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到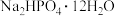 晶体。已知:
晶体。已知: 溶液的
溶液的 在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;
在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;___________ ,冷却结晶,过滤、洗涤及干燥。[实验中可选用的试剂: 溶液、0.1
溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、活性炭]
溶液、活性炭]
 ]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以
]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以 、
、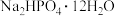 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为
 。合成磷酸亚铁的装置如图。
。合成磷酸亚铁的装置如图。
回答下列问题:
(1)仪器A的名称为
(2)实验中需要210
 0.1
0.1
 溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有
溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有 )的质量为
)的质量为(3)实验中应使用煮沸并冷却的蒸馏水配制酸性
 溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为
溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为(4)实验时,在仪器A中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入
 与
与 混合溶液至
混合溶液至 ,再滴入
,再滴入 溶液,最终维持
溶液,最终维持 。用抗坏血酸稀溶液作底液的作用是
。用抗坏血酸稀溶液作底液的作用是(5)生成的
 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是(6)某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠(含
 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到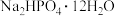 晶体。已知:
晶体。已知: 溶液的
溶液的 在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;
在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水; 溶液、0.1
溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、活性炭]
溶液、活性炭]
您最近一年使用:0次
2023-10-22更新
|
321次组卷
|
3卷引用:新疆生产建设兵团第二中学(新疆兵团地州学校)2023-2024学年高三上学期期中联考化学试题
名校
解题方法
7 . 铁是人类较早使用的金属之一,运用所学知识,回答下列问题。
I.某学习小组研究 腐蚀铜后所得的废液成分并回收铜,进行了如下实验:
腐蚀铜后所得的废液成分并回收铜,进行了如下实验:
(1)从 腐蚀铜后的废液中回收铜,并获得
腐蚀铜后的废液中回收铜,并获得 溶液,设计如下方案:
溶液,设计如下方案:
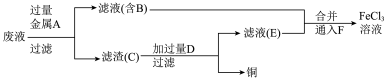
滤渣C中所含物质的化学式为___________ ;通入F发生反应的离子方程式为___________ 。
II.学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验。
请回答:
(2)实验I中反应的化学方程式是___________ 。
(3)甲同学观察到实验I中持续产生肥皂泡,但实验II中溶液B未呈现红色,则溶液B未呈现红色的原因是___________ 。(写出反应的离子方程式)
(4)实验室在制备 时必须隔绝空气,否则发生的现象是
时必须隔绝空气,否则发生的现象是___________ ;反应化学方程式为___________ 。
I.某学习小组研究
 腐蚀铜后所得的废液成分并回收铜,进行了如下实验:
腐蚀铜后所得的废液成分并回收铜,进行了如下实验:(1)从
 腐蚀铜后的废液中回收铜,并获得
腐蚀铜后的废液中回收铜,并获得 溶液,设计如下方案:
溶液,设计如下方案:
滤渣C中所含物质的化学式为
II.学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验。
| 实验I | 实验II |
 |  |
(2)实验I中反应的化学方程式是
(3)甲同学观察到实验I中持续产生肥皂泡,但实验II中溶液B未呈现红色,则溶液B未呈现红色的原因是
(4)实验室在制备
 时必须隔绝空气,否则发生的现象是
时必须隔绝空气,否则发生的现象是
您最近一年使用:0次
名校
8 . 回答下列问题:
(1)①在现代半导体工业生产中,常利 腐蚀铜的原理制作印刷线路板,该原理的离子方程式为
腐蚀铜的原理制作印刷线路板,该原理的离子方程式为_______ 。
②氯化铁溶液中同时加入铁粉和铜粉,反应结束后烧杯底部不可能出现的是_______ 。
A.有铁无铜 B.有铜无铁 C.有铁有铜 D.无铁无铜
(2)某同学在 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入
煤油,再于液面下依次加入 滴
滴 溶液和几滴氯水,溶液变红,煤油的作用是
溶液和几滴氯水,溶液变红,煤油的作用是_______ 。
(3)某同学取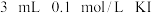 溶液,加入
溶液,加入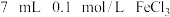 溶液混合。分别取此溶液于
溶液混合。分别取此溶液于 支试管中进行如下实验:
支试管中进行如下实验:
①第一支试管中加入 滴淀粉溶液,溶液显蓝色;
滴淀粉溶液,溶液显蓝色;
②第二支试管中加入 滴
滴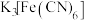 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;
③第三支试管中加入 滴
滴_______ 溶液,溶液变红。
实验②检验的离子可能是_______  填离子符号
填离子符号 ;写出
;写出 与
与 反应的离子方程式
反应的离子方程式_______ 。上述 和
和 溶充分反应后,溶液中
溶充分反应后,溶液中 浓度为
浓度为_______ 。
(4)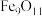 中铁元素形式为
中铁元素形式为 和
和 ,则
,则 和
和 离子质量之比为
离子质量之比为_______ 。
(1)①在现代半导体工业生产中,常利
 腐蚀铜的原理制作印刷线路板,该原理的离子方程式为
腐蚀铜的原理制作印刷线路板,该原理的离子方程式为②氯化铁溶液中同时加入铁粉和铜粉,反应结束后烧杯底部不可能出现的是
A.有铁无铜 B.有铜无铁 C.有铁有铜 D.无铁无铜
(2)某同学在
 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入
煤油,再于液面下依次加入 滴
滴 溶液和几滴氯水,溶液变红,煤油的作用是
溶液和几滴氯水,溶液变红,煤油的作用是(3)某同学取
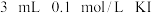 溶液,加入
溶液,加入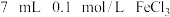 溶液混合。分别取此溶液于
溶液混合。分别取此溶液于 支试管中进行如下实验:
支试管中进行如下实验:①第一支试管中加入
 滴淀粉溶液,溶液显蓝色;
滴淀粉溶液,溶液显蓝色;②第二支试管中加入
 滴
滴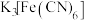 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;③第三支试管中加入
 滴
滴实验②检验的离子可能是
 填离子符号
填离子符号 ;写出
;写出 与
与 反应的离子方程式
反应的离子方程式 和
和 溶充分反应后,溶液中
溶充分反应后,溶液中 浓度为
浓度为(4)
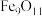 中铁元素形式为
中铁元素形式为 和
和 ,则
,则 和
和 离子质量之比为
离子质量之比为
您最近一年使用:0次
名校
9 . 常温下,下列离子在指定的水溶液中能大量共存的是
A. 的溶液中: 的溶液中: 、 、 、 、 、 、 |
B.在 溶液中: 溶液中: 、 、 、 、 、 、 |
C.含有大量 的溶液中: 的溶液中: 、 、 、 、 、 、 |
D.能使酚酞变红的溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次
2023-01-11更新
|
409次组卷
|
6卷引用:新疆 乌鲁木齐市第十二中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
10 . 下列试剂不能使 转化为
转化为 的是
的是
①氯水 ②NaCl溶液 ③酸性 ④
④ 溶液 ⑤盐酸 ⑥
溶液 ⑤盐酸 ⑥ 溶液
溶液
 转化为
转化为 的是
的是①氯水 ②NaCl溶液 ③酸性
 ④
④ 溶液 ⑤盐酸 ⑥
溶液 ⑤盐酸 ⑥ 溶液
溶液| A.②⑤⑥ | B.①③④ | C.②④⑤ | D.①②③ |
您最近一年使用:0次
2023-01-11更新
|
185次组卷
|
4卷引用:新疆生产建设兵团第二中学2022-2023学年高一上学期期末考试化学试题



