名校
解题方法
1 . 下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中: 、Na+、[Al(OH)4]-、
、Na+、[Al(OH)4]-、
③加入Al能放出H2的溶液中:Cl-、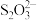 、
、 、
、
④由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、 、SCN-、
、SCN-、
⑥酸性溶液中:Fe2+、Al3+、NO 、I-、Cl-
、I-、Cl-
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中:
 、Na+、[Al(OH)4]-、
、Na+、[Al(OH)4]-、
③加入Al能放出H2的溶液中:Cl-、
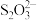 、
、 、
、
④由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、
 、SCN-、
、SCN-、
⑥酸性溶液中:Fe2+、Al3+、NO
 、I-、Cl-
、I-、Cl-| A.①② | B.③⑥ | C.②④ | D.③⑤ |
您最近一年使用:0次
2023-08-26更新
|
1315次组卷
|
3卷引用:第1课时 离子反应发生的条件
名校
2 . 下列表示反应的离子方程式正确的是
A.向 溶液中通入过量的氯气: 溶液中通入过量的氯气: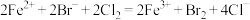 |
B. 溶液与少量的 溶液与少量的 溶液混合: 溶液混合: |
C.将 溶液滴入明矾 溶液滴入明矾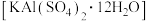 溶液中至沉淀质量最大: 溶液中至沉淀质量最大: |
D.用醋酸和淀粉-KI溶液检验加碘盐中的 : : |
您最近一年使用:0次
2023-07-19更新
|
1856次组卷
|
4卷引用:广东省阳江市2023-2024学年高二上学期10月月考化学试题
解题方法
3 . 某小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
【实验1】试剂:酸化的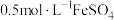 溶液(
溶液( ),
),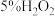 溶液(
溶液( )
)
(1)上述实验中 溶液与
溶液与 溶液反应的离子方程式是
溶液反应的离子方程式是_______ 。
(2)产生气泡的原因是_______ 。
【实验Ⅱ】试剂:未酸化的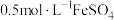 溶液(
溶液( ),
), 溶液(
溶液( )
)
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加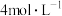 盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有
盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有 ,经检验还含有
,经检验还含有 。检验棕黄色沉淀中
。检验棕黄色沉淀中 的方法是
的方法是_______ 。
(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ. 溶液氧化
溶液氧化 消耗
消耗
ⅱ. 氧化的产物发生了水解
氧化的产物发生了水解
①根据实验Ⅱ记录否定假设ⅰ,理由是_______ 。
②实验验证假设ⅱ:取_______ ,加热,溶液变为红褐色, 下降,证明假设ⅱ成立。
下降,证明假设ⅱ成立。
(5)将 溶液加入
溶液加入 溶液后,产生红褐色胶体,反应的离子方程式是:
溶液后,产生红褐色胶体,反应的离子方程式是:_______ 。
 溶液的反应。
溶液的反应。【实验1】试剂:酸化的
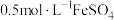 溶液(
溶液( ),
),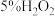 溶液(
溶液( )
)| 操作 | 现象 |
取 上述 上述 溶液于试管中,加入5滴 溶液于试管中,加入5滴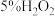 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与
溶液与 溶液反应的离子方程式是
溶液反应的离子方程式是(2)产生气泡的原因是
【实验Ⅱ】试剂:未酸化的
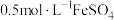 溶液(
溶液( ),
), 溶液(
溶液( )
)| 操作 | 现象 |
取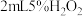 溶液于试管中,加入5滴上述 溶液于试管中,加入5滴上述 溶液 溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液 |
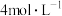 盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有
盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有 ,经检验还含有
,经检验还含有 。检验棕黄色沉淀中
。检验棕黄色沉淀中 的方法是
的方法是(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ.
 溶液氧化
溶液氧化 消耗
消耗
ⅱ.
 氧化的产物发生了水解
氧化的产物发生了水解①根据实验Ⅱ记录否定假设ⅰ,理由是
②实验验证假设ⅱ:取
 下降,证明假设ⅱ成立。
下降,证明假设ⅱ成立。(5)将
 溶液加入
溶液加入 溶液后,产生红褐色胶体,反应的离子方程式是:
溶液后,产生红褐色胶体,反应的离子方程式是:
您最近一年使用:0次
2023-07-05更新
|
350次组卷
|
3卷引用:广东省汕头市2022-2023学年高二下学期7月期末考试化学试题
4 . 硅氯仿( ,熔点
,熔点 ,沸点
,沸点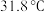 )遇水分解,易发生氧化反应,实验室利用硅粉和氯化氢在温度为
)遇水分解,易发生氧化反应,实验室利用硅粉和氯化氢在温度为 条件下制备硅氯仿。
条件下制备硅氯仿。
回答下列问题:
(1)实验室将 固体与浓
固体与浓 混合加热制取
混合加热制取 。
。

①选用图甲所示装置制取并收集一瓶纯净且干燥的 ,连接顺序为
,连接顺序为___________ (用小写字母表示,气流方向从左往右,个别装置可以多次选用)。
② 固体与浓
固体与浓 反应还生成一种酸式盐,该反应的化学方程式为
反应还生成一种酸式盐,该反应的化学方程式为___________ 。
(2)硅粉和氯化氢反应制备硅氯仿的装置如图乙所示(夹持仪器已略去)。

① 在空气中能够自燃,其中氢元素的化合价为
在空气中能够自燃,其中氢元素的化合价为___________ 。
②仪器A中发生反应的化学方程式为___________ 。
③设置装置B的目的是___________ 。
④C口需要连接丙装置的___________ (填“D”或“E”)口, 溶液的作用是:a.
溶液的作用是:a.___________ ;b.吸收氧气,防止氧气进入A中与硅氯仿反应,用离子方程式表示其吸收 的原理:
的原理:___________ 。
 ,熔点
,熔点 ,沸点
,沸点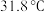 )遇水分解,易发生氧化反应,实验室利用硅粉和氯化氢在温度为
)遇水分解,易发生氧化反应,实验室利用硅粉和氯化氢在温度为 条件下制备硅氯仿。
条件下制备硅氯仿。回答下列问题:
(1)实验室将
 固体与浓
固体与浓 混合加热制取
混合加热制取 。
。
①选用图甲所示装置制取并收集一瓶纯净且干燥的
 ,连接顺序为
,连接顺序为②
 固体与浓
固体与浓 反应还生成一种酸式盐,该反应的化学方程式为
反应还生成一种酸式盐,该反应的化学方程式为(2)硅粉和氯化氢反应制备硅氯仿的装置如图乙所示(夹持仪器已略去)。

①
 在空气中能够自燃,其中氢元素的化合价为
在空气中能够自燃,其中氢元素的化合价为②仪器A中发生反应的化学方程式为
③设置装置B的目的是
④C口需要连接丙装置的
 溶液的作用是:a.
溶液的作用是:a. 的原理:
的原理:
您最近一年使用:0次
名校
5 . 下列反应的离子方程式书写正确的是
A. 溶液中通入少量 溶液中通入少量 : : |
B. 溶液中滴加少量盐酸: 溶液中滴加少量盐酸: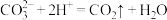 |
C. 溶液中通入过量 溶液中通入过量 : : |
D. 溶液中加入过量 溶液中加入过量 溶液: 溶液: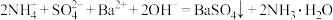 |
您最近一年使用:0次
2023-05-10更新
|
988次组卷
|
3卷引用:浙江省名校协作体2023-2024学年高二上学期开学适应性考试化学试题
名校
6 . 钴酸锂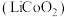 可用作锂离子电池的电极材料。以红土镍矿为原料制备
可用作锂离子电池的电极材料。以红土镍矿为原料制备 的工艺流程如图:
的工艺流程如图:

已知:①红土镍矿的主要成分有 、
、 、
、 、
、 、
、 、
、 等。
等。
②20℃时,生成氢氧化物沉淀的pH
注:金属离子起始浓度为0.1mol/L。
(1)上述流程中能加快反应速率的措施有_______ 。(写出两点)
(2) 的作用是将
的作用是将 氧化为
氧化为 。
。
①加入 发生反应的离子方程式是
发生反应的离子方程式是_______ 。
②滤渣2的主要成分是_______ (写化学式)。
(3)萃取剂RH可用于对溶液中的 、
、 的萃取率影响如图所示,萃取剂浓度的最佳取值约为
的萃取率影响如图所示,萃取剂浓度的最佳取值约为_______  。
。

(4)向反萃取后的水溶液中加入稍过量 ,得到
,得到 沉淀。将
沉淀。将 与
与 按
按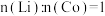 的比例混合,鼓入空气,高温烧结,得到
的比例混合,鼓入空气,高温烧结,得到 。
。
①得到 沉淀的离子方程式是
沉淀的离子方程式是_______ 。
②选择沉淀剂时,若不采用 而采用
而采用 ,产物中会混有
,产物中会混有 ,原因是
,原因是_______ 。
③在空气中烧结反应的化学方程式是_______ 。
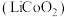 可用作锂离子电池的电极材料。以红土镍矿为原料制备
可用作锂离子电池的电极材料。以红土镍矿为原料制备 的工艺流程如图:
的工艺流程如图:
已知:①红土镍矿的主要成分有
 、
、 、
、 、
、 、
、 、
、 等。
等。②20℃时,生成氢氧化物沉淀的pH
| 离子 |  |  |  |  |  |
| 开始沉淀 | 7.0 | 1.9 | 3.4 | 7.2 | 7.1 |
| 沉淀完全 | 9.0 | 3.2 | 4.7 | 9.2 | 9.1 |
注:金属离子起始浓度为0.1mol/L。
(1)上述流程中能加快反应速率的措施有
(2)
 的作用是将
的作用是将 氧化为
氧化为 。
。①加入
 发生反应的离子方程式是
发生反应的离子方程式是②滤渣2的主要成分是
(3)萃取剂RH可用于对溶液中的
 、
、 的萃取率影响如图所示,萃取剂浓度的最佳取值约为
的萃取率影响如图所示,萃取剂浓度的最佳取值约为 。
。
(4)向反萃取后的水溶液中加入稍过量
 ,得到
,得到 沉淀。将
沉淀。将 与
与 按
按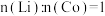 的比例混合,鼓入空气,高温烧结,得到
的比例混合,鼓入空气,高温烧结,得到 。
。①得到
 沉淀的离子方程式是
沉淀的离子方程式是②选择沉淀剂时,若不采用
 而采用
而采用 ,产物中会混有
,产物中会混有 ,原因是
,原因是③在空气中烧结反应的化学方程式是
您最近一年使用:0次
名校
7 . 某酸性溶液中可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 和
和 。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是

 、
、 、
、 、
、 、
、 、
、 、
、 、
、 和
和 。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
A.反应①发生反应的离子方程式为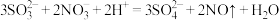 |
B.溶液中至少有6种离子大量存在,其中 一定存在,且 一定存在,且 |
C.溶液中可能含有 ,一定含有 ,一定含有 ,可取少量原溶液加入 ,可取少量原溶液加入 溶液检验 溶液检验 |
D. 、 、 、 、 一定存在, 一定存在, 、 、 一定不存在 一定不存在 |
您最近一年使用:0次
2022-11-17更新
|
1333次组卷
|
10卷引用:河北省石家庄市正定中学2022- 2023学年高二下学期期末考试化学试题
河北省石家庄市正定中学2022- 2023学年高二下学期期末考试化学试题百师联盟2023届高三上学期一轮复习联考(全国卷)化学试题宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题辽宁省葫芦岛市四校2022-2023学年高三上学期期中联考化学试题(已下线)专题03 离子反应方程式和离子共存(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题三 离子反应-实战高考·二轮复习核心突破(已下线)专题卷06 离子共存与离子推断-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)江西省百师联盟2024届高三上学期一轮复习联考化学试题江西省百师联盟2024届高三上学期9月复习联考化学试题黑龙江省海伦市第一中学2022-2023学年高三上学期1月期末考试化学试题
8 . 碘及其化合物广泛用于医药、染料等方面。碘酸是一种强酸,其水溶液有强氧化性。已知氧化性: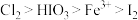 。回答下列问题:
。回答下列问题:
(1)一种以含有少量 的废液为原料制备
的废液为原料制备 的方法如图所示。
的方法如图所示。
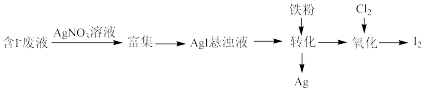
①“转化”生成的Ag溶于稀硝酸可获得硝酸银,写出Ag与稀硝酸反应的离子方程式:___________ 。
②通入 的过程中,若
的过程中,若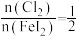 ,则反应中被氧化的元素为
,则反应中被氧化的元素为___________ (填元素符号);当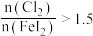 后,单质碘的产率会降低,原因是
后,单质碘的产率会降低,原因是___________ 。
(2)大量的碘由自然界的 与还原剂
与还原剂 反应制得,则该制备
反应制得,则该制备 的反应中的氧化剂和还原剂的物质的量之比为
的反应中的氧化剂和还原剂的物质的量之比为___________ 。
(3)卤素互化物 可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:
可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:___________ 。
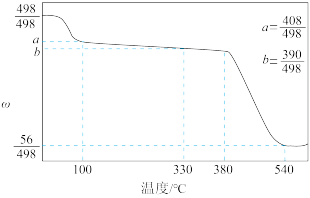
(4)碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水。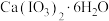 加热升温过程中剩余固体的质量分数w(
加热升温过程中剩余固体的质量分数w( )随温度变化的关系如图所示。为获得无水碘酸钙,可将
)随温度变化的关系如图所示。为获得无水碘酸钙,可将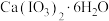 晶体
晶体___________ (填实验操作)。若将加热温度提高至540℃,则此时得到固体的主要成分为___________ (填化学式)。
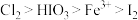 。回答下列问题:
。回答下列问题:(1)一种以含有少量
 的废液为原料制备
的废液为原料制备 的方法如图所示。
的方法如图所示。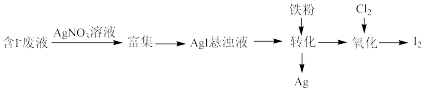
①“转化”生成的Ag溶于稀硝酸可获得硝酸银,写出Ag与稀硝酸反应的离子方程式:
②通入
 的过程中,若
的过程中,若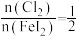 ,则反应中被氧化的元素为
,则反应中被氧化的元素为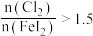 后,单质碘的产率会降低,原因是
后,单质碘的产率会降低,原因是(2)大量的碘由自然界的
 与还原剂
与还原剂 反应制得,则该制备
反应制得,则该制备 的反应中的氧化剂和还原剂的物质的量之比为
的反应中的氧化剂和还原剂的物质的量之比为(3)卤素互化物
 可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:
可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:(4)碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水。
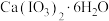 加热升温过程中剩余固体的质量分数w(
加热升温过程中剩余固体的质量分数w( )随温度变化的关系如图所示。为获得无水碘酸钙,可将
)随温度变化的关系如图所示。为获得无水碘酸钙,可将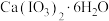 晶体
晶体
您最近一年使用:0次
2022-09-26更新
|
369次组卷
|
4卷引用:辽宁省协作校2022-2023学年高二上学期第一次考试化学试题
9 . 某同学探究Fe2+还原性的实验记录如下:
下列说法错误的是
| ① | ② | ③ |
 | 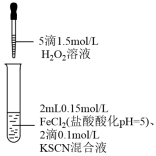 | 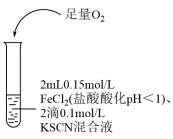 |
溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。 | 溶液变红且不褪色,有气体生成(经检验为O2),经检验有丁达尔效应。 | 溶液变红且不褪色,滴加盐酸和BaCl2溶液,无白色沉淀,经检验无丁达尔效应。 |
| A.对比①②,可以判定酸性越强,H2O2的氧化能力越强 |
| B.①中发生的氧化还原反应只有两种 |
| C.②中红色溶液中含有Fe(OH)3胶体 |
| D.③中发生的氧化还原反应为4Fe2++O2+4H+=4Fe3++2H2O |
您最近一年使用:0次
2021-10-09更新
|
1281次组卷
|
11卷引用:江西省景德镇市第一中学2021-2022学年高二上学期期末(重点班)化学试题
江西省景德镇市第一中学2021-2022学年高二上学期期末(重点班)化学试题湖南省宁远县第一中学2022-2023学年高二上学期第一次适应性考试化学试题山东省滨州市2021届高三上学期期末考试化学试题(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)山东省六校(泰安一中、菏泽一中、章丘四中、东营一中、济宁一中、聊城一中、胜利一中)2022届高三“山东学情”10月联考化学试题A卷山东省六校(泰安一中、菏泽一中、章丘四中、东营一中、济宁一中、聊城一中、胜利一中)2022届高三“山东学情”10月联考化学试题B卷(已下线)解密11 化学实验(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)湖南省永州市2023届高考第一次适应性考试化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)北京市海淀区第二十中学2022-2023学年高一上学期11月月考化学试题
10 . 某化学兴趣小组对硫酸亚铁的性质进行探究并做如下实验,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸中配制成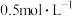 的溶液:
的溶液:
回答下列问题:
(1)进一步研究证实,黑色沉淀的主要成分是 。
。 溶液呈碱性,
溶液呈碱性, 溶液与其反应不生成
溶液与其反应不生成 而生成
而生成 的可能原因是
的可能原因是_______ 。
(2用离子方程式表示步骤ⅱ中溶液变红的原因:_______ 、_______ 。
(3)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a. 被
被 还原 b.
还原 b. 被
被 氧化 c.
氧化 c. 被
被 氧化
氧化
乙同学根据上述实验认为假设b不成立,他依据的现象是_____ 。
(4)甲同学利用上述部分试剂,通过以下实验验证了(3)中假设c成立。请将以下实验操作及现象补充完整。
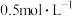 的溶液:
的溶液:| 实验序号 | 操作及现象 |
| ⅰ | 取 上述 上述 溶液于试管中,逐滴加入少量 溶液于试管中,逐滴加入少量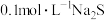 溶液,产生大量黑色沉淀 溶液,产生大量黑色沉淀 |
| ⅱ | 取 上述 上述 溶液于试管中,加入2滴 溶液于试管中,加入2滴 溶液无现象,通入一段时间 溶液无现象,通入一段时间 ,溶液变为浅红色 ,溶液变为浅红色 |
| ⅲ | 重复实验ⅱ,向浅红色溶液中加入5% 溶液至过量,产生无色气体(经检验为 溶液至过量,产生无色气体(经检验为 ),溶液变为深红色中,且红色很快褪去 ),溶液变为深红色中,且红色很快褪去 |
(1)进一步研究证实,黑色沉淀的主要成分是
 。
。 溶液呈碱性,
溶液呈碱性, 溶液与其反应不生成
溶液与其反应不生成 而生成
而生成 的可能原因是
的可能原因是(2用离子方程式表示步骤ⅱ中溶液变红的原因:
(3)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a.
 被
被 还原 b.
还原 b. 被
被 氧化 c.
氧化 c. 被
被 氧化
氧化乙同学根据上述实验认为假设b不成立,他依据的现象是
(4)甲同学利用上述部分试剂,通过以下实验验证了(3)中假设c成立。请将以下实验操作及现象补充完整。
| 步骤 | 试剂及操作 | 现象 |
| 1 | 取实验ⅲ中褪色后溶液少量于试管,滴加 溶液 溶液 | ① |
| 2 | ② | 溶液变为红色 |
您最近一年使用:0次
2021-06-25更新
|
266次组卷
|
2卷引用:山东省莱州市2020-2021学年高二下学期期末考试化学试题



