解题方法
1 . 硫酸亚铁晶体 在医药上作补血剂。某课外小组取10片补血剂总质量wg,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量wg,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(1)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加___________ 后,溶液变为红色,证实了怀疑。
(2)步骤②反应的离子方程式为___________ ,下列物质中可以用来代替该步骤中的 是
是___________ (填序号)。
① 溶液②氯水③稀盐酸④碳酸钠
溶液②氯水③稀盐酸④碳酸钠
(3)服用维生素C可使食物中的 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的___________ 性。假设实验中的损耗忽略不计,则该补血剂含铁元素的质量分数为___________ 。
 在医药上作补血剂。某课外小组取10片补血剂总质量wg,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量wg,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(1)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加
(2)步骤②反应的离子方程式为
 是
是①
 溶液②氯水③稀盐酸④碳酸钠
溶液②氯水③稀盐酸④碳酸钠(3)服用维生素C可使食物中的
 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的
您最近一年使用:0次
2 . 碘是一种紫黑色固体,微溶于水,碘单质及碘的化合物被广泛用于医疗、染料等方面。一种以海水为原料制备碘单质的方法如图所示。
(1)将海水中的 “富集”得到悬浊液,有关反应的离子方程式是
“富集”得到悬浊液,有关反应的离子方程式是________ 。
(2)“转化”时用铁粉而不用铁片的原因是________ 。 进入“氧化”环节,通入
进入“氧化”环节,通入 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为________ ;若反应物用量比 时,氧化产物为
时,氧化产物为________ ;
(3)欲判断经一系列处理后的水溶液中是否含有 ,应进行的操作是
,应进行的操作是________ 。
(4)成品中 的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取
的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取 的
的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的
溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的 用
用 溶液除去,反应式为
溶液除去,反应式为 。测定时消耗
。测定时消耗 溶液体积VmL样品中
溶液体积VmL样品中 的含量为
的含量为________ (用质量分数表示)。

(1)将海水中的
 “富集”得到悬浊液,有关反应的离子方程式是
“富集”得到悬浊液,有关反应的离子方程式是(2)“转化”时用铁粉而不用铁片的原因是
 进入“氧化”环节,通入
进入“氧化”环节,通入 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为 时,氧化产物为
时,氧化产物为(3)欲判断经一系列处理后的水溶液中是否含有
 ,应进行的操作是
,应进行的操作是(4)成品中
 的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取
的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取 的
的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的
溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的 用
用 溶液除去,反应式为
溶液除去,反应式为 。测定时消耗
。测定时消耗 溶液体积VmL样品中
溶液体积VmL样品中 的含量为
的含量为
您最近一年使用:0次
3 . Ⅰ.“价类”二维图是学习元素及其化合物的重要工具.如图所示是铁及其化合物的“价类”二维图。__________ 、__________ ;Z在空气中转化为W的化学方程式为__________ 。
(2)含重铬酸根离子 的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾
的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾 作处理剂,发生反应的离子方程式为
作处理剂,发生反应的离子方程式为 ,则该反应中还原性:
,则该反应中还原性:
______ (填“>”或“<”) 。该反应中,每生成
。该反应中,每生成 ,消耗
,消耗 的质量为
的质量为__________ g。
Ⅱ.硫酸亚铁晶体 在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(3)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加__________ 后,溶液变为红色,证实了怀疑。
(4)步骤②反应的离子方程式为__________ ,下列物质中可以用来代替该步骤中的 是
是__________ (填序号)。
① 溶液 ②氯水 ③稀盐酸 ④碳酸钠
溶液 ②氯水 ③稀盐酸 ④碳酸钠
(5)服用维生素C可使食物中的 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的__________ 性。假设实验中的损耗忽略不计,则该补血剂含铁元素的质量分数为__________ 。

(2)含重铬酸根离子
 的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾
的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾 作处理剂,发生反应的离子方程式为
作处理剂,发生反应的离子方程式为 ,则该反应中还原性:
,则该反应中还原性:
 。该反应中,每生成
。该反应中,每生成 ,消耗
,消耗 的质量为
的质量为Ⅱ.硫酸亚铁晶体
 在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(3)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加
(4)步骤②反应的离子方程式为
 是
是①
 溶液 ②氯水 ③稀盐酸 ④碳酸钠
溶液 ②氯水 ③稀盐酸 ④碳酸钠(5)服用维生素C可使食物中的
 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的
您最近一年使用:0次
2024-01-24更新
|
143次组卷
|
2卷引用:四川省内江市2023-2024学年高一上学期期末检测题化学试题
4 . 铁及其化合物在生产、生活中有重要作用。回答下列问题:
I.硫酸亚铁晶体 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
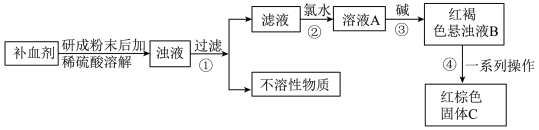
(1)检验经步骤①得到的滤液中是否含有 的方法为
的方法为______ 。
(2)步骤②加入氯水发生反应的离子方程式是______ 。
(3)步骤③产生的红褐色物质成分是______ (写化学式)。
(4)步骤④中一系列操作为______ 、洗涤、干燥、灼烧。
(5)若所取补血剂质量为 ,最终得到红棕色固体
,最终得到红棕色固体 的质量为
的质量为 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为______ (用含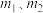 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。
II.高铁酸钾 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:

(6)过程①制取 ,理论上需要
,理论上需要 的物质的量为
的物质的量为______ 。步骤②中反应能够发生的原因是______ 。实验室用 饱和溶液制备
饱和溶液制备 胶体的方法是:取
胶体的方法是:取 小烧杯,加入
小烧杯,加入 蒸馏水,将蒸馏水加热至沸腾
蒸馏水,将蒸馏水加热至沸腾______ (将操作补充完整)。
I.硫酸亚铁晶体
 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
(1)检验经步骤①得到的滤液中是否含有
 的方法为
的方法为(2)步骤②加入氯水发生反应的离子方程式是
(3)步骤③产生的红褐色物质成分是
(4)步骤④中一系列操作为
(5)若所取补血剂质量为
 ,最终得到红棕色固体
,最终得到红棕色固体 的质量为
的质量为 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为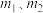 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。II.高铁酸钾
 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
(6)过程①制取
 ,理论上需要
,理论上需要 的物质的量为
的物质的量为 饱和溶液制备
饱和溶液制备 胶体的方法是:取
胶体的方法是:取 小烧杯,加入
小烧杯,加入 蒸馏水,将蒸馏水加热至沸腾
蒸馏水,将蒸馏水加热至沸腾
您最近一年使用:0次
5 . 铁泥是钢铁厂废弃物,经分析其成分如下表:
已知杂质不溶于酸。
综合利用废弃物,对资源利用和环境保护具有现实意义,铁泥常用于制备铁红,实验室模拟其工艺流程如下:

(1)酸浸过程中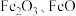 与硫酸反应的离子方程式为
与硫酸反应的离子方程式为_______ 、_______ 。
(2)转化过程中发生反应的离子方程式为______________ 。从经济环保角度考虑,“转化”中可替代 的物质是
的物质是_______ 。检验溶液中的 常用的试剂是
常用的试剂是_______ 。
(3)滤液2中含有的主要离子有_______ 。
(4)煅烧步骤的化学反应方程式为______________
| 成分 |  |  |  |  | 水分 | 杂质 |
质量分数 | 74.25 | 7.28 | 3.56 | 3.67 | 8.12 | 3.12 |
综合利用废弃物,对资源利用和环境保护具有现实意义,铁泥常用于制备铁红,实验室模拟其工艺流程如下:

(1)酸浸过程中
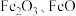 与硫酸反应的离子方程式为
与硫酸反应的离子方程式为(2)转化过程中发生反应的离子方程式为
 的物质是
的物质是 常用的试剂是
常用的试剂是(3)滤液2中含有的主要离子有
(4)煅烧步骤的化学反应方程式为
您最近一年使用:0次
名校
6 . 工业上用赤铁矿(主要成分为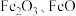 ,含
,含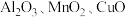 等杂质)制备绿矾
等杂质)制备绿矾 的流程如下:
的流程如下: 能与
能与 溶液反应生成可溶性盐
溶液反应生成可溶性盐 。
。
回答下列问题:
(1)试剂a为___________ 。
(2)试剂b需过量,其目的是___________ ;“滤渣”的成分是___________ 。
(3)“结晶”需隔绝空气,原因是___________ 。
(4)绿矾隔绝空气加强热可用于制备红色颜料铁红。取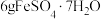 样品隔绝空气加热(杂质不反应),受热过程中样品质量随温度变化的曲线如图所示(已知固体
样品隔绝空气加热(杂质不反应),受热过程中样品质量随温度变化的曲线如图所示(已知固体 不含结晶水)。
不含结晶水)。 主要成分的化学式为
主要成分的化学式为___________ 。
②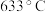 时,除生成铁红外,同时生成能使
时,除生成铁红外,同时生成能使 溶液变浑浊的气体和使品红溶液裉色的气体。该温度下反应的化学方程式为
溶液变浑浊的气体和使品红溶液裉色的气体。该温度下反应的化学方程式为___________ ;该样品中 的质量分数为
的质量分数为___________  (保留一位小数)。
(保留一位小数)。
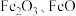 ,含
,含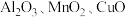 等杂质)制备绿矾
等杂质)制备绿矾 的流程如下:
的流程如下: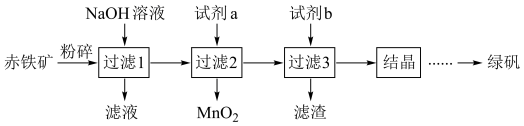
 能与
能与 溶液反应生成可溶性盐
溶液反应生成可溶性盐 。
。回答下列问题:
(1)试剂a为
(2)试剂b需过量,其目的是
(3)“结晶”需隔绝空气,原因是
(4)绿矾隔绝空气加强热可用于制备红色颜料铁红。取
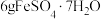 样品隔绝空气加热(杂质不反应),受热过程中样品质量随温度变化的曲线如图所示(已知固体
样品隔绝空气加热(杂质不反应),受热过程中样品质量随温度变化的曲线如图所示(已知固体 不含结晶水)。
不含结晶水)。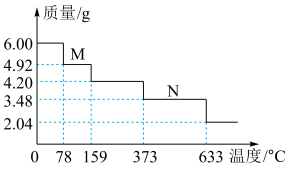
 主要成分的化学式为
主要成分的化学式为②
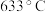 时,除生成铁红外,同时生成能使
时,除生成铁红外,同时生成能使 溶液变浑浊的气体和使品红溶液裉色的气体。该温度下反应的化学方程式为
溶液变浑浊的气体和使品红溶液裉色的气体。该温度下反应的化学方程式为 的质量分数为
的质量分数为 (保留一位小数)。
(保留一位小数)。
您最近一年使用:0次
2024-02-02更新
|
263次组卷
|
3卷引用:山东省潍坊市2023-2024学年高一上学期期末考试化学试题
解题方法
7 . 有某种含有少量 杂质的
杂质的 样品,现要测定其中铁元素的质量分数,实验采用下列步骤进行:
样品,现要测定其中铁元素的质量分数,实验采用下列步骤进行:
①准确称量mg样品(在2~3g范围内);
②向样品中加入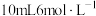 的盐酸,再加入蒸馏水,配制成250mL溶液;
的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中所配的溶液,加入3mL氯水,加热使其反应完全;
④趁热迅速加入10%的氨水至过量,充分搅拌,使沉淀完全;
⑤过滤,将沉淀洗涤后,灼烧、冷却、称重,并重复操作至恒重,若坩埚质量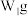 ,坩埚及灼烧后的固体总质量为
,坩埚及灼烧后的固体总质量为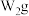 。
。
下列说法正确的是
 杂质的
杂质的 样品,现要测定其中铁元素的质量分数,实验采用下列步骤进行:
样品,现要测定其中铁元素的质量分数,实验采用下列步骤进行:①准确称量mg样品(在2~3g范围内);
②向样品中加入
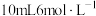 的盐酸,再加入蒸馏水,配制成250mL溶液;
的盐酸,再加入蒸馏水,配制成250mL溶液;③量取25mL操作②中所配的溶液,加入3mL氯水,加热使其反应完全;
④趁热迅速加入10%的氨水至过量,充分搅拌,使沉淀完全;
⑤过滤,将沉淀洗涤后,灼烧、冷却、称重,并重复操作至恒重,若坩埚质量
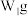 ,坩埚及灼烧后的固体总质量为
,坩埚及灼烧后的固体总质量为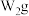 。
。下列说法正确的是
A.步骤③中的离子反应为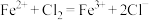 |
B.最后坩埚中的固体是 和 和 |
C.样品中铁元素的质量分数为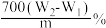 |
D.向样品水溶液中先通 再滴加 再滴加 溶液,出现血红色,判断有 溶液,出现血红色,判断有 |
您最近一年使用:0次
8 . 铁是人类较早使用的金属之一,根据铁及其化合物之间的相互转化,回答下列问题:
(1)Fe2+易被人体吸收,医生建议在服用补铁剂时,同时服用维生素C.维生素C的作用是______ 。
(2)印刷电路板的制作原理是用足量的FeCl3溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的离子方程式:______ 。
(3)某废料铁泥的主要成分为Fe2O3、FeO、Fe和杂质(杂质不与硫酸反应)。现取wg废料铁泥提取Fe2O3,设计实验流程如下:

①分离溶液A和沉淀C的实验操作为______ 。
②能检验溶液A中含有Fe2+的试剂是______ (填字母)。
A.铁粉 B.酸性KMnO4溶液 C.KSCN溶液
③步骤Ⅱ中发生反应的离子方程式为______ 。
④若最终获得ngFe2O3,则废料铁泥中铁元素的质量分数为______ 。
(1)Fe2+易被人体吸收,医生建议在服用补铁剂时,同时服用维生素C.维生素C的作用是
(2)印刷电路板的制作原理是用足量的FeCl3溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的离子方程式:
(3)某废料铁泥的主要成分为Fe2O3、FeO、Fe和杂质(杂质不与硫酸反应)。现取wg废料铁泥提取Fe2O3,设计实验流程如下:

①分离溶液A和沉淀C的实验操作为
②能检验溶液A中含有Fe2+的试剂是
A.铁粉 B.酸性KMnO4溶液 C.KSCN溶液
③步骤Ⅱ中发生反应的离子方程式为
④若最终获得ngFe2O3,则废料铁泥中铁元素的质量分数为
您最近一年使用:0次
9 . 现有某种仅由Fe3O4和Fe2O3组成的含铁氧化物样品,为测定此样品中Fe3O4的质量分数,实验采用下列步骤进行:
①准确称量m1g样品,将样品加入过量稀盐酸中,微热,使固体样品完全溶解;
②向步骤①所得溶液中加入过量的双氧水,把溶液中的Fe2+氧化为Fe3+;
③向步骤②所得溶液中加入NaOH溶液至过量,小火加热煮沸;
④冷却后过滤,将沉淀洗涤后移至坩埚中,灼烧、冷却、托盘天平称重,并重复操作至恒重。
(1)在Fe3O4中Fe有+2价和+3价两种价态,则在Fe3O4中+2价铁和+3价铁的原子个数之比为___________ ;请写出Fe2O3与盐酸反应的离子方程式:___________ 。
(2)步骤②中加入双氧水发生反应的离子方程式为___________ ,该反应中氧化剂为___________ (填化学式)。
(3)步骤④中判断沉淀完全分解的依据是___________ 。
(4)若坩埚质量为m2g,坩埚及灼烧后的固体总质量为m3g,则样品中Fe3O4的质量分数为___________ (用含m1、m2、m3的代数式表示)。若步骤④中沉淀未完全分解,则测得的Fe3O4的质量分数___________ (填“偏大”、“偏小”或“不变”)。
①准确称量m1g样品,将样品加入过量稀盐酸中,微热,使固体样品完全溶解;
②向步骤①所得溶液中加入过量的双氧水,把溶液中的Fe2+氧化为Fe3+;
③向步骤②所得溶液中加入NaOH溶液至过量,小火加热煮沸;
④冷却后过滤,将沉淀洗涤后移至坩埚中,灼烧、冷却、托盘天平称重,并重复操作至恒重。
(1)在Fe3O4中Fe有+2价和+3价两种价态,则在Fe3O4中+2价铁和+3价铁的原子个数之比为
(2)步骤②中加入双氧水发生反应的离子方程式为
(3)步骤④中判断沉淀完全分解的依据是
(4)若坩埚质量为m2g,坩埚及灼烧后的固体总质量为m3g,则样品中Fe3O4的质量分数为
您最近一年使用:0次
2023-01-11更新
|
189次组卷
|
3卷引用:陕西省渭南市富平县蓝光中学2023-2024学年高一上学期1月期末化学试题
10 . 以铁屑(表面含少量 )为原料先制备
)为原料先制备 ,再通过灼烧、还原制备高纯度还原铁粉的工艺流程如下:
,再通过灼烧、还原制备高纯度还原铁粉的工艺流程如下:

(1)酸溶。将铁屑溶于足量的稀 中过滤所得溶液经检验不含
中过滤所得溶液经检验不含 。
。
①检验酸溶后的溶液是否含 的实验操作是
的实验操作是_______ 。
②滤液中不存在 的原因是
的原因是_______ 。
(2)沉淀、过滤。向酸溶后的溶液中滴加稍过量的 ,过滤得
,过滤得 。
。
①沉淀反应的离子方程式为_______ 。
②沉淀中 含量的测定:准确称取6.300g沉淀,加入适量蒸馏水和稀硫酸溶解、酸化,并转移入250mL容量瓶中定容,取25.00mL溶液,向其中滴加
含量的测定:准确称取6.300g沉淀,加入适量蒸馏水和稀硫酸溶解、酸化,并转移入250mL容量瓶中定容,取25.00mL溶液,向其中滴加
 溶液,完全反应时,消耗
溶液,完全反应时,消耗 溶液20.00mL。
溶液20.00mL。
过程中发生的反应为: (未配平,假设杂质不参与反应)。计算沉淀中
(未配平,假设杂质不参与反应)。计算沉淀中 (相对分子质量为180)的质量分数
(相对分子质量为180)的质量分数_______ (写出计算过程)。
(3)灼烧。在氧气流中灼烧 得
得 、
、 。
。
①灼烧时发生反应的化学方程式为_______ 。
②研究发现, 也可以灼烧得到
也可以灼烧得到 ,但灼烧
,但灼烧 得到的
得到的 比灼烧
比灼烧 得到的
得到的 更容易被还原,可能的原因是
更容易被还原,可能的原因是_______ 。
(4)还原。为制得高纯度的还原铁粉,以下还原剂最合适的是_______ 。
A.碳粉 B.铝粉 C.氢气
 )为原料先制备
)为原料先制备 ,再通过灼烧、还原制备高纯度还原铁粉的工艺流程如下:
,再通过灼烧、还原制备高纯度还原铁粉的工艺流程如下:
(1)酸溶。将铁屑溶于足量的稀
 中过滤所得溶液经检验不含
中过滤所得溶液经检验不含 。
。①检验酸溶后的溶液是否含
 的实验操作是
的实验操作是②滤液中不存在
 的原因是
的原因是(2)沉淀、过滤。向酸溶后的溶液中滴加稍过量的
 ,过滤得
,过滤得 。
。①沉淀反应的离子方程式为
②沉淀中
 含量的测定:准确称取6.300g沉淀,加入适量蒸馏水和稀硫酸溶解、酸化,并转移入250mL容量瓶中定容,取25.00mL溶液,向其中滴加
含量的测定:准确称取6.300g沉淀,加入适量蒸馏水和稀硫酸溶解、酸化,并转移入250mL容量瓶中定容,取25.00mL溶液,向其中滴加
 溶液,完全反应时,消耗
溶液,完全反应时,消耗 溶液20.00mL。
溶液20.00mL。过程中发生的反应为:
 (未配平,假设杂质不参与反应)。计算沉淀中
(未配平,假设杂质不参与反应)。计算沉淀中 (相对分子质量为180)的质量分数
(相对分子质量为180)的质量分数(3)灼烧。在氧气流中灼烧
 得
得 、
、 。
。①灼烧时发生反应的化学方程式为
②研究发现,
 也可以灼烧得到
也可以灼烧得到 ,但灼烧
,但灼烧 得到的
得到的 比灼烧
比灼烧 得到的
得到的 更容易被还原,可能的原因是
更容易被还原,可能的原因是(4)还原。为制得高纯度的还原铁粉,以下还原剂最合适的是
A.碳粉 B.铝粉 C.氢气
您最近一年使用:0次
2022-08-29更新
|
671次组卷
|
3卷引用:17 2024年苏州昆山周市高级中学高一3月月考



