(1)PM2.5分散在空气中形成的分散系
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl- |
| 浓度/mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(4)硫酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为
②某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸
2 . 氨基磺酸(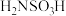 )可用于合成除草剂、防火剂、金属清洗剂等,它微溶于乙醇,260℃时分解,在沸水中反应:
)可用于合成除草剂、防火剂、金属清洗剂等,它微溶于乙醇,260℃时分解,在沸水中反应: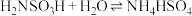 。实验室可用羟胺(
。实验室可用羟胺(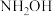 )与
)与 反应制备氨基磺酸,反应为
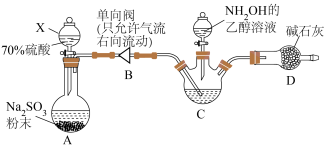
反应制备氨基磺酸,反应为 ,其反应装置如图所示(夹持装置等未画出)。
,其反应装置如图所示(夹持装置等未画出)。
已知: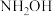 性质不稳定,室温下吸收水汽和
性质不稳定,室温下吸收水汽和 时,迅速分解,加热时爆炸。
时,迅速分解,加热时爆炸。
(1)仪器X的作用是
(2)“单向阀”的作用是
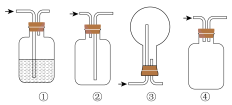
(3)实验时,应先打开装置
(4)该装置还存在一处明显的问题,改进的办法是
(5)氨基磺酸粗品经结晶、过滤、重结晶等操作精制得纯品,其中洗涤氨基磺酸可用
 为紫色固体,易溶于水,微溶于
为紫色固体,易溶于水,微溶于 溶液,不溶于乙醇;有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生
溶液,不溶于乙醇;有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生 。
。
(1)A中发生反应的离子反应方程式是
(2)下列试剂中,装置B的X溶液可以选用的是__________(填标号)。
| A.饱和食盐水 | B.浓盐酸 | C.饱和氯水 | D. 溶液 溶液 |
(3)C中得到紫色固体和溶液,生成
 的化学方程式是
的化学方程式是 固体,可以采取的一种措施是
固体,可以采取的一种措施是(4)高铁酸钾与水反应的离子方程式是
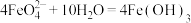 (胶体)
(胶体) ,则其作为水处理剂的原理是
,则其作为水处理剂的原理是(5)某同学设计如图装置制备一定量的
 ,并使其能在较长时间内存在。
,并使其能在较长时间内存在。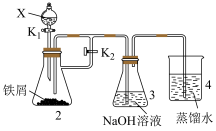
X不能是硝酸,原因是
②H2O受热易分解。
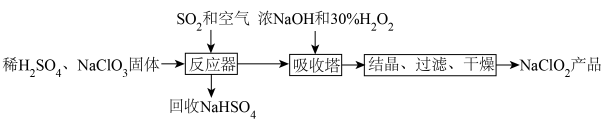
(1)向“反应器”中鼓入空气的作用是
(2)“吸收塔”的作用是将产生的ClO2转化为NaClO2,在此过程中加入的H2O2的作用是
(3)“吸收塔”中需要控制温度不超过20℃,其原因是
(4)写出“反应器”步骤中生成ClO2的离子方程式
5 . Ⅰ.工业生产纯碱的工艺流程示意图如图:
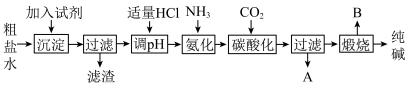
(1)为除去粗盐水中的
 、
、 、
、 等杂质离子,加入试剂顺序合理的是______。
等杂质离子,加入试剂顺序合理的是______。| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是
(3)工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
(4)碳酸化后过滤,滤液A最主要的成分是
Ⅱ.纯碱在生产生活中有广泛的用途。
(5)工业上,可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为
6 . 某学习小组为了验证SO2的还原性并测定产生SO2的质量,组装了下图装置。回答下列问题:(已知:K3[Fe(CN)6]可检验亚铁离子,生成蓝色沉淀)

(1)C中发生反应的化学方程式是
a.组装仪器、加入药品后检查气密性
b.实验开始和最后时均需要通入空气
c.利用A、B装置是为了减小实验误差
d.F、G中的碱石灰可以换为无水CaCl2
(2)甲同学认为很快可以看到D装置的现象,他的依据是
第一步:Fe3++SO2+H2O = Fe(HSO3)2+(棕红色)+H+ (快反应)
第二步:Fe3++ Fe(HSO3)2+ +H2O= +2Fe2++3H+ (慢反应)
+2Fe2++3H+ (慢反应)
如果需要验证第一步反应是快反应,可以事先在D装置中滴加数滴
(3)学习小组通过实验后D和F装置中的数据来计算SO2的质量。D中加入足量的BaCl2溶液充分反应,经过
已知:
I.硝酸氧化草酸溶液:3H2C2O4+2HNO3=6CO2↑+2NO↑+4H2O
Ⅱ.控制反应液温度为55~60℃,往含m1gH2C2O4的草酸溶液中边搅拌边滴加含有适量催化剂的混酸(HNO3与H2SO4)溶液。

(2)指出该套装置的错误之处:
(3)实验开始一段时间后,仍需通入氮气,此时通入氮气的作用为
(4)实验开始后,要证明有NO产生的实验操作和现象为
(5)下列各项措施中,不能提高碳含量的测定准确度的是
a.滴加混酸不宜过快
b.在加入混酸之前,排尽装置中的CO2气体
c.球形干燥管中的药品换成CaCl2
d.D中的溶液换成澄清饱和石灰水
(6)待充分反应后,将D中沉淀进行过滤、洗涤、干燥、称量,所得固体质量为m2g,则草酸中碳的含量为
(7)在实验操作规范的条件下,实验测得草酸中碳的含量比实际的大,其原因可能是
(1)实验室利用铜与浓硫酸制取SO2的化学方程式为
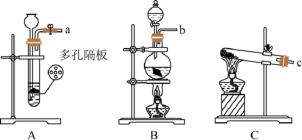
(2)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
已知:2NaHSO3
 Na2S2O5+H2O。
Na2S2O5+H2O。试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
| 实验编号 | 实验步骤 | 现象 | 结论 |
| Ⅰ | 取少量样品,加入除氧蒸馏水 | 固体完全溶解得到无色溶液 | / |
| Ⅱ | 取实验I的溶液, | 样品已氧化变质 | |
| Ⅲ | 另取实验I的溶液, | 样品未完全氧化变质 |
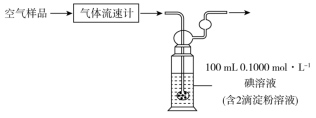
已知该反应的化学方程式为:SO2+I2+2H2O=H2SO4+2HI,若空气流速为a m3·min-1,当观察到
 溶液的反应原理。
溶液的反应原理。(1)配制溶液
用
 标准试剂配制
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有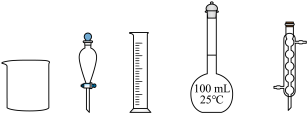
(2)测定
 溶液的pH
溶液的pH用
 溶液的pH为1.10。
溶液的pH为1.10。(3)提出假设
假设ⅰ:

假设ⅱ:
 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向
 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加 生成。
生成。实验Ⅱ:向pH=1.10的
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设
(5)查阅资料知,铜粉与
 溶液可能涉及的反应有;
溶液可能涉及的反应有;反应①:
 ;
;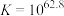 ;速率很慢。
;速率很慢。反应②:
 ;
;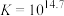 ,速率较快。
,速率较快。反应③:
 ;
;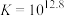 ;速率很快。
;速率很快。反应④:
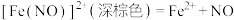
(a)对反应①来说,
 起到的作用为
起到的作用为(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到
 的存在,原因是
的存在,原因是 、
、 、FeO、
、FeO、 等)来制备绿矾(
等)来制备绿矾( )和氧化铝,其工艺流程如图:
)和氧化铝,其工艺流程如图: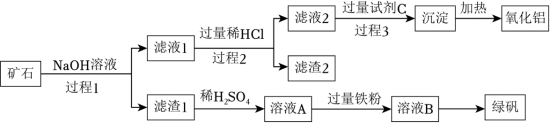
回答下列问题:
(1)过程1中能加快矿石与NaOH溶液反应速率的措施是
(2)滤渣1的主要成分是
(3)向溶液A中加入过量铁粉发生反应的离子方程式为:
(4)写出由滤液1生成滤液2的离子方程式
(5)用来配制试剂C的物质的电子式为:
(6)绿矾晶体易被空气中的氧气氧化变质,宜密封保存放置。为探究制备的绿矾样品是否变质,具体的实验操作为



