名校
解题方法
1 . 下列各组离子中,能大量共存且加入(或通入)X试剂后发生反应的离子方程式对应正确的是
| 选项 | 离子组 | 试剂X | 离子方程式 |
| A | 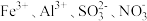 | 过量的盐酸 |  |
| B | 透明溶液中: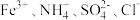 | 过量的铜粉 | 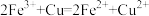 |
| C |  | 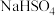 溶液 溶液 | 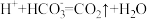 |
| D |  的溶液中: 的溶液中: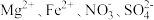 | 双氧水 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-10-10更新
|
192次组卷
|
14卷引用:四川省宜宾市叙州区第二中学2020届高三下学期第二次高考适应性考试理综化学试题
四川省宜宾市叙州区第二中学2020届高三下学期第二次高考适应性考试理综化学试题四川省内江市第六中学2022-2023学年高三上学期入学考试化学试题 陕西省西安市长安区第五中学2019届高三上学期期中考试化学试题河北省衡水市衡水中学2019届高三上学期期中考试化学试题宁夏石嘴山市第三中学2020届高三上学期期中考试化学试题福建省三明第一中学2020届高三上学期第二次月考化学试题(已下线)小题必刷04 离子共存——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷06 与量有关的离子方程式书写——2021年高考化学一轮复习小题必刷(通用版)山西省运城市永济涑北中学2020-2021学年高三上学期10月月考化学试题(已下线)第05讲 离子共存 离子的检验和推断(精练)-2022年高考化学一轮复习讲练测山西省太原市第五中学2021-2022学年高三上学期11月化学月考试题广东省梅州市兴宁市齐昌中学2022-2023学年高三上学期第二次质检考试化学试题陕西省渭南市2023-2024学年高三上学期期中检测化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二下学期期末考试化学试题
名校
解题方法
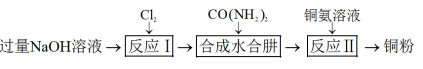
2 . 水合肼 (N2H4∙H2O)常用作航天器燃料,也广泛应用于医药生产,易被氧化。实验室制取水合肼,并模拟利用水合肼处理铜氨{ }废液回收铜粉的实验流程如图:
}废液回收铜粉的实验流程如图:
已知: 。
。
(1)反应I中温度升高时易产生副产物 ,该副反应的离子方程式为
,该副反应的离子方程式为___________ ,为提高反应I中 产率,实验中可采取的措施有
产率,实验中可采取的措施有___________ 。
A.反应容器浸入热水中 B.适当减慢通入 的速率 C.不断搅拌溶液
的速率 C.不断搅拌溶液
(2)① 与
与 反应合成水合肼的化学方程式为
反应合成水合肼的化学方程式为___________ 。
②合成过程中理论上需控制
___________ (保留2位小数),实际生产中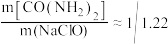 ,原因是
,原因是___________ 。
(3)生产过程中需要使用到 ,以
,以 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入计量的
溶液中加入计量的 ,生成氯化物;再向混合液中加入酸化的
,生成氯化物;再向混合液中加入酸化的 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应离子方程式为
的总反应离子方程式为___________ 。 在氯气中燃烧可以生成
在氯气中燃烧可以生成 ,
, 在高温下会分解生成
在高温下会分解生成 和
和 ,生成
,生成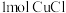 ,转移电子数为
,转移电子数为___________ 。
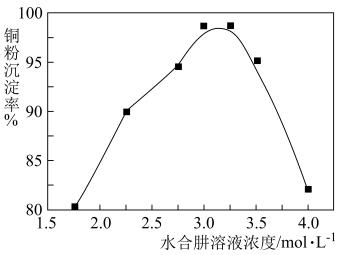
(4)铜粉沉淀率与水合肼溶液浓度的关系如图所示,为提高铜粉沉淀率,最适宜的水合肼溶液浓度为___________ 。
 }废液回收铜粉的实验流程如图:
}废液回收铜粉的实验流程如图:
已知:
 。
。(1)反应I中温度升高时易产生副产物
 ,该副反应的离子方程式为
,该副反应的离子方程式为 产率,实验中可采取的措施有
产率,实验中可采取的措施有A.反应容器浸入热水中 B.适当减慢通入
 的速率 C.不断搅拌溶液
的速率 C.不断搅拌溶液(2)①
 与
与 反应合成水合肼的化学方程式为
反应合成水合肼的化学方程式为②合成过程中理论上需控制

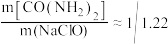 ,原因是
,原因是(3)生产过程中需要使用到
 ,以
,以 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入计量的
溶液中加入计量的 ,生成氯化物;再向混合液中加入酸化的
,生成氯化物;再向混合液中加入酸化的 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应离子方程式为
的总反应离子方程式为 在氯气中燃烧可以生成
在氯气中燃烧可以生成 ,
, 在高温下会分解生成
在高温下会分解生成 和
和 ,生成
,生成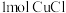 ,转移电子数为
,转移电子数为(4)铜粉沉淀率与水合肼溶液浓度的关系如图所示,为提高铜粉沉淀率,最适宜的水合肼溶液浓度为

您最近一年使用:0次
名校
解题方法
3 . 对于下列实验,能正确描述其反应的离子方程式是
A.同浓度同体积NH4HSO4溶液与NaOH溶液混合:NH +OH-=NH3·H2O +OH-=NH3·H2O |
| B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2=CaCO3↓+2H+ |
| C.向H2O2溶液中滴加少量FeCl3:2Fe3++H2O2=O2↑+2H++2Fe2+ |
D.用Na2SO3溶液吸收少量Cl2:3SO +Cl2+H2O=2HSO +Cl2+H2O=2HSO +2Cl-+SO +2Cl-+SO |
您最近一年使用:0次
2021-08-14更新
|
441次组卷
|
5卷引用:四川省蓬安中学校2020届高三上学期入学考试化学试题
四川省蓬安中学校2020届高三上学期入学考试化学试题云南省楚雄东兴中学2023-2024学年高三上学期10月月考化学试题(已下线)专题4 硫与环境保护(章末培优)-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)福建省安溪县第一中学2021-2022学年高一下学期第一次月考化学试题山东省莱州市第一中学2022-2023学年高二下学期6月月考化学试题
解题方法
4 . CuCl是重要的化工原料,研究人员提出用有机硅生产中产生的废触煤(生产中未反应的硅粉和催化剂混合物,主要成分为粉末状的硅、铜、锌和碳)来生产CuCl,并设计出如下图所示流程图。
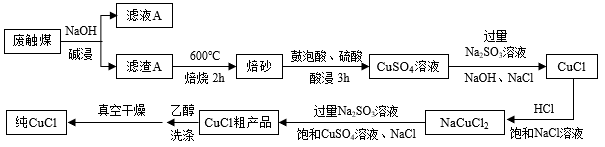
已知:氯化亚铜微溶于水,不溶于乙醇,溶于浓盐酸和氨水生成络合物。
(1)已知锌与铝性质相似,既能与强酸反应又能与强碱反应。写出碱浸时锌与NaOH反应的离子方程式___________ 。
(2)实验室模拟焙烧的过程,除三脚架外,还需要用到的实验仪器是___________ 。(从下列仪器中选出所需的仪器,填字母)
A.蒸发皿 B.坩埚 C.表面皿 D.泥三角 E酒精灯 F.干燥器 G.坩埚钳
(3)焙砂的主要成分是___________ ,写出提高焙砂浸取率和速率的两种方法___________ ,___________ 。
(4)写出由NaCuCl2生成CuCl的离子方程式___________ ,NaCl的作用是___________ ,用乙醇洗涤CuCl晶体的优点是___________ 。
(5)准确称取氯化亚铜产品10.00 g,将其置于过量的FeCl3溶液中,待样品完全溶解后加入适量稀硫酸和水配成1000 mL溶液,取50 mL用0.0500 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液16.67 mL,反应中 被还原为Cr3+,产品中CuCl的质量分数为
被还原为Cr3+,产品中CuCl的质量分数为___________ 。

已知:氯化亚铜微溶于水,不溶于乙醇,溶于浓盐酸和氨水生成络合物。
(1)已知锌与铝性质相似,既能与强酸反应又能与强碱反应。写出碱浸时锌与NaOH反应的离子方程式
(2)实验室模拟焙烧的过程,除三脚架外,还需要用到的实验仪器是
A.蒸发皿 B.坩埚 C.表面皿 D.泥三角 E酒精灯 F.干燥器 G.坩埚钳
(3)焙砂的主要成分是
(4)写出由NaCuCl2生成CuCl的离子方程式
(5)准确称取氯化亚铜产品10.00 g,将其置于过量的FeCl3溶液中,待样品完全溶解后加入适量稀硫酸和水配成1000 mL溶液,取50 mL用0.0500 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液16.67 mL,反应中
 被还原为Cr3+,产品中CuCl的质量分数为
被还原为Cr3+,产品中CuCl的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 下列实验操作的现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某钾盐溶于硝酸溶液,再滴加1~2滴品红 | 品红不褪色 | 该钾盐不含 或 或 |
| B | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| C | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,同时有黑色颗粒产生 | 钠可以置换出碳 |
| D | 向FeCl2溶液中滴加几滴K3[Fe(CN)6]溶液 | 溶液变成蓝色 | K3[Fe(CN)6]溶液可用于鉴别Fe2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-12-10更新
|
629次组卷
|
2卷引用:四川省资阳市2021届高三上学期第一次诊断性考试化学试题
6 . 某研究小组同学为探究锌与硫酸反应生成SO2、H2的临界浓度(浓硫酸能与锌反应生成SO2的最低浓度)设计了如下实验。在大试管A中加入100mL 18mol/L硫酸,向连接在塑料棒上的多孔塑料球内加入足量的锌粒(塑料棒可以上下移动),在试剂瓶D中加入足量的浓NaOH溶液(加热和夹持装置已省略)。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
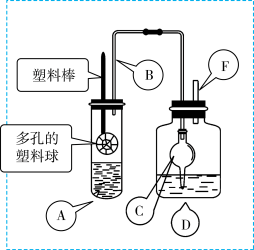
(1)请写出锌与硫酸反应产生SO2的化学方程式_______ 。
(2)在组装仪器之后,加入试剂之前必须进行的操作是__________ 。
(3)长导管B的作用是______ ,如果没有这个设计,最终测定的临界浓度会_______ 。(填“偏高”、“偏低”或“无影响”)
(4)装置中干燥管C的作用是_______ 。
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:_________ mol/L。(用含a的计算式表示,忽略体积变化)
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO 进行滴定,通过滴定出的SO
进行滴定,通过滴定出的SO 的物质的量计算临界浓度,你认为他的这一想法是否可行?
的物质的量计算临界浓度,你认为他的这一想法是否可行?______ (填“可行”或“不可行”),原因是_____ 。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。

(1)请写出锌与硫酸反应产生SO2的化学方程式
(2)在组装仪器之后,加入试剂之前必须进行的操作是
(3)长导管B的作用是
(4)装置中干燥管C的作用是
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO
 进行滴定,通过滴定出的SO
进行滴定,通过滴定出的SO 的物质的量计算临界浓度,你认为他的这一想法是否可行?
的物质的量计算临界浓度,你认为他的这一想法是否可行?
您最近一年使用:0次
2020-07-03更新
|
494次组卷
|
4卷引用:四川省阆中中学2020届高三全景模拟(最后一考)理综化学试题
四川省阆中中学2020届高三全景模拟(最后一考)理综化学试题(已下线)第一单元 物质的量测试题-2021年高考化学一轮复习名师精讲练吉林省长春外国语学校2021届高三上学期期末考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记
10-11高三上·四川成都·阶段练习
解题方法
7 . (Ⅰ)近年来我国对碳纳米管的研究也有了较大突破,即用电弧合成法来制碳纳米管,但往往有大量的碳纳米颗粒,需用氧化法来提纯这些颗粒,化学方程式为:

试回答下列问题:
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂为_______ ,被氧化的元素为________ 。
(3)H2SO4在上述反应中表现出来的性质是___ (填字母)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应若生成11 g CO2,则转移电子的数目为__________ 。
(Ⅱ)2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感(或称H1N1型猪流感)疫情,随后也不断蔓延我国各地.防控专家表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感.
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:
_______________________________________________________
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只被还原的是____ 。
A. MnO2 B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(7)漂白剂亚氯酸钠(NaClO2)在常温于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是____ 。

试回答下列问题:
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂为
(3)H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应若生成11 g CO2,则转移电子的数目为
(Ⅱ)2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感(或称H1N1型猪流感)疫情,随后也不断蔓延我国各地.防控专家表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感.
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只被还原的是
A. MnO2 B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(7)漂白剂亚氯酸钠(NaClO2)在常温于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是
您最近一年使用:0次



