名校
解题方法
1 . 下列实验操作的现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某钾盐溶于硝酸溶液,再滴加1~2滴品红 | 品红不褪色 | 该钾盐不含 或 或 |
| B | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| C | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,同时有黑色颗粒产生 | 钠可以置换出碳 |
| D | 向FeCl2溶液中滴加几滴K3[Fe(CN)6]溶液 | 溶液变成蓝色 | K3[Fe(CN)6]溶液可用于鉴别Fe2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-12-10更新
|
629次组卷
|
2卷引用:四川省资阳市2021届高三上学期第一次诊断性考试化学试题
2 . 如表所示有关物质检验的实验结论正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
| B | 向某溶液中加入盐酸,将生成的气体通入品红溶液中,品红溶液褪色 | 该溶液一定含有 |
| C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| D | 将SO2通入Na2CO3溶液中生成的气体,先通入足量的酸性KMnO4溶液,再通入澄清石灰水中有浑浊 | 说明酸性H2SO3>H2CO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-09-05更新
|
844次组卷
|
25卷引用:四川省成都石室中学2019-2020学年高二入学考试化学试题
四川省成都石室中学2019-2020学年高二入学考试化学试题四川省资阳市乐至中学2022-2023学年高一下学期期中考试化学试题吉林省长春市市田家炳实验中学2019届高三上学期12月月考化学试题河北省衡水中学2019届高三上学期第二次调研考试化学试题5.1.2 硫酸不同价态含硫物质的转化——2020年春高一新人教版第二册化学一课一练天津市滨海新区塘沽第一中学2019 —2020 学年高一下学期第一 次月考化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(十)2020年春高一化学新人教版第二册课后同步:5.1.2 硫酸不同价态含硫物质的转化辽宁省鞍山市第八中学2019-2020学年高一下学期期中考试化学试题山东省济宁市实验中学2019-2020学年高一下学期开学检测化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第三次综合测试化学试题(已下线)第四单元 非金属及其化合物测试题-2021年高考化学一轮复习名师精讲练(已下线)第15讲 硫及其化合物(精练)-2021年高考化学一轮复习讲练测福建省福州市闽江口联盟校2021届高三上学期期中联考化学试题广东省揭阳市普宁市华侨中学2021—2022学年高一下学期第一次月考化学科试题甘肃省玉门油田第一中学2021-2022学年高一下学期期中考试化学试题 广东省揭阳市惠来县第一中学2021-2022学年高一下学期第一次阶段考试化学试题广州大学附属中学2021-2022学年高一下学期5月月考化学试题广西南宁市宾阳县宾阳中学2021-2022学年高一下学期3月月考化学试题(已下线)第11讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)河北省藁城新冀明中学2021-2022学年高三上学期第一次月考化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高一下学期第一次月考化学试题山东省菏泽市单县第二中学2022-2023学年高一上学期(普通班)段考化学试题广东省湛江市第二中学2022-2023学年高一下学期期末考试化学试题陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题
3 . 某研究小组同学为探究锌与硫酸反应生成SO2、H2的临界浓度(浓硫酸能与锌反应生成SO2的最低浓度)设计了如下实验。在大试管A中加入100mL 18mol/L硫酸,向连接在塑料棒上的多孔塑料球内加入足量的锌粒(塑料棒可以上下移动),在试剂瓶D中加入足量的浓NaOH溶液(加热和夹持装置已省略)。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
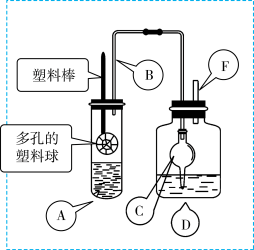
(1)请写出锌与硫酸反应产生SO2的化学方程式_______ 。
(2)在组装仪器之后,加入试剂之前必须进行的操作是__________ 。
(3)长导管B的作用是______ ,如果没有这个设计,最终测定的临界浓度会_______ 。(填“偏高”、“偏低”或“无影响”)
(4)装置中干燥管C的作用是_______ 。
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:_________ mol/L。(用含a的计算式表示,忽略体积变化)
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO 进行滴定,通过滴定出的SO
进行滴定,通过滴定出的SO 的物质的量计算临界浓度,你认为他的这一想法是否可行?
的物质的量计算临界浓度,你认为他的这一想法是否可行?______ (填“可行”或“不可行”),原因是_____ 。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。

(1)请写出锌与硫酸反应产生SO2的化学方程式
(2)在组装仪器之后,加入试剂之前必须进行的操作是
(3)长导管B的作用是
(4)装置中干燥管C的作用是
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO
 进行滴定,通过滴定出的SO
进行滴定,通过滴定出的SO 的物质的量计算临界浓度,你认为他的这一想法是否可行?
的物质的量计算临界浓度,你认为他的这一想法是否可行?
您最近一年使用:0次
2020-07-03更新
|
494次组卷
|
4卷引用:四川省阆中中学2020届高三全景模拟(最后一考)理综化学试题
四川省阆中中学2020届高三全景模拟(最后一考)理综化学试题(已下线)第一单元 物质的量测试题-2021年高考化学一轮复习名师精讲练吉林省长春外国语学校2021届高三上学期期末考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记
名校
4 . 下列现象或事实不能用同一原理解释的是
| A.浓硝酸和氯水用棕色试剂瓶保存 | B.硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
| C.SO2 和 Na2SO3 溶液都能使氯水褪色 | D.常温下铁和铂都不溶于浓硝酸 |
您最近一年使用:0次
2020-06-13更新
|
1301次组卷
|
35卷引用:四川省内江市第六中学2019-2020学年高一下学期入学考试化学B试题
四川省内江市第六中学2019-2020学年高一下学期入学考试化学B试题四川省内江市第六中学2019-2020学年高一下学期入学考试化学C试题四川省威远县连界一中2019-2020学年高一4月测试化学试题四川隆昌市第二中学2019-2020学年高一下学期4月测试化学试题四川省峨眉第二中学校2021-2022学年高一下学期3月月考化学试题四川省遂宁中学校2019-2020学年高一下学期第二次月考化学试题(已下线)2015届山西省忻州第一中学高三上学期期中考试化学试卷2014-2015辽宁省实验分校高一上学期期末化学(理)试卷2016届山东省山东师范大学附属中学高三上学期一模化学试卷2016届陕西省安康长兴学校高三上学期10月月考化学试卷2016届河南省陕州中学高三上学期第一次月考化学试卷2016届吉林省东北师大附属中学高三上学期第二次模拟化学试卷2016届山东省菏泽一中高三上学期12月月考化学试卷2015-2016学年河南省新乡市延津一中高一下开学考试化学试卷2015-2016学年河南省新乡市延津一中高一下学期开学化学试卷2016-2017黑龙江牡丹江第一高级中学高一上期末化学卷2018-2019学年人教版高中化学必修一:非金属及其化合物章末综合测评(四)山东省新泰二中2020届高三上学期第一阶段性测试化学试题北京五中2019-2020学年度高一第二学期第一次阶段性考试试卷化学试题内蒙古赤峰二中2019-2020学年高一下学期第一次月考化学试题湖北省黄梅一中2019--2020学年高一下学期期中考试化学试题安徽省安庆市怀宁县怀宁中学2019-2020学年高一下学期期中考试化学试题甘肃省静宁县第一中学2019-2020学年高一下学期期中考试(第二次月考)化学试题江西省上饶中学2019-2020学年高二下学期期末考试化学试题安徽省六安中学2019-2020学年高一下学期期中考试化学试题内蒙古通辽市奈曼旗实验中学2018-2019学年高一下学期期中考试化学试题人教版2019必修第二册 第五章 第二节 第3课时 硝酸 酸雨及防治湖北省沙市中学2021-2022学年高一下学期期中考试化学试题云南省丽江市2021-2022学年高一上学期9月测试化学试题 湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(B卷)河南省巩义市第二高级中学2022-2023学年高一下学期阶段测试(6月)化学试题广东省湛江市第二中学2022-2023学年高一下学期期末考试化学试题河北省衡水市武强学校2023-2024学年高三上学期开学考试化学试题天津市第二十中学2023-2024学年高一下学期3月考试化学试题陕西省宝鸡市眉县槐芽中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
5 . 实验题。查阅资料知:Br2的沸点为58.8℃,密度为3.119g·cm-3微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________ 态,保存时通常在盛溴的试剂瓶中加入少量__________ 。
Ⅱ.工业生产中,海水提取溴常用空气吹出法。其生产流程可用下图表示:
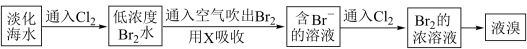
某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴
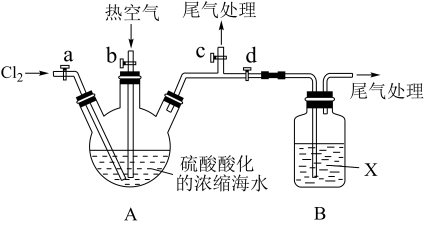
实验步骤如下:
① 关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
② 关闭a、c,打开b、d,向A中鼓入足量热空气;
③ 关闭b,打开a,再通过A向B中通入足量的Cl2;
④ 将B中所得液体进行蒸馏,收集液溴。
(2)当观察到A中液面上方出现_________ (实验现象)即可判断步骤①中反应已经结束。
(3)X试剂可以是_________ (填序号),尾气处理选用_________ (填序号)。
a.H2O b.饱和食盐水 c.氢氧化钠溶液 D.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为________________________ 。
(4)蒸馏时应该选择_________ ,操作中应控制的关键实验条件为__________________ 。
Ⅰ.(1)常温下,单质溴通常呈
Ⅱ.工业生产中,海水提取溴常用空气吹出法。其生产流程可用下图表示:
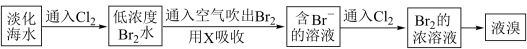
某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴

实验步骤如下:
① 关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
② 关闭a、c,打开b、d,向A中鼓入足量热空气;
③ 关闭b,打开a,再通过A向B中通入足量的Cl2;
④ 将B中所得液体进行蒸馏,收集液溴。
(2)当观察到A中液面上方出现
(3)X试剂可以是
a.H2O b.饱和食盐水 c.氢氧化钠溶液 D.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为
(4)蒸馏时应该选择

您最近一年使用:0次
2017-02-17更新
|
273次组卷
|
3卷引用:四川省南充高级中学2020-2021学年高二下学期第一次月考理综化学试题
10-11高三上·四川成都·阶段练习
解题方法
6 . (Ⅰ)近年来我国对碳纳米管的研究也有了较大突破,即用电弧合成法来制碳纳米管,但往往有大量的碳纳米颗粒,需用氧化法来提纯这些颗粒,化学方程式为:

试回答下列问题:
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂为_______ ,被氧化的元素为________ 。
(3)H2SO4在上述反应中表现出来的性质是___ (填字母)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应若生成11 g CO2,则转移电子的数目为__________ 。
(Ⅱ)2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感(或称H1N1型猪流感)疫情,随后也不断蔓延我国各地.防控专家表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感.
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:
_______________________________________________________
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只被还原的是____ 。
A. MnO2 B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(7)漂白剂亚氯酸钠(NaClO2)在常温于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是____ 。

试回答下列问题:
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂为
(3)H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应若生成11 g CO2,则转移电子的数目为
(Ⅱ)2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感(或称H1N1型猪流感)疫情,随后也不断蔓延我国各地.防控专家表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感.
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只被还原的是
A. MnO2 B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(7)漂白剂亚氯酸钠(NaClO2)在常温于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是
您最近一年使用:0次



