名校
解题方法
1 . 下列图象所表示的化学知识中,不正确的是
A.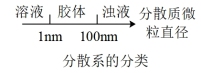 | B.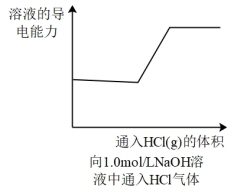 |
C.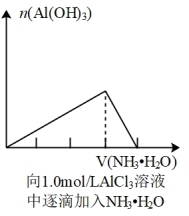 | D.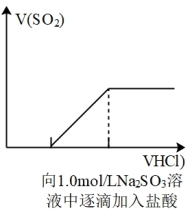 |
您最近一年使用:0次
2022-03-30更新
|
703次组卷
|
2卷引用:四川省内江市第六中学2021-2022学年高一上学期第二次月考化学试题
名校
2 . 下列过程中,最终的白色沉淀物不一定是BaSO4的是
A.Fe(NO3)2溶液 白色沉淀 白色沉淀 |
B.Ba(NO3)2溶液 白色沉淀 白色沉淀 |
C.无色溶液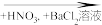 白色沉淀 白色沉淀 |
D.无色溶液 无色溶液 无色溶液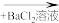 白色沉淀 白色沉淀 |
您最近一年使用:0次
2022-02-18更新
|
1087次组卷
|
30卷引用:四川省遂宁市射洪中学2021-2022学年高一上学期第三次(12月)月考(强基班)化学试题
四川省遂宁市射洪中学2021-2022学年高一上学期第三次(12月)月考(强基班)化学试题(已下线)2012届浙江省绍兴一中高三上学期期中考试化学试卷(已下线)2012届江西省吉安一中高三上学期期中考试化学试卷(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】甘肃省武威第一中学2018-2019学年高一下学期第一次阶段测试化学试题(已下线)2019年8月25日 《每日一题》2020年高考一轮复习—— 每周一测(已下线)考点07 元素化合物综合——《备战2020年高考精选考点专项突破题集》2019年广东省清远市高三上学期期末调研考试化学试题2020届高三化学一轮复习 化学基础实验(选择题和大题训练)(已下线)第15讲 硫及其化合物(精讲)——2021年高考化学一轮复习讲练测上海市南洋模范中学2020—2021学年高二上学期开学考试化学(等级考)试题陕西省西北工业大学附属中学2018-2019学年高一上学期期末考试化学试题云南省玉溪市一中2020-2021学年高一下学期第一次月考化学试题山东省临沂市临沂第二十四中学2020-2021学年高一下学期期中考试化学试题广东省肇庆市高要区第二中学2020-2021学年高一下学期段考(二)化学试题(已下线)第13讲 硫及其化合物(精讲)-2022年一轮复习讲练测(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第11讲 硫及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)上海市华东师范大学第二附属中学2021-2022学年高一下学期3月阶段反馈化学试题(已下线)第13讲 硫及其化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第11讲 硫及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第11讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)新疆哈密市第八中学2021-2022学年高一下学期期末考试化学试题贵州省松桃民族中学2022-2023学年高一下学期3月月考化学试题(已下线)专题03 硫酸和硝酸专讲(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)第2讲 离子反应和离子方程式(已下线)第4讲 浓硫酸 不同价态含硫物质的转化云南省开远市第一中学校2022-2023学年高一下学期3月月考化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高一下学期4月月考化学试题
名校
解题方法
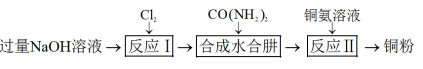
3 . 水合肼 (N2H4∙H2O)常用作航天器燃料,也广泛应用于医药生产,易被氧化。实验室制取水合肼,并模拟利用水合肼处理铜氨{ }废液回收铜粉的实验流程如图:
}废液回收铜粉的实验流程如图:
已知: 。
。
(1)反应I中温度升高时易产生副产物 ,该副反应的离子方程式为
,该副反应的离子方程式为___________ ,为提高反应I中 产率,实验中可采取的措施有
产率,实验中可采取的措施有___________ 。
A.反应容器浸入热水中 B.适当减慢通入 的速率 C.不断搅拌溶液
的速率 C.不断搅拌溶液
(2)① 与
与 反应合成水合肼的化学方程式为
反应合成水合肼的化学方程式为___________ 。
②合成过程中理论上需控制
___________ (保留2位小数),实际生产中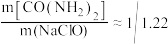 ,原因是
,原因是___________ 。
(3)生产过程中需要使用到 ,以
,以 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入计量的
溶液中加入计量的 ,生成氯化物;再向混合液中加入酸化的
,生成氯化物;再向混合液中加入酸化的 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应离子方程式为
的总反应离子方程式为___________ 。 在氯气中燃烧可以生成
在氯气中燃烧可以生成 ,
, 在高温下会分解生成
在高温下会分解生成 和
和 ,生成
,生成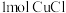 ,转移电子数为
,转移电子数为___________ 。
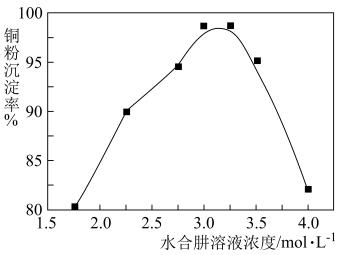
(4)铜粉沉淀率与水合肼溶液浓度的关系如图所示,为提高铜粉沉淀率,最适宜的水合肼溶液浓度为___________ 。
 }废液回收铜粉的实验流程如图:
}废液回收铜粉的实验流程如图:
已知:
 。
。(1)反应I中温度升高时易产生副产物
 ,该副反应的离子方程式为
,该副反应的离子方程式为 产率,实验中可采取的措施有
产率,实验中可采取的措施有A.反应容器浸入热水中 B.适当减慢通入
 的速率 C.不断搅拌溶液
的速率 C.不断搅拌溶液(2)①
 与
与 反应合成水合肼的化学方程式为
反应合成水合肼的化学方程式为②合成过程中理论上需控制

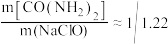 ,原因是
,原因是(3)生产过程中需要使用到
 ,以
,以 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入计量的
溶液中加入计量的 ,生成氯化物;再向混合液中加入酸化的
,生成氯化物;再向混合液中加入酸化的 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应离子方程式为
的总反应离子方程式为 在氯气中燃烧可以生成
在氯气中燃烧可以生成 ,
, 在高温下会分解生成
在高温下会分解生成 和
和 ,生成
,生成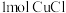 ,转移电子数为
,转移电子数为(4)铜粉沉淀率与水合肼溶液浓度的关系如图所示,为提高铜粉沉淀率,最适宜的水合肼溶液浓度为

您最近一年使用:0次
名校
解题方法
4 . 对于下列实验,能正确描述其反应的离子方程式是
A.同浓度同体积NH4HSO4溶液与NaOH溶液混合:NH +OH-=NH3·H2O +OH-=NH3·H2O |
| B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2=CaCO3↓+2H+ |
| C.向H2O2溶液中滴加少量FeCl3:2Fe3++H2O2=O2↑+2H++2Fe2+ |
D.用Na2SO3溶液吸收少量Cl2:3SO +Cl2+H2O=2HSO +Cl2+H2O=2HSO +2Cl-+SO +2Cl-+SO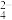 |
您最近一年使用:0次
2021-08-14更新
|
441次组卷
|
5卷引用:四川省蓬安中学校2020届高三上学期入学考试化学试题
四川省蓬安中学校2020届高三上学期入学考试化学试题(已下线)专题4 硫与环境保护(章末培优)-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)福建省安溪县第一中学2021-2022学年高一下学期第一次月考化学试题山东省莱州市第一中学2022-2023学年高二下学期6月月考化学试题云南省楚雄东兴中学2023-2024学年高三上学期10月月考化学试题
真题
名校
5 . 工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是
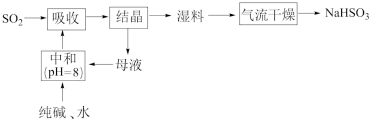
| A.吸收过程中有气体生成 | B.结晶后母液中含有NaHCO3 |
| C.气流干燥湿料时温度不宜过高 | D.中和后溶液中含Na2SO3和NaHCO3 |
您最近一年使用:0次
2021-06-29更新
|
13300次组卷
|
39卷引用:四川省宜宾市叙州区第一中学校2022-2023学年高一下学期6月期末考试化学试题
四川省宜宾市叙州区第一中学校2022-2023学年高一下学期6月期末考试化学试题2021年新高考山东化学高考真题(已下线)课时22 硫及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题12 硫及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练江西省赣县第三中学2021-2022学年高二上学期入学考试化学试题(已下线)专题12 工艺流程选择题-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)第四单元 非金属及其化合物(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)安徽省合肥市第一中学2021-2022学年高三上学期10月月考化学试题内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题2021年山东高考化学试题变式题1-10(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)卷09 物质的分离、提纯-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)卷05 工艺流程型选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)卷05 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷03题 元素化合物的性质-备战2022年高考化学临考题号押题(新高考通版)上海市奉贤区2022届高三下学期等级考二模化学试题(已下线)微专题21 二氧化硫性质四重性探究-备战2023年高考化学一轮复习考点微专题(已下线)第13讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第12练 硫及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题30 非金属及其化合物制备流程与实验探究(S、Se、Te、Cl、Br、I)-备战2023年高考化学一轮复习考点微专题新疆乌鲁木齐市第八中学2022-2023学年高三上学期第一次月考化学试题(已下线)易错点34 化学实验方案的设计与评价-备战2023年高考化学考试易错题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题江苏省扬州市广陵区名校2022-2023学年高一上学期12月月考化学试题(已下线)专题14 工艺流程选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)第四章 非金属及其化合物 第20讲 硫及其氧化物(已下线)上海市静安区2022-2023学年高三下学期二模变式题(选择题11-15)(已下线)专题10 物质的反应及转化(已下线)专题10 物质的反应及转化(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 硫及其重要化合物(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)新疆石河子第一中学2023-2024学年高三上学期第三次月考化学试题山东省潍坊市昌乐二中2023-2024学年高三上学期第一次月考化学试题北京市中国人民大学附属中学2023-2024学年高三上学期11月统练三 化学试题天津市第一中学2023-2024学年高二上学期11月期中考试化学试题河南省信阳高级中学2023-2024学年高三上学期1月月考理综试题-高中化学江苏省常州市田家炳2高级中学023-2024学年高一上学期12月阶段性调研化学学科试卷
名校
解题方法
6 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 将一块用砂纸打磨过的铝条放入试管,再加入98%浓硫酸3mL,铝条表面无明显现象 | 铝与浓硫酸常温下不反应 |
| B | 向试管中加入3mL稀KMnO4酸性溶液,再通入SO2气体,紫红色褪去 | SO2具有漂白性 |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| D | 将溶液X与稀盐酸反应产生的气体通入品红溶液中,品红溶液褪色 | 溶液X中一定含有SO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-03-16更新
|
1375次组卷
|
6卷引用:四川省南充市李渡中学2020-2021学年高一下学期第一次月考化学试题
解题方法
7 . 下列实验操作对应的现象符合事实的是
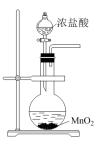 | 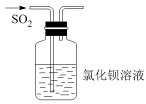 | 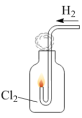 | 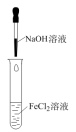 |
| A.将浓盐酸滴入后产生黄绿色气体 | B.少量SO2通入氯化钡溶液,产生白色沉淀 | C.出现苍白色火焰,集气瓶口有白雾 | D.试管中产生白色沉淀,较长时间不变色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-02-02更新
|
220次组卷
|
2卷引用:四川省成都南开为明学校2020-2021学年高一下学期开学测试化学试题
8 . 下列溶液蒸干并灼烧能得到溶质固体的是
| A.碳酸钾溶液 | B.碳酸氢钙溶液 | C.氯化铜溶液 | D.亚硫酸铁溶液 |
您最近一年使用:0次
解题方法
9 . CuCl是重要的化工原料,研究人员提出用有机硅生产中产生的废触煤(生产中未反应的硅粉和催化剂混合物,主要成分为粉末状的硅、铜、锌和碳)来生产CuCl,并设计出如下图所示流程图。
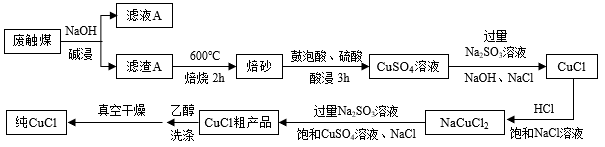
已知:氯化亚铜微溶于水,不溶于乙醇,溶于浓盐酸和氨水生成络合物。
(1)已知锌与铝性质相似,既能与强酸反应又能与强碱反应。写出碱浸时锌与NaOH反应的离子方程式___________ 。
(2)实验室模拟焙烧的过程,除三脚架外,还需要用到的实验仪器是___________ 。(从下列仪器中选出所需的仪器,填字母)
A.蒸发皿 B.坩埚 C.表面皿 D.泥三角 E酒精灯 F.干燥器 G.坩埚钳
(3)焙砂的主要成分是___________ ,写出提高焙砂浸取率和速率的两种方法___________ ,___________ 。
(4)写出由NaCuCl2生成CuCl的离子方程式___________ ,NaCl的作用是___________ ,用乙醇洗涤CuCl晶体的优点是___________ 。
(5)准确称取氯化亚铜产品10.00 g,将其置于过量的FeCl3溶液中,待样品完全溶解后加入适量稀硫酸和水配成1000 mL溶液,取50 mL用0.0500 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液16.67 mL,反应中 被还原为Cr3+,产品中CuCl的质量分数为
被还原为Cr3+,产品中CuCl的质量分数为___________ 。

已知:氯化亚铜微溶于水,不溶于乙醇,溶于浓盐酸和氨水生成络合物。
(1)已知锌与铝性质相似,既能与强酸反应又能与强碱反应。写出碱浸时锌与NaOH反应的离子方程式
(2)实验室模拟焙烧的过程,除三脚架外,还需要用到的实验仪器是
A.蒸发皿 B.坩埚 C.表面皿 D.泥三角 E酒精灯 F.干燥器 G.坩埚钳
(3)焙砂的主要成分是
(4)写出由NaCuCl2生成CuCl的离子方程式
(5)准确称取氯化亚铜产品10.00 g,将其置于过量的FeCl3溶液中,待样品完全溶解后加入适量稀硫酸和水配成1000 mL溶液,取50 mL用0.0500 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液16.67 mL,反应中
 被还原为Cr3+,产品中CuCl的质量分数为
被还原为Cr3+,产品中CuCl的质量分数为
您最近一年使用:0次
10 . 亚硫酸钠是重要的化工原料,具有强还原性,在实验室需要隔绝空气密封保存。回答下列问题:
(1)要配制250 mL 0.5mol/L的Na2SO3溶液,需要用托盘天平称取Na2SO3∙7H2O晶体___________ g。配制溶液所用到的玻璃仪器有:玻璃棒、烧杯和___________
(2)配制过程中所用蒸馏水需煮沸、冷却后才能使用,煮沸蒸馏水的目的是___________
(3)下列操作会使所配Na2SO3溶液浓度偏高的是___________
A.所选用的溶质已经失去部分结晶水
B.容量瓶未经干燥就开始配制溶液
C.用未煮沸的蒸馏水配制溶液
D.定容时俯视容量瓶的刻度线
E.摇匀后液面低于刻度线,再加入蒸馏水使液面最低点与刻度线相切
(4)Na2SO3溶液敞口放在空气中,也容易被氧化而变质。写出Na2SO3溶液变质的离子方程式___________ 。
(1)要配制250 mL 0.5mol/L的Na2SO3溶液,需要用托盘天平称取Na2SO3∙7H2O晶体
(2)配制过程中所用蒸馏水需煮沸、冷却后才能使用,煮沸蒸馏水的目的是
(3)下列操作会使所配Na2SO3溶液浓度偏高的是
A.所选用的溶质已经失去部分结晶水
B.容量瓶未经干燥就开始配制溶液
C.用未煮沸的蒸馏水配制溶液
D.定容时俯视容量瓶的刻度线
E.摇匀后液面低于刻度线,再加入蒸馏水使液面最低点与刻度线相切
(4)Na2SO3溶液敞口放在空气中,也容易被氧化而变质。写出Na2SO3溶液变质的离子方程式
您最近一年使用:0次



