解题方法
1 . 钠及其化合物在生产、生活中有着重要的用途,根据所学知识,回答下列问题。
Ⅰ.某汽车安全气囊的产气药剂主要含有 、
、 、
、 、
、 等物质。当汽车发生碰撞时,
等物质。当汽车发生碰撞时, 迅速分解产生
迅速分解产生 和Na,同时放出大量的热,
和Na,同时放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。
(1) 是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为
是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为___________ 。
Ⅱ.某实验小组设计如下实验方案测定 与
与 混合物中各组分的含量。
混合物中各组分的含量。
(2)方案一:称取30g样品,置于坩埚中加热至恒重,冷却、称量,剩余固体质量为31.6g,计算。
①实验中加热至恒重的目的是___________ 。
②样品中 的质量分数为
的质量分数为___________ 。
(3)方案二:用如图所示装置(铁架台、铁夹等仪器未在图中画出)进行实验。
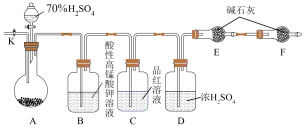
①装置C的作用是___________ ;装置F的作用是___________ 。
②实验过程中,当装置A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气。这样做的目的是___________ 。
(4)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量 溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗涤干净的方法是
溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗涤干净的方法是___________ 。
Ⅰ.某汽车安全气囊的产气药剂主要含有
 、
、 、
、 、
、 等物质。当汽车发生碰撞时,
等物质。当汽车发生碰撞时, 迅速分解产生
迅速分解产生 和Na,同时放出大量的热,
和Na,同时放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。(1)
 是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为
是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为Ⅱ.某实验小组设计如下实验方案测定
 与
与 混合物中各组分的含量。
混合物中各组分的含量。(2)方案一:称取30g样品,置于坩埚中加热至恒重,冷却、称量,剩余固体质量为31.6g,计算。
①实验中加热至恒重的目的是
②样品中
 的质量分数为
的质量分数为(3)方案二:用如图所示装置(铁架台、铁夹等仪器未在图中画出)进行实验。

①装置C的作用是
②实验过程中,当装置A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气。这样做的目的是
(4)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量
 溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗涤干净的方法是
溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗涤干净的方法是
您最近半年使用:0次
名校
解题方法
2 . 为测定Na2CO3与Na2SO3混合物中各组分的含量,设计如下实验方案:
(1)方案一:称取一定质量的样品(30g),置于坩埚中加热至恒重,冷却,称取剩余固体质量为31.6g,计算。①实验中加热至恒重的目的是_______ 。②样品中Na2CO3的质量分数为_______ 。
(2)方案二:以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
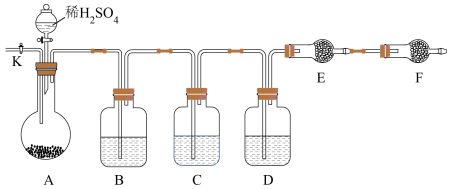
①已知仪器C中装有品红溶液,其作用是_______ ,
②实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙 请将下列容器中应盛放的试剂序号填入相应空格:B中_______ ,D中_______ ,E中_______ 。
③实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气。这样做的目的是_______ 。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量BaCl2溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗干净的方法是_______ 。
(1)方案一:称取一定质量的样品(30g),置于坩埚中加热至恒重,冷却,称取剩余固体质量为31.6g,计算。①实验中加热至恒重的目的是
(2)方案二:以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)

①已知仪器C中装有品红溶液,其作用是
②实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙 请将下列容器中应盛放的试剂序号填入相应空格:B中
③实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气。这样做的目的是
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量BaCl2溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗干净的方法是
您最近半年使用:0次
2023-08-22更新
|
74次组卷
|
2卷引用:山西省运城市康杰中学2022-2023学年高一下学期3月月考化学试题
3 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
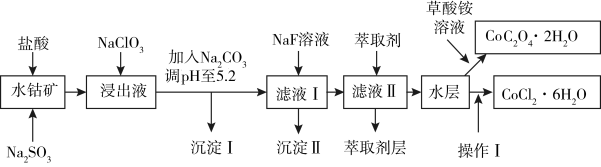
已知:①过滤后的浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中Co2O3发生反应的离子反应方程式为__________ 。
(2)NaClO3在浸出液中的作用________ 。
(3)加入Na2CO3调pH至5.2,目的是______ ;萃取剂层含锰元素,则沉淀II的主要成分为MgF2和____ 。
(4)操作I包括:_________ 、_________ 、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是________ (回答一条原因即可)。

已知:①过滤后的浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为
(2)NaClO3在浸出液中的作用
(3)加入Na2CO3调pH至5.2,目的是
(4)操作I包括:
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是
您最近半年使用:0次
2020-11-04更新
|
421次组卷
|
3卷引用:黑龙江省哈尔滨市第六中学2021届高三上学期期中考试化学试题
名校
4 . 焦亚硫酸钠(Na2S2O5)常用作葡萄酒、果脯等食品的抗氧化剂。
I.焦亚硫酸钠的制备
已知:①Na2S2O5在空气中、受热时均易分解。
②生成Na2S2O5的化学方程式为2NaHSO3=Na2S2O5+H2O。
③水溶液中H2SO3、HSO 、SO
、SO 的物质的量分数随pH的分布如图1所示。
的物质的量分数随pH的分布如图1所示。
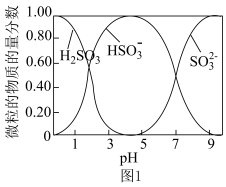
(1)SO2与Na2CO3过饱和溶液反应生成NaHSO3和CO2,其离子方程式为___________ 。
(2)实验室制备少量Na2S2O5的装置如图2所示,请补充完整相应实验方案:在不断搅拌下,控制反应温度在40℃左右,___________ ,20℃静置结晶,经减压抽滤、洗涤、25~30 ℃干燥,可获得Na2S2O5固体。
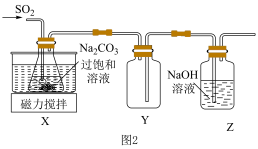
(3)实验制得的Na2S2O5固体中含有一定量的Na2SO4,其原因是___________ 。
Ⅱ.焦亚硫酸钠含量的测定
工业焦亚硫酸钠优质品要求质量分数≥96.5%。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为:
Na2S2O5+CH3COOH+I2+H2O—H2SO4+HI+CH3COONa(未配平);
I2+2Na2S2O3=Na2S4O6+2NaI。
准确称取0.1950g样品,快速置于预先加入30.00 mL 0.100 0 mol·L-1碘标准液及20 mL水的250 mL碘量瓶中,加入5 mL乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处放置5 min;用0.1000 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00 mL。
(4)滴定终点现象是___________ 。
(5)通过计算判断该样品是否为优质品是___________ (写出计算过程)。
I.焦亚硫酸钠的制备
已知:①Na2S2O5在空气中、受热时均易分解。
②生成Na2S2O5的化学方程式为2NaHSO3=Na2S2O5+H2O。
③水溶液中H2SO3、HSO
 、SO
、SO 的物质的量分数随pH的分布如图1所示。
的物质的量分数随pH的分布如图1所示。
(1)SO2与Na2CO3过饱和溶液反应生成NaHSO3和CO2,其离子方程式为
(2)实验室制备少量Na2S2O5的装置如图2所示,请补充完整相应实验方案:在不断搅拌下,控制反应温度在40℃左右,

(3)实验制得的Na2S2O5固体中含有一定量的Na2SO4,其原因是
Ⅱ.焦亚硫酸钠含量的测定
工业焦亚硫酸钠优质品要求质量分数≥96.5%。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为:
Na2S2O5+CH3COOH+I2+H2O—H2SO4+HI+CH3COONa(未配平);
I2+2Na2S2O3=Na2S4O6+2NaI。
准确称取0.1950g样品,快速置于预先加入30.00 mL 0.100 0 mol·L-1碘标准液及20 mL水的250 mL碘量瓶中,加入5 mL乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处放置5 min;用0.1000 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00 mL。
(4)滴定终点现象是
(5)通过计算判断该样品是否为优质品是
您最近半年使用:0次
解题方法
5 . 以黄铁矿(主要成分 )为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。由尾气可以生产焦亚硫酸钠(
)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。由尾气可以生产焦亚硫酸钠( ,
,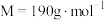 ),常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。其中一种流程如下图所示。
),常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。其中一种流程如下图所示。
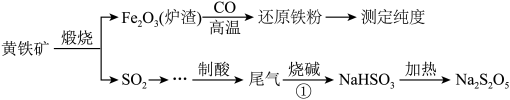
回答下列问题:
(1) 中硫元素的化合价为
中硫元素的化合价为___________ 。
(2)由炉渣制备还原铁粉的化学方程式为___________ 。
(3)生产 ,通常是由
,通常是由 过饱和溶液经结晶脱水制得。写出该过程的化学方程式
过饱和溶液经结晶脱水制得。写出该过程的化学方程式___________ 。
(4)①实验制得的 固体中含有少量
固体中含有少量 杂质,文字叙述其可能的原因是
杂质,文字叙述其可能的原因是________ 。
②葡萄酒酿造过程中要添加 作抗氧化剂,此物质会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的方法是
作抗氧化剂,此物质会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的方法是___________ 。
(5) 纯度测定:取
纯度测定:取 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 该溶液,向其中滴加
该溶液,向其中滴加 的碘溶液,最终滴加
的碘溶液,最终滴加 碘溶液将溶液中
碘溶液将溶液中 恰好完全反应。此过程反应的离子方程式为
恰好完全反应。此过程反应的离子方程式为________ ;样品中 的质量分数为
的质量分数为________ (已知其它杂质不反应)。
 )为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。由尾气可以生产焦亚硫酸钠(
)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。由尾气可以生产焦亚硫酸钠( ,
,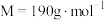 ),常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。其中一种流程如下图所示。
),常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。其中一种流程如下图所示。
回答下列问题:
(1)
 中硫元素的化合价为
中硫元素的化合价为(2)由炉渣制备还原铁粉的化学方程式为
(3)生产
 ,通常是由
,通常是由 过饱和溶液经结晶脱水制得。写出该过程的化学方程式
过饱和溶液经结晶脱水制得。写出该过程的化学方程式(4)①实验制得的
 固体中含有少量
固体中含有少量 杂质,文字叙述其可能的原因是
杂质,文字叙述其可能的原因是②葡萄酒酿造过程中要添加
 作抗氧化剂,此物质会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的方法是
作抗氧化剂,此物质会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的方法是(5)
 纯度测定:取
纯度测定:取 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 该溶液,向其中滴加
该溶液,向其中滴加 的碘溶液,最终滴加
的碘溶液,最终滴加 碘溶液将溶液中
碘溶液将溶液中 恰好完全反应。此过程反应的离子方程式为
恰好完全反应。此过程反应的离子方程式为 的质量分数为
的质量分数为
您最近半年使用:0次
名校
解题方法
6 . 氯化亚铜(CuCl)微溶于水,易被氧化,广泛应用于医药等行业。以废铜渣(铜单质的质量分数为64%,CuO的质量分数为8%,其他杂质不含铜元素)为原料,可制备CuCl并获得副产品(NH4)2SO4,流程如图:
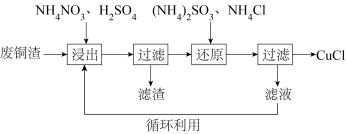
(1)“浸出”时发生的主要反应有:
反应Ⅰ:CuO与H2SO4反应的化学方程式为______ 。
反应Ⅱ:4Cu+NH4NO3+5H2SO4=4CuSO4+(NH4)2SO4+3H2O。
①浸出温度为20℃时,铜元素浸出率随时间的变化如图所示。

铜元素浸出率=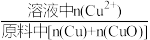 ×100%
×100%
结合图像,从反应速率的角度分析,可得出的结论是______ 。
②实际浸出温度选择65℃,可提高单位时间内铜元素浸出率。若温度过高,会产生红棕色气体,该气体的化学式为______ 。
(2)充分浸出后,“还原”时加入的(NH4)2SO3溶液需略过量,“还原”后的滤液经多次循环可提取一定量的(NH4)2SO4 (忽略转化流程中杂质参与的反应)。
①“还原”时(NH4)2SO4溶液过量的原因是______ 。
②假设铜元素完全浸出,忽略过量的(NH4)2SO4,计算100g废铜渣理论上可制得CuCl与(NH4)2SO4的物质的量(写出计算过程)。______

(1)“浸出”时发生的主要反应有:
反应Ⅰ:CuO与H2SO4反应的化学方程式为
反应Ⅱ:4Cu+NH4NO3+5H2SO4=4CuSO4+(NH4)2SO4+3H2O。
①浸出温度为20℃时,铜元素浸出率随时间的变化如图所示。

铜元素浸出率=
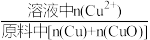 ×100%
×100%结合图像,从反应速率的角度分析,可得出的结论是
②实际浸出温度选择65℃,可提高单位时间内铜元素浸出率。若温度过高,会产生红棕色气体,该气体的化学式为
(2)充分浸出后,“还原”时加入的(NH4)2SO3溶液需略过量,“还原”后的滤液经多次循环可提取一定量的(NH4)2SO4 (忽略转化流程中杂质参与的反应)。
①“还原”时(NH4)2SO4溶液过量的原因是
②假设铜元素完全浸出,忽略过量的(NH4)2SO4,计算100g废铜渣理论上可制得CuCl与(NH4)2SO4的物质的量(写出计算过程)。
您最近半年使用:0次
解题方法
7 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类。我国工业上一般以黄铁矿为原料来制备硫酸。工业制硫酸涉及下列反应:① ;②
;②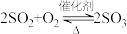 ;③
;③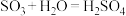 。生产中用浓硫酸代替水吸收
。生产中用浓硫酸代替水吸收 ,制得焦硫酸(
,制得焦硫酸( ,也可以表示为
,也可以表示为 ),将焦硫酸稀释后可制得密度为1.84 g⋅cm
),将焦硫酸稀释后可制得密度为1.84 g⋅cm 、质量分数为98%的浓硫酸。下列有关硫及其化合物的性质与用途具有对应关系的是
、质量分数为98%的浓硫酸。下列有关硫及其化合物的性质与用途具有对应关系的是
 ;②
;②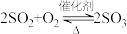 ;③
;③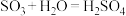 。生产中用浓硫酸代替水吸收
。生产中用浓硫酸代替水吸收 ,制得焦硫酸(
,制得焦硫酸( ,也可以表示为
,也可以表示为 ),将焦硫酸稀释后可制得密度为1.84 g⋅cm
),将焦硫酸稀释后可制得密度为1.84 g⋅cm 、质量分数为98%的浓硫酸。下列有关硫及其化合物的性质与用途具有对应关系的是
、质量分数为98%的浓硫酸。下列有关硫及其化合物的性质与用途具有对应关系的是| A.二氧化硫具有氧化性,可用作葡萄酒的抗氧化剂 |
| B.亚硫酸钠溶液显碱性,可用于吸收少量的二氧化硫 |
| C.硫具有还原性,可用硫黄处理洒落的汞单质 |
| D.硫酸铜溶液具有酸性,可用作泳池杀菌剂 |
您最近半年使用:0次
名校
解题方法
8 . 实验小组探究 与
与 的反应。向盛有
的反应。向盛有 的烧瓶中加入
的烧瓶中加入 固体,测得反应体系中
固体,测得反应体系中 含量的变化如图。
含量的变化如图。

下列说法不正确 的是
 与
与 的反应。向盛有
的反应。向盛有 的烧瓶中加入
的烧瓶中加入 固体,测得反应体系中
固体,测得反应体系中 含量的变化如图。
含量的变化如图。
下列说法
A.有 生成推测发生了反应: 生成推测发生了反应: |
B.bc段 含量下降与反应 含量下降与反应 有关 有关 |
C.可用 酸化的 酸化的 溶液检验b点固体中是否含有 溶液检验b点固体中是否含有 |
D.产物 也可能是 也可能是 与 与 直接化合生成的 直接化合生成的 |
您最近半年使用:0次
解题方法
9 . 如图所示是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图。
(1)试写出在废气脱硫并形成副产物的过程中所发生的主要反应的化学方程式:__________ 。
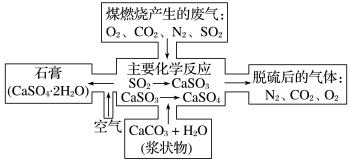
(2)废气脱硫以后含量明显增加的气体是________ (写物质名称),它对环境的负面影响是_________ 。
(3)检验脱硫后的气体中是否含有SO2的简单方法是___________________ 。
(1)试写出在废气脱硫并形成副产物的过程中所发生的主要反应的化学方程式:

(2)废气脱硫以后含量明显增加的气体是
(3)检验脱硫后的气体中是否含有SO2的简单方法是
您最近半年使用:0次
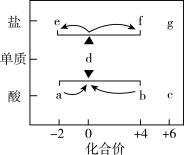
10 . 在“价-类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,f、g均为含钠元素的正盐,请回答:___________ ;
(2)固体f露置在空气中易变质转化为g,该转化的化学方程式为___________ ;
(3)某同学利用下列装置测定空气中 的含量。
的含量。___________ ,该装置中 与碘(
与碘( )溶液发生反应的离子方程式为:
)溶液发生反应的离子方程式为:___________ 。若空气流速为 ,当
,当 与碘(
与碘( )溶液恰好完全反应时,耗时10 min,则该空气样品中
)溶液恰好完全反应时,耗时10 min,则该空气样品中 的含量是
的含量是___________  。(用含V的最简表达式表示)。
。(用含V的最简表达式表示)。
(2)固体f露置在空气中易变质转化为g,该转化的化学方程式为
(3)某同学利用下列装置测定空气中
 的含量。
的含量。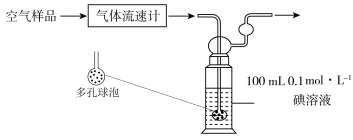
 与碘(
与碘( )溶液发生反应的离子方程式为:
)溶液发生反应的离子方程式为: ,当
,当 与碘(
与碘( )溶液恰好完全反应时,耗时10 min,则该空气样品中
)溶液恰好完全反应时,耗时10 min,则该空气样品中 的含量是
的含量是 。(用含V的最简表达式表示)。
。(用含V的最简表达式表示)。
您最近半年使用:0次
2023-09-08更新
|
249次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高一下学期期中考试化学试题



