1 . 以硫酸工业产生的SO2尾气和氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质,生产流程如下:
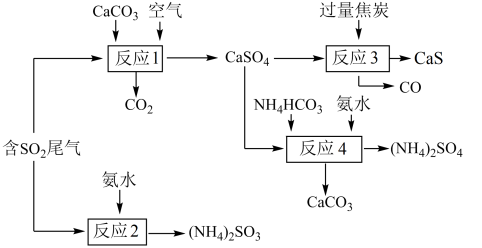
(1)反应1的化学方程式为________________ ;
(2)反应2中用足量氨水吸收SO2,该反应的离子方程式为___________________ ;
(3)为充分利用副产品CO,有人提出以熔融K2CO3为电解质,设计成CO燃料电池以减少对环境的污染。该燃料电池负极的电极反应式为______________ ;
(4)整个合成路线中可以循环利用的物质是_____________ ;
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥, 形成共生系统。计算10.00L 2.00mol/L的(NH4)2SO3溶液可以处理标准状况下NO气体的体积(写出计算过程)_______________ 。

(1)反应1的化学方程式为
(2)反应2中用足量氨水吸收SO2,该反应的离子方程式为
(3)为充分利用副产品CO,有人提出以熔融K2CO3为电解质,设计成CO燃料电池以减少对环境的污染。该燃料电池负极的电极反应式为
(4)整个合成路线中可以循环利用的物质是
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥, 形成共生系统。计算10.00L 2.00mol/L的(NH4)2SO3溶液可以处理标准状况下NO气体的体积(写出计算过程)
您最近半年使用:0次
2 . I.硫元素是动植物生长不可缺少的元素,硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的试剂是_______ 。
(2)甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4,方案乙:由Cu→CuO→CuSO4
①方案甲中,铜和浓硫酸反应的化学方程式是_______ 。
②这两种方案,你认为哪一种方案更合理?_______ 。理由是_______ 。
II.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
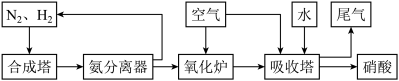
(3)合成塔中发生反应的化学方程式为_______ 。
(4)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨的_______ 性质。
(5)氧化炉中,NH3转化为NO的化学方程式为_______ 。
(1)Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的试剂是
(2)甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4,方案乙:由Cu→CuO→CuSO4
①方案甲中,铜和浓硫酸反应的化学方程式是
②这两种方案,你认为哪一种方案更合理?
II.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:

(3)合成塔中发生反应的化学方程式为
(4)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨的
(5)氧化炉中,NH3转化为NO的化学方程式为
您最近半年使用:0次
3 . 己二酸在有机合成工业等方面有着重要作用,以环己醇( ,M=
,M= ,
, )为原料制取己二酸[
)为原料制取己二酸[ ,M=
,M= ]
]
I.实验原理:3 +8KMnO4
+8KMnO4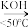 3KOOC(CH2)4COOK+8MnO2↓+2KOH+5H2O
3KOOC(CH2)4COOK+8MnO2↓+2KOH+5H2O
II.实验步骤:向250mL三颈烧瓶中加入搅拌磁子、50mL1.0%的KOH溶液和9.0g高锰酸钾,按图1所示安装装置,控制滴速并维持温度在45℃左右,共滴加环己醇2.0mL,滴加结束时需启动加热装置加热一段时间,得到浊液X。趁热过滤分离出 ,再向滤液Y中加入约4mL浓盐酸,使溶液呈酸性,加热浓缩使溶液体积减少至10mL,经过冷却、脱色得到1.46g产品。
,再向滤液Y中加入约4mL浓盐酸,使溶液呈酸性,加热浓缩使溶液体积减少至10mL,经过冷却、脱色得到1.46g产品。
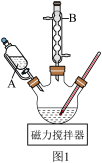
(1)图1中仪器A的名称为___________ ,仪器B是冷凝管,进出水的方向为___________ (填“下进上出”“上进下出”),搅拌磁子的作用是___________ 。
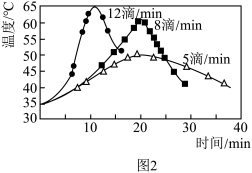
(2)“氧化”过程中,三颈烧瓶中浊液温度逐渐升高,说明该反应是___________ (填“吸热反应”或“放热反应”);在环己醇不同滴速下,浊液温度随滴加时间变化曲线如图2,为减少副反应发生及安全角度考虑,应选择的滴速为___________ 滴/min。
(3)“氧化”后,用玻璃棒蘸取一滴浊液X点在滤纸上,在黑色圆点周围出现紫色环。该现象说明___________ ;向滤液Y中加入适量的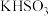 ,反应的离子方程式为
,反应的离子方程式为___________ ,若不加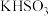 ,在加入浓盐酸制取己二酸的过程中会观察到的现象是
,在加入浓盐酸制取己二酸的过程中会观察到的现象是___________ 。
(4)环己醇的转化率为___________ (保留4位有效数字)。
 ,M=
,M= ,
, )为原料制取己二酸[
)为原料制取己二酸[ ,M=
,M= ]
]I.实验原理:3
 +8KMnO4
+8KMnO4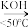 3KOOC(CH2)4COOK+8MnO2↓+2KOH+5H2O
3KOOC(CH2)4COOK+8MnO2↓+2KOH+5H2OII.实验步骤:向250mL三颈烧瓶中加入搅拌磁子、50mL1.0%的KOH溶液和9.0g高锰酸钾,按图1所示安装装置,控制滴速并维持温度在45℃左右,共滴加环己醇2.0mL,滴加结束时需启动加热装置加热一段时间,得到浊液X。趁热过滤分离出
 ,再向滤液Y中加入约4mL浓盐酸,使溶液呈酸性,加热浓缩使溶液体积减少至10mL,经过冷却、脱色得到1.46g产品。
,再向滤液Y中加入约4mL浓盐酸,使溶液呈酸性,加热浓缩使溶液体积减少至10mL,经过冷却、脱色得到1.46g产品。
(1)图1中仪器A的名称为
(2)“氧化”过程中,三颈烧瓶中浊液温度逐渐升高,说明该反应是

(3)“氧化”后,用玻璃棒蘸取一滴浊液X点在滤纸上,在黑色圆点周围出现紫色环。该现象说明
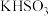 ,反应的离子方程式为
,反应的离子方程式为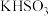 ,在加入浓盐酸制取己二酸的过程中会观察到的现象是
,在加入浓盐酸制取己二酸的过程中会观察到的现象是(4)环己醇的转化率为
您最近半年使用:0次
名校
4 . 碳酸锰 (MnCO3)是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。利用软锰矿(主要成分是 ,含有少量的
,含有少量的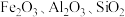 等)制备碳酸锰的工艺流程如下。下列说法错误的是
等)制备碳酸锰的工艺流程如下。下列说法错误的是
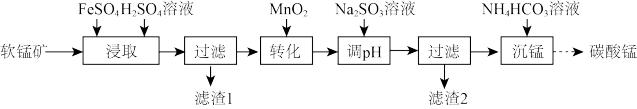
 ,含有少量的
,含有少量的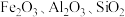 等)制备碳酸锰的工艺流程如下。下列说法错误的是
等)制备碳酸锰的工艺流程如下。下列说法错误的是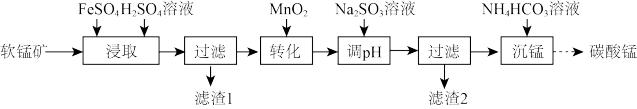
A.“浸取”时发生反应的离子方程式为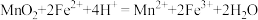 |
B.“转化”的主要目的是将滤液中的 氧化为 氧化为 ,以便后续操作除去 ,以便后续操作除去 |
C.滤渣2的主要成分为 |
| D.该工艺流程中没有气体放出 |
您最近半年使用:0次
5 . 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如图:

已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为__ ;实验中控制温度除用冰水浴外,还缓慢通入Cl2,其理由是__ 。
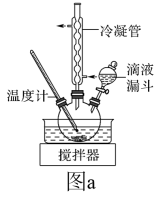
(2)步骤Ⅱ合成N2H4·H2O的装置如图a所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过分液漏斗逐渐滴加NaClO碱性溶液的目的是___ ,合成N2H4·H2O发生的反应的离子方程式为__ ;使用冷凝管的目的是__ 。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2SO3制备无水Na2SO3(水溶液中H2SO3,HSO ,SO
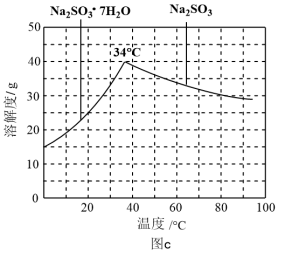
,SO 随pH的分布如图b所示,Na2SO3的溶解度曲线如图c所示)。
随pH的分布如图b所示,Na2SO3的溶解度曲线如图c所示)。
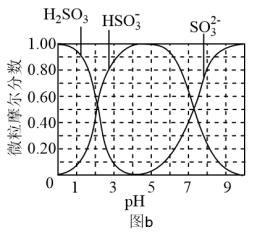
①边搅拌边向Na2SO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为___ 。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为__ 时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于__ ℃条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封包装。

已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
(2)步骤Ⅱ合成N2H4·H2O的装置如图a所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过分液漏斗逐渐滴加NaClO碱性溶液的目的是

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2SO3制备无水Na2SO3(水溶液中H2SO3,HSO
 ,SO
,SO 随pH的分布如图b所示,Na2SO3的溶解度曲线如图c所示)。
随pH的分布如图b所示,Na2SO3的溶解度曲线如图c所示)。

①边搅拌边向Na2SO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为
您最近半年使用:0次
名校
解题方法
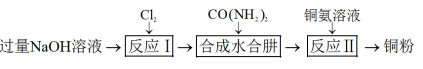
6 . 水合肼 (N2H4∙H2O)常用作航天器燃料,也广泛应用于医药生产,易被氧化。实验室制取水合肼,并模拟利用水合肼处理铜氨{ }废液回收铜粉的实验流程如图:
}废液回收铜粉的实验流程如图:
已知: 。
。
(1)反应I中温度升高时易产生副产物 ,该副反应的离子方程式为
,该副反应的离子方程式为___________ ,为提高反应I中 产率,实验中可采取的措施有
产率,实验中可采取的措施有___________ 。
A.反应容器浸入热水中 B.适当减慢通入 的速率 C.不断搅拌溶液
的速率 C.不断搅拌溶液
(2)① 与
与 反应合成水合肼的化学方程式为
反应合成水合肼的化学方程式为___________ 。
②合成过程中理论上需控制
___________ (保留2位小数),实际生产中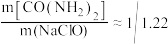 ,原因是
,原因是___________ 。
(3)生产过程中需要使用到 ,以
,以 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入计量的
溶液中加入计量的 ,生成氯化物;再向混合液中加入酸化的
,生成氯化物;再向混合液中加入酸化的 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应离子方程式为
的总反应离子方程式为___________ 。 在氯气中燃烧可以生成
在氯气中燃烧可以生成 ,
, 在高温下会分解生成
在高温下会分解生成 和
和 ,生成
,生成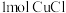 ,转移电子数为
,转移电子数为___________ 。
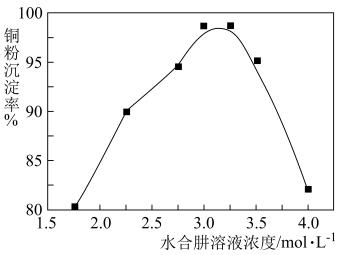
(4)铜粉沉淀率与水合肼溶液浓度的关系如图所示,为提高铜粉沉淀率,最适宜的水合肼溶液浓度为___________ 。
 }废液回收铜粉的实验流程如图:
}废液回收铜粉的实验流程如图:
已知:
 。
。(1)反应I中温度升高时易产生副产物
 ,该副反应的离子方程式为
,该副反应的离子方程式为 产率,实验中可采取的措施有
产率,实验中可采取的措施有A.反应容器浸入热水中 B.适当减慢通入
 的速率 C.不断搅拌溶液
的速率 C.不断搅拌溶液(2)①
 与
与 反应合成水合肼的化学方程式为
反应合成水合肼的化学方程式为②合成过程中理论上需控制

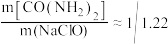 ,原因是
,原因是(3)生产过程中需要使用到
 ,以
,以 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入计量的
溶液中加入计量的 ,生成氯化物;再向混合液中加入酸化的
,生成氯化物;再向混合液中加入酸化的 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应离子方程式为
的总反应离子方程式为 在氯气中燃烧可以生成
在氯气中燃烧可以生成 ,
, 在高温下会分解生成
在高温下会分解生成 和
和 ,生成
,生成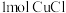 ,转移电子数为
,转移电子数为(4)铜粉沉淀率与水合肼溶液浓度的关系如图所示,为提高铜粉沉淀率,最适宜的水合肼溶液浓度为

您最近半年使用:0次



