解题方法
1 . 某研究性学习小组欲用下图所示的装置证明H2SO3和HClO酸性强弱(已知:H2SO3酸性强于H2CO3)。下列有关说法不正确的是
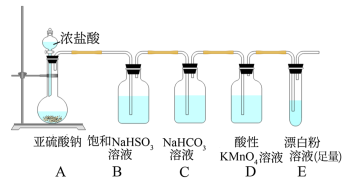

| A.通过本实验无法得出非金属性:Cl>S |
| B.装置B的作用是除去SO2中混入的HCl气体 |
| C.可直接将SO2通入Ca(ClO)2溶液来证明H2SO3和HClO酸性强弱 |
| D.装置D颜色变浅但不褪色,且E中产生白色沉淀即可证明H2SO3酸性强于HClO |
您最近半年使用:0次
2021-09-14更新
|
444次组卷
|
3卷引用:湖北省新高考联考协作体2021-2022学年高二上学期开学考试化学试题
湖北省新高考联考协作体2021-2022学年高二上学期开学考试化学试题(已下线)专题5 微观结构与物质的多样性(章末培优)-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)河南省顶级名校2021-2022学年高一下学期5月月考化学试题
名校
解题方法
2 . 下列有关实验操作、现象和结论都正确的是
| 实验操作 | 现象 | 解释或结论 | |
| A. | 向某无色溶液中通入过量的CO2气体 | 产生白色沉淀 | 该溶液中可能含有 |
| B | Cu与浓硫酸反应,冷却后,再将冷水缓慢加入盛有反应混合物的试管中 | 溶液变蓝 | 证明反应生成了Cu2+ |
| C | 向亚硫酸钠溶液中依次滴加稀盐酸和硝酸钡溶液 | 产生白色沉淀 | 亚硫酸钠溶液已变质 |
| D. | 某铁的氧化物样品用足量浓盐酸溶解后,再滴入少量酸性高锰酸钾 | 紫红色褪去 | 铁的氧化物中含+2价铁 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
3 .  在生产和生活中用途广泛。
在生产和生活中用途广泛。
Ⅰ. 溶液的配制及浓度的标定
溶液的配制及浓度的标定
(1) 溶液的配制
溶液的配制
①配制100mL一定浓度的 溶液需用到的仪器有
溶液需用到的仪器有___________ (填字母)。 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为___________ 。
(2) 溶液浓度的标定
溶液浓度的标定
量取10.00mL 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用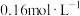
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为___________  。
。
Ⅱ. 与
与 反应的探究
反应的探究
(3)预测现象1:向 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为___________ (用离子方程式表示)。
预测现象2:向 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。
(4)实验验证:小组同学设计以下实验探究溶液中 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
①请补充表格中的数据:a=___________ 。
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是___________ 。
③实验ⅵ和ⅶ的实验现象说明溶液中 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:___________ 。
④甲同学认为实验ⅵ和ⅶ中, 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,___________ (填实验操作与现象),则说明猜想成立。
(5)请举出一种水解反应在生产或生活中的应用:___________ 。
 在生产和生活中用途广泛。
在生产和生活中用途广泛。Ⅰ.
 溶液的配制及浓度的标定
溶液的配制及浓度的标定(1)
 溶液的配制
溶液的配制①配制100mL一定浓度的
 溶液需用到的仪器有
溶液需用到的仪器有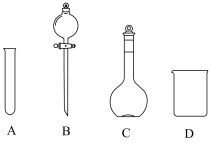
 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为(2)
 溶液浓度的标定
溶液浓度的标定量取10.00mL
 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用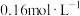
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为 。
。Ⅱ.
 与
与 反应的探究
反应的探究(3)预测现象1:向
 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为预测现象2:向
 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。(4)实验验证:小组同学设计以下实验探究溶液中
 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:| 序号 | ⅰ | ⅱ | ⅲ | ⅳ | ⅴ | ⅵ | ⅶ |
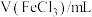 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 |
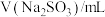 | 0 | 1.0 | 2.0 | 5.0 | a | 20.0 | 26.0 |
 | 38.0 | 37.0 | 36.0 | 33.0 | 23.0 | 18.0 | 12.0 |
| 现象 | 溶液接近无色透明 | 出现褐色沉淀 | |||||
| pH | 1.7 | 1.7 | 1.7 | 1.8 | 2.8 | 5.4 | 6.2 |
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是
③实验ⅵ和ⅶ的实验现象说明溶液中
 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:④甲同学认为实验ⅵ和ⅶ中,
 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,(5)请举出一种水解反应在生产或生活中的应用:
您最近半年使用:0次
4 . Ⅰ.某小组利用数字化实验模拟制备Fe(OH)2并探究其相关性质。
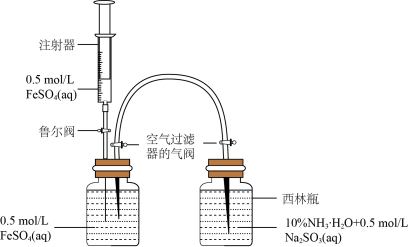
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是_____ ,Na2SO3的作用是_____ 。
(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化, 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。

对比ab、bc段溶解氧的消耗速率,可以得出什么结论_____ 。
(3)已知:在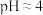 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且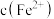 降低量大于
降低量大于 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因_____ ,检验反应后的溶液中是否存在 ,可以选择的试剂是
,可以选择的试剂是_____ 。
A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是_____ 。
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是

(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化,
 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。
对比ab、bc段溶解氧的消耗速率,可以得出什么结论
(3)已知:在
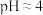 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且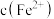 降低量大于
降低量大于 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因 ,可以选择的试剂是
,可以选择的试剂是A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
 |  | 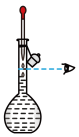 | 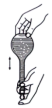 |
| A.称量 | B.转移 | C、定容 | D、摇匀 |
| A.A | B.B | C.C | D.D |
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
您最近半年使用:0次
5 . “价—类”二维图是研究物质性质的一种方法,图中a~f表示的均是含硫物质。下列说法正确的是

| A.a可用硫化亚铁与稀硝酸反应制取 |
B.可发生反应: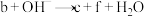 (未配平) (未配平) |
| C.c能使溴水褪色,证明c有漂白性 |
| D.f既有氧化性又有还原性 |
您最近半年使用:0次
2024-02-14更新
|
573次组卷
|
4卷引用:河北省承德市2023-2024学年高一上学期期末考试化学试题
河北省承德市2023-2024学年高一上学期期末考试化学试题(已下线)专题01 硫及其化合物(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)河北省石家庄市第二十三中学2023-2024学年高一下学期第一次月考(3月)化学试题安徽省淮南市第二中2023-2024学年高一下学期第一次月考化学试题
6 . 碘酸钾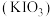 是重要的分析试剂。某研究小组设计实验制备
是重要的分析试剂。某研究小组设计实验制备 ,并进行相关探究。
,并进行相关探究。
I.制备
制备 实验装置如图:
实验装置如图:
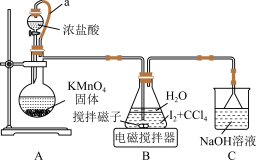
查阅资料: 为白色固体,能溶于水,难溶于四氯化碳;
为白色固体,能溶于水,难溶于四氯化碳; 溶于水,难溶于乙醇。
溶于水,难溶于乙醇。
(1)装置 中
中 可以提高化学反应速率,其原因是
可以提高化学反应速率,其原因是___________ 。
(2)装置 中制取
中制取 的化学反应方程式为
的化学反应方程式为___________ 。
II.制备
(3)从B中分离出 溶液,所需玻璃仪器有烧杯、玻璃棒和
溶液,所需玻璃仪器有烧杯、玻璃棒和___________ 。加入 溶液中和制得
溶液中和制得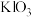 溶液,再加入适量
溶液,再加入适量___________ ,经搅拌、静置、过滤等操作,得到白色固体粗产品,提纯得 晶体。
晶体。
III.实验探究
为探究 溶液和
溶液和 溶液的反应,该小组设计了实验A:向足量的酸性
溶液的反应,该小组设计了实验A:向足量的酸性 溶液滴入数滴淀粉溶液,再加入
溶液滴入数滴淀粉溶液,再加入 溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
(4)溶液变蓝,表明 体现了
体现了___________ 性。
(5)针对T秒前溶液未变蓝,小组做出如下猜想:
i.猜想 秒前未生成
秒前未生成 ,是由于反应的活化能大,影响了反应速率导致的。
,是由于反应的活化能大,影响了反应速率导致的。
ii.猜想b:T秒前生成了 ,但由于存在
,但由于存在 迅速被消耗,反应为
迅速被消耗,反应为___________ (用离子方程式表示)。
(6)请设计实验B,证明猜想b成立:向实验A的蓝色溶液中加入少量的___________ (填化学式)溶液,蓝色迅速消失,后再次变蓝。
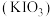 是重要的分析试剂。某研究小组设计实验制备
是重要的分析试剂。某研究小组设计实验制备 ,并进行相关探究。
,并进行相关探究。I.制备

制备
 实验装置如图:
实验装置如图:
查阅资料:
 为白色固体,能溶于水,难溶于四氯化碳;
为白色固体,能溶于水,难溶于四氯化碳; 溶于水,难溶于乙醇。
溶于水,难溶于乙醇。(1)装置
 中
中 可以提高化学反应速率,其原因是
可以提高化学反应速率,其原因是(2)装置
 中制取
中制取 的化学反应方程式为
的化学反应方程式为II.制备

(3)从B中分离出
 溶液,所需玻璃仪器有烧杯、玻璃棒和
溶液,所需玻璃仪器有烧杯、玻璃棒和 溶液中和制得
溶液中和制得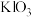 溶液,再加入适量
溶液,再加入适量 晶体。
晶体。III.实验探究
为探究
 溶液和
溶液和 溶液的反应,该小组设计了实验A:向足量的酸性
溶液的反应,该小组设计了实验A:向足量的酸性 溶液滴入数滴淀粉溶液,再加入
溶液滴入数滴淀粉溶液,再加入 溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。(4)溶液变蓝,表明
 体现了
体现了(5)针对T秒前溶液未变蓝,小组做出如下猜想:
i.猜想
 秒前未生成
秒前未生成 ,是由于反应的活化能大,影响了反应速率导致的。
,是由于反应的活化能大,影响了反应速率导致的。ii.猜想b:T秒前生成了
 ,但由于存在
,但由于存在 迅速被消耗,反应为
迅速被消耗,反应为(6)请设计实验B,证明猜想b成立:向实验A的蓝色溶液中加入少量的
您最近半年使用:0次
名校
7 . 下列由实验操作及现象所得结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向1 mL 0.1 mol·L−1硝酸银溶液中,加入2 mL等浓度NaCl溶液,出现白色沉淀,再加入几滴等浓度的Na2S溶液,有黑色沉淀生成 | 溶解度AgCl>Ag2S |
| B | 适量溴乙烷与氢氧化钠的乙醇溶液共热反应,将产生的气体通入酸性高锰酸钾溶液,溶液紫红色褪去 | 证明有乙烯生成 |
| C | 某溶液中加盐酸,产生使品红溶液褪色的无色有刺激味气体 | 原溶液中一定存在SO |
| D | 对有酚酞的碳酸钠溶液加热,溶液颜色变浅 | 说明水解平衡逆向移动 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
8 . Ⅰ、有以下13种物质:①石墨 ②氯化钠 ③酒精 ④氨水 ⑤二氧化碳 ⑥碳酸氢钠 ⑦氢氧化钠溶液 ⑧纯醋酸 ⑨氯化氢 ⑩硫酸铝 ⑪稀硫酸 ⑫氯化银 ⑬硫酸氢钠
(1)能导电的是_______ ;属于非电解质的是_______ 。
Ⅱ、“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(
,得到亚硫酸钠( )粗品。其流程如下:
)粗品。其流程如下:
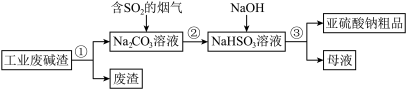
(2)过程①进行的操作是_______ 。
(3)上述流程中的 是酸性氧化物,原因是:
是酸性氧化物,原因是:_______ 。(用化学方程式表示)
(4)加入NaOH后,发生反应的离子方程式为_______ 。
(5)亚硫酸钠粗品中含有少量 ,原因是
,原因是_______ 。
(6)设计实验证明亚硫酸钠粗品含有少量 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,_______ ,出现白色沉淀,则证明含有 。
。
(1)能导电的是
Ⅱ、“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为
 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(
,得到亚硫酸钠( )粗品。其流程如下:
)粗品。其流程如下:
(2)过程①进行的操作是
(3)上述流程中的
 是酸性氧化物,原因是:
是酸性氧化物,原因是:(4)加入NaOH后,发生反应的离子方程式为
(5)亚硫酸钠粗品中含有少量
 ,原因是
,原因是(6)设计实验证明亚硫酸钠粗品含有少量
 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, 。
。
您最近半年使用:0次
名校
解题方法
9 . 设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为 。
。
ⅱ. 与
与 反应生成黄色沉淀。
反应生成黄色沉淀。
某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,
溶液,___________ (填实验现象)。
上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是___________
(3)写出NO与碱性 溶液反应的离子方程式
溶液反应的离子方程式___________
(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: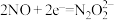 ,则氧化反应为:
,则氧化反应为:___________ 。
(5)某同学结合所学知识设计处理工业废气中 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式___________
②再向生成的溶液中加入一定量___________ ,以此溶液来吸收NO气体。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性
 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。资料:ⅰ.NO与碱性
 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为 。
。ⅱ.
 与
与 反应生成黄色沉淀。
反应生成黄色沉淀。某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和
 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴
 的
的 溶液,
溶液,上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是
(3)写出NO与碱性
 溶液反应的离子方程式
溶液反应的离子方程式(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性
 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: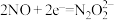 ,则氧化反应为:
,则氧化反应为:(5)某同学结合所学知识设计处理工业废气中
 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。①先用饱和纯碱溶液吸收废气中的
 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式②再向生成的溶液中加入一定量
您最近半年使用:0次
名校
解题方法
10 . 下列离子方程式中正确的是
A.在足量烧碱溶液中氯气发生歧化反应: |
B.将氯气通入 溶液中: 溶液中: |
C.能证明氧化性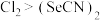 的反应: 的反应: |
D.次氯酸钠与亚硫酸钠反应: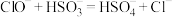 |
您最近半年使用:0次
2023-09-28更新
|
39次组卷
|
2卷引用:湖南省三湘创新发展联合体2023-2024学年高三上学期9月月考化学试题



