1 . 草酸亚铁晶体(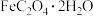 ,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。
,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。

(1)按照气流从左到右的方向,上述装置的接口顺序为A→_______ →尾气处理装置(仪器可重复使用)。
(2)实验证明了气体产物中含有 ,依据的实验现象为
,依据的实验现象为_______ 。
(3)实验证明了气体产物中含有CO,依据的实验现象为_______ 。
(4)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为_______ 。
(5)工业制得的草酸亚铁晶体中常含有 杂质,测定其纯度的步骤如下:
杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品溶于稀 中,配成250 mL溶液;
中,配成250 mL溶液;
步骤2:取上述溶液25.00 mL,用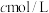
 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 ;
;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀 ,再用
,再用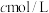
 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 。
。
①步骤2中滴定终点的现象为_______ 。
②该样品中草酸亚铁晶体的质量分数的表达式为_______ 。
③若步骤1配制溶液时部分 被氧化变质,则测定结果将
被氧化变质,则测定结果将_______ (填“偏高”“偏低”或“不变”)。
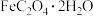 ,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。
,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。
(1)按照气流从左到右的方向,上述装置的接口顺序为A→
(2)实验证明了气体产物中含有
 ,依据的实验现象为
,依据的实验现象为(3)实验证明了气体产物中含有CO,依据的实验现象为
(4)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(5)工业制得的草酸亚铁晶体中常含有
 杂质,测定其纯度的步骤如下:
杂质,测定其纯度的步骤如下:步骤1:称取m g草酸亚铁晶体样品溶于稀
 中,配成250 mL溶液;
中,配成250 mL溶液;步骤2:取上述溶液25.00 mL,用
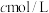
 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 ;
;步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀
 ,再用
,再用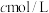
 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 。
。①步骤2中滴定终点的现象为
②该样品中草酸亚铁晶体的质量分数的表达式为
③若步骤1配制溶液时部分
 被氧化变质,则测定结果将
被氧化变质,则测定结果将
您最近一年使用:0次
2022-12-16更新
|
191次组卷
|
2卷引用:黑龙江省海伦市第一中学2022-2023学年高三上学期1月期末考试化学试题
解题方法
2 . 从下列事实所列出的相应结论正确的是
| 序号 | 实验事实 | 结论 |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证明SO2有漂白性 |
| ② | 用磨口玻璃瓶保存NaOH溶液,硝酸用棕色试剂瓶保存在阴暗处 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀滴加稀盐酸,沉淀不溶解, | 证明Na2SO3已氧化变质 |
| ④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A.①② | B.③④⑤ | C.②④ | D.④⑤ |
您最近一年使用:0次
2020-01-20更新
|
42次组卷
|
3卷引用:黑龙江绥化市第七中学校2020-2021学年高一下学期第二次月考化学试题
名校
解题方法
3 . 三氯化六氨合钴(III)([Co(NH3)6]Cl3,钴为+3价)在钴化合物的合成中是重要原料。实验室以CoCl2为原料制备[Co(NH3)6]Cl3,步骤如下:
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。
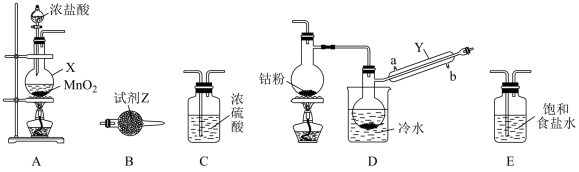
(1)仪器X的名称为____ 。
(2)X中发生反应的离子方程式为____ 。
(3)装置的连接顺序为A→____ →B;反应开始前应先点燃A处的酒精灯,其目的是___ 。
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是____ 。
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为____ 。
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
则该氧化还原滴定指示剂为____ ,该样品中钴元素的质量分数为____ 。
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。

(1)仪器X的名称为
(2)X中发生反应的离子方程式为
(3)装置的连接顺序为A→
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O
 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。则该氧化还原滴定指示剂为
您最近一年使用:0次
2022-09-20更新
|
246次组卷
|
2卷引用:黑龙江省绥化市第一中学2022-2023学年高三上学期期中考试化学试题
名校
4 . 由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
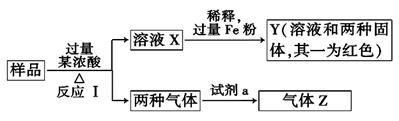
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)___________ 。
(2)Z为一种或两种气体
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是_________ 。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是_____________ 。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)_____________ 。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I- 时,共转移3 mol电子,该反应的离子方程式是_______________ 。

(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)
(2)Z为一种或两种气体
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I- 时,共转移3 mol电子,该反应的离子方程式是
您最近一年使用:0次
2016-12-09更新
|
294次组卷
|
5卷引用:2016届黑龙江省绥化市第一中学高三上学期期中测试化学试卷



