解题方法
1 . 六氨合氯化镁(MgCl2•6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组以MgCl2•6H2O为原料在实验室制备MgCl2•6NH3,并测定所得产品中氯化镁的含量。
I.制备无水MgCl2。利用SOCl2与MgCl2•6H2O混合并加热,可制得无水MgCl2,实验装置如图(加热及夹持装置略去):
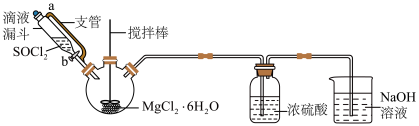
已知:SOCl2:熔点 105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
(1)三颈瓶中发生反应的化学方程式为_____________ 。
(2)该实验装置中的不足之处为_______________________________ 。
(3)改进装置后,向三颈瓶中缓慢滴加SOCl2时,需打开活塞b,此时_________ (填“需要”或“不需要”)打开玻璃塞a,原因为______________ 。
Ⅱ.制备MgCl2·6NH3。将NH3通入无水MgCl2的乙醇溶液中,充分反应后,过滤、洗涤并自然风干,制得粗品。相关物质在不同溶剂中的溶解性如表:
(4)洗涤产品时,应选择的洗涤剂为___________(填字母)。
Ⅲ.测定产品中氯化镁的含量,步骤如下:
①称取1.80g样品,加入足量稀硝酸溶解,配成250mL溶液;②取25.00mL待测液于锥形瓶中,以K2CrO4为指示剂,用0.20mol/L的AgNO3标准液滴定溶液中Cl-,记录消耗标准液的体积;③重复步骤2操作2~3次,平均消耗标准液10.00 mL。
(5)步骤1中,用稀硝酸溶解样品的目的为________________ 。
(6)该样品中MgCl2的质量分数为___________ (保留小数点后2位)。
I.制备无水MgCl2。利用SOCl2与MgCl2•6H2O混合并加热,可制得无水MgCl2,实验装置如图(加热及夹持装置略去):

已知:SOCl2:熔点
 105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。(1)三颈瓶中发生反应的化学方程式为
(2)该实验装置中的不足之处为
(3)改进装置后,向三颈瓶中缓慢滴加SOCl2时,需打开活塞b,此时
Ⅱ.制备MgCl2·6NH3。将NH3通入无水MgCl2的乙醇溶液中,充分反应后,过滤、洗涤并自然风干,制得粗品。相关物质在不同溶剂中的溶解性如表:
NH3 | MgCl2 | MgCl2·6NH3 | |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
(4)洗涤产品时,应选择的洗涤剂为___________(填字母)。
| A.冰浓氨水 | B.乙二醇和水的混合液 |
| C.氨气饱和的甲醇溶液 | D.氨气饱和的乙二醇溶液 |
Ⅲ.测定产品中氯化镁的含量,步骤如下:
①称取1.80g样品,加入足量稀硝酸溶解,配成250mL溶液;②取25.00mL待测液于锥形瓶中,以K2CrO4为指示剂,用0.20mol/L的AgNO3标准液滴定溶液中Cl-,记录消耗标准液的体积;③重复步骤2操作2~3次,平均消耗标准液10.00 mL。
(5)步骤1中,用稀硝酸溶解样品的目的为
(6)该样品中MgCl2的质量分数为
您最近一年使用:0次
名校
2 . 某纯碱样品只含NaCl杂质,为测定样品中 的含量进行如下实验。
的含量进行如下实验。
实验Ⅰ:甲小组称取样品5.00g,采用如下实验装置进行实验。实验结束时,分离③中所得固体,称其质量为7.88g。

(1)装置①的作用是___________ 。
(2)装置②中反应的离子方程式为___________ 。
(3)下列说法不正确的是___________(填标号)。
(4)样品中 的质量分数为
的质量分数为____ 。
实验Ⅱ:乙小组称取样品ag,采用如图实验装置进行实验。
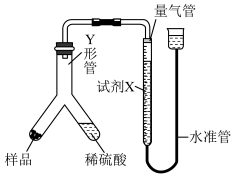
(5)试剂X应选择____ (填标号)。
A.饱和 溶液 B.饱和
溶液 B.饱和 溶液 C.饱和
溶液 C.饱和 溶液
溶液
(6)下列哪些因素会造成样品中 的含量偏低
的含量偏低___ (填标号)。
A.将稀硫酸替换为盐酸
B.读数时未冷却至室温
C.读数时水准管的液面高于量气管的液面
(7)实验结束时,所得气体体积为V mL。实验时的气体摩尔体积为 ,则样品
,则样品 的质量分数为
的质量分数为______ 。
 的含量进行如下实验。
的含量进行如下实验。实验Ⅰ:甲小组称取样品5.00g,采用如下实验装置进行实验。实验结束时,分离③中所得固体,称其质量为7.88g。

(1)装置①的作用是
(2)装置②中反应的离子方程式为
(3)下列说法不正确的是___________(填标号)。
| A.先通入空气一段时间,再滴加盐酸 |
| B.装置②、③间应增加除去HCl杂质的装置 |
| C.装置④的作用是吸收尾气,防止空气污染 |
| D.停止滴加盐酸后,还需继续通入空气一段时间 |
 的质量分数为
的质量分数为实验Ⅱ:乙小组称取样品ag,采用如图实验装置进行实验。

(5)试剂X应选择
A.饱和
 溶液 B.饱和
溶液 B.饱和 溶液 C.饱和
溶液 C.饱和 溶液
溶液(6)下列哪些因素会造成样品中
 的含量偏低
的含量偏低A.将稀硫酸替换为盐酸
B.读数时未冷却至室温
C.读数时水准管的液面高于量气管的液面
(7)实验结束时,所得气体体积为V mL。实验时的气体摩尔体积为
 ,则样品
,则样品 的质量分数为
的质量分数为
您最近一年使用:0次
3 . 下图是某儿童微量元素体检报告单的部分数据:
根据上表的数据,回答下列问题:
(1)该儿童___________ 元素含量偏低。
(2)硫酸亚铁晶体(FeSO4•7H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:
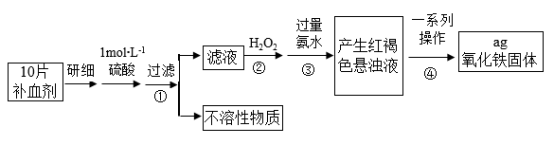
请回答下列问题:
a.②中加入H2O2后发生的反应的离子方程式___________ 。
b.④中一系列处理的操作步骤为___________ 、___________ 、灼烧、冷却、称量。
c.若实验无损耗,则每片补血剂含铁元素的质量分数为___________ 。
怀化市医疗机构临床检验结果报告单 | ||||
分析项目 | 检测结果 | 单位 | 参考范围 | |
1 | 锌(Zn) | 115.92 |
| 66~120 |
2 | 铁(Fe) | 6.95↓ | mmol·L-1 | 7.52~11.82 |
3 | 钙(Ca) | 1.68 | mmol·L-1 | 1.55~2.10 |
(1)该儿童
(2)硫酸亚铁晶体(FeSO4•7H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:

请回答下列问题:
a.②中加入H2O2后发生的反应的离子方程式
b.④中一系列处理的操作步骤为
c.若实验无损耗,则每片补血剂含铁元素的质量分数为
您最近一年使用:0次
4 . 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是__________ (填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
(Ⅰ)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
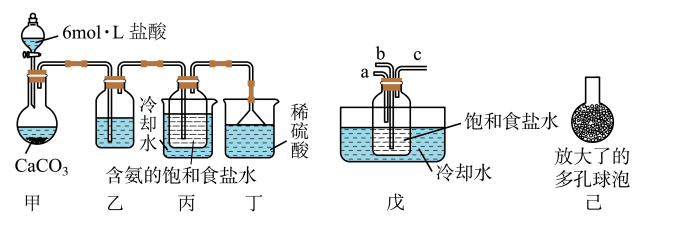
试回答下列有关问题:
①乙装置中的试剂是_____________ 。
②丁装置的作用是____________________ 。
(Ⅱ)另一位同学用图中戊装置(其它装置未画出)进行实验。
①实验时,须先从a管通入___________ 气体(填气体分子式),再从b管通入__________ 气体(填气体分子式)。
②有同学建议在戊装置的b管下端连接己装置,理由是__________________________ 。
(3)探究小苏打样品(含少量NaCl)中碳酸氢钠的含量:
称取1.840 g小苏打样品(含少量NaCl),配置成250 mL溶液,取出25.00 mL用0.1000mol·L-1盐酸滴定,消耗盐酸21.50 mL。
①实验中所需要的定量仪器除滴定管外,还有______________________________ 。
②样品中NaHCO3质量分数为__________________________ 。
(4)将一定质量小苏打样品(只考虑含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果_____________ 。(选填“偏高”、“偏低”或“不受影响”)
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
(Ⅰ)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

试回答下列有关问题:
①乙装置中的试剂是
②丁装置的作用是
(Ⅱ)另一位同学用图中戊装置(其它装置未画出)进行实验。
①实验时,须先从a管通入
②有同学建议在戊装置的b管下端连接己装置,理由是
(3)探究小苏打样品(含少量NaCl)中碳酸氢钠的含量:
称取1.840 g小苏打样品(含少量NaCl),配置成250 mL溶液,取出25.00 mL用0.1000mol·L-1盐酸滴定,消耗盐酸21.50 mL。
①实验中所需要的定量仪器除滴定管外,还有
②样品中NaHCO3质量分数为
(4)将一定质量小苏打样品(只考虑含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果
您最近一年使用:0次
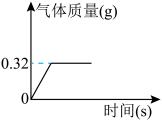
5 . 为测定某过氧化钠样品的纯度,将2g该样品与足量水发生反应(杂质不参与反应):2Na2O2+2H2O=4NaOH+O2↑,生成气体质量与时间的关系如图所示。
(1)生成氧气的质量是___________ g。
(2)列式计算该样品中过氧化钠的质量分数为___________ 。
(1)生成氧气的质量是
(2)列式计算该样品中过氧化钠的质量分数为
您最近一年使用:0次
6 . 氢化钙(CaH2)是种白色细颗粒状固体,能与水发生剧烈反应,其反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,常用作登山运动员的能源提供剂。
(1)某化学实验小组为了探究氢化钙的性质,将一定量的CaH2加入到碳酸钠溶液中,立即产生大量气泡,且溶液变浑浊。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是___________ (填写化学式)。
为进步确定滤液中所含溶质的成分,他们进行了以下实验探究。
【提出猜想】
(2)猜想一:NaOH;
猜想二:NaOH和Na2CO3;
猜想三:___________ ;
猜想四:NaOH、Na2CO3、Ca(OH)2。
经过分析,大家一致认为上述猜想___________ 不需要验证,肯定是错误的,原因是___________ (用化学方程式表示)。
【实验探究】
(3)方案一:取一定量的滤液于试管中,往其中滴加少量稀盐酸,无明显实验现象。
方案二:取一定量的滤液于另一试管中,往其中滴加氯化钡溶液,观察到___________ 。
【讨论交流】
(4)根据实验现象,得出猜想___________ 是正确的。请解释方案一中无明显现象的原因是___________ 。
【拓展探究】
(5)上述小组同学将5g氢化钙样品(所含杂质不参与反应也不溶于水)加入到50g碳酸钠溶液中,充分混合后,恰好完全反应。实验测得反应过程中产生气体的质量为0.4g。计算:
①样品中CaH2的质量分数为___________ 。
②原碳酸钠溶液中溶质的质量为___________ 。
③反应后溶液中溶质的质量分数为___________ 。(计算结果保留一位小数)
(1)某化学实验小组为了探究氢化钙的性质,将一定量的CaH2加入到碳酸钠溶液中,立即产生大量气泡,且溶液变浑浊。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是
为进步确定滤液中所含溶质的成分,他们进行了以下实验探究。
【提出猜想】
(2)猜想一:NaOH;
猜想二:NaOH和Na2CO3;
猜想三:
猜想四:NaOH、Na2CO3、Ca(OH)2。
经过分析,大家一致认为上述猜想
【实验探究】
(3)方案一:取一定量的滤液于试管中,往其中滴加少量稀盐酸,无明显实验现象。
方案二:取一定量的滤液于另一试管中,往其中滴加氯化钡溶液,观察到
【讨论交流】
(4)根据实验现象,得出猜想
【拓展探究】
(5)上述小组同学将5g氢化钙样品(所含杂质不参与反应也不溶于水)加入到50g碳酸钠溶液中,充分混合后,恰好完全反应。实验测得反应过程中产生气体的质量为0.4g。计算:
①样品中CaH2的质量分数为
②原碳酸钠溶液中溶质的质量为
③反应后溶液中溶质的质量分数为
您最近一年使用:0次
名校
7 . 肆虐了三年的“新冠”疫情,最近管控突然放开,小伙伴们基本都经历了“吞刀子”、过电抽、白夜咳的“恐怖”。“84消毒液”能有效杀灭病毒,某同学购买了一瓶“84消毒液”,该消毒液通常稀释到100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:
回答下列问题:
(1)某同学欲配制物质的量浓度为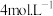 的“84消毒液”480mL。请你帮他将下列过程补充完整:
的“84消毒液”480mL。请你帮他将下列过程补充完整:
①计算并用托盘天平称量 固体
固体___________ g;
②将称量好的 固体放在烧杯中,加适量蒸馏水,用玻璃棒搅拌,使
固体放在烧杯中,加适量蒸馏水,用玻璃棒搅拌,使 全部溶解;
全部溶解;
③将烧杯中的溶液沿着玻璃棒注入容量瓶中;
④用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;
⑤将蒸馏水注入容量瓶中,当液面距离容量瓶颈部的刻度线1~2cm时,改用___________ 滴加蒸馏水至凹液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀;
⑥将配好的溶液倒入试剂瓶中,并贴好标签。
(2)判断下列操作对所配溶液的浓度的影响(填“偏高”“偏低”或“无影响”)。
A.定容时,俯视刻度线,浓度___________ 。
B.定容摇匀后发现溶液凹液面最低处低于刻度线,加蒸馏水至刻度线,浓度___________ 。
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因:___________ 。
(4)某消毒小组人员用 的浓硫酸配制
的浓硫酸配制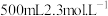 的稀硫酸用于增强“84消毒液”的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强“84消毒液”的消毒能力,需取用浓硫酸的体积为___________  。
。
(5)“84消毒液”不能与洁厕灵(浓盐酸)混合使用,请用离子方程式解释原因:___________ 。
| 84消毒液 有效成分  规格  质量分数  密度 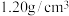 |
(1)某同学欲配制物质的量浓度为
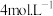 的“84消毒液”480mL。请你帮他将下列过程补充完整:
的“84消毒液”480mL。请你帮他将下列过程补充完整:①计算并用托盘天平称量
 固体
固体②将称量好的
 固体放在烧杯中,加适量蒸馏水,用玻璃棒搅拌,使
固体放在烧杯中,加适量蒸馏水,用玻璃棒搅拌,使 全部溶解;
全部溶解;③将烧杯中的溶液沿着玻璃棒注入容量瓶中;
④用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;
⑤将蒸馏水注入容量瓶中,当液面距离容量瓶颈部的刻度线1~2cm时,改用
⑥将配好的溶液倒入试剂瓶中,并贴好标签。
(2)判断下列操作对所配溶液的浓度的影响(填“偏高”“偏低”或“无影响”)。
A.定容时,俯视刻度线,浓度
B.定容摇匀后发现溶液凹液面最低处低于刻度线,加蒸馏水至刻度线,浓度
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因:
(4)某消毒小组人员用
 的浓硫酸配制
的浓硫酸配制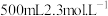 的稀硫酸用于增强“84消毒液”的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强“84消毒液”的消毒能力,需取用浓硫酸的体积为 。
。(5)“84消毒液”不能与洁厕灵(浓盐酸)混合使用,请用离子方程式解释原因:
您最近一年使用:0次
8 . 抗击新冠病毒期间,各地大规模进行环境消毒,其中“84”消毒液试用比较广泛。如图是某“84”消毒液的标签,该“84”消毒液的物质的量浓度为_____  ?某同学取100mL该“84”消毒液,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为
?某同学取100mL该“84”消毒液,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为_____  ?
?
 ?某同学取100mL该“84”消毒液,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为
?某同学取100mL该“84”消毒液,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为 ?
?| “84”消毒液 [有效成分]NaClO [规格]1000mL [质量分数]37.25% [密度] 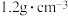 |
您最近一年使用:0次
名校
解题方法
9 . 填空题
(1)① 中的质子数为
中的质子数为___________ ,电子数为___________ 。
②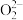 中的质子数为
中的质子数为___________ ,电子数为___________ 。
③ 中的质子数为
中的质子数为___________ ,电子数为___________ 。
(2)含氧元素质量相同的 和
和 ,两者中硫原子个数比为
,两者中硫原子个数比为___________ ,两者的质量比为___________ 。
(3)把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要加水___________ g。
(4)镓属于活泼金属,镓( )元素与铝元素化学性质相似,请写出镓(
)元素与铝元素化学性质相似,请写出镓( )与稀硫酸反应的化学方程式为
)与稀硫酸反应的化学方程式为___________ 。
(1)①
 中的质子数为
中的质子数为②
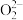 中的质子数为
中的质子数为③
 中的质子数为
中的质子数为(2)含氧元素质量相同的
 和
和 ,两者中硫原子个数比为
,两者中硫原子个数比为(3)把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要加水
(4)镓属于活泼金属,镓(
 )元素与铝元素化学性质相似,请写出镓(
)元素与铝元素化学性质相似,请写出镓( )与稀硫酸反应的化学方程式为
)与稀硫酸反应的化学方程式为
您最近一年使用:0次
名校
10 . 新型肺炎疫情过后,我们仍要注意消毒。“84消毒液”是大规模环境消毒剂。已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
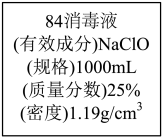
(1)下列说法不正确的是_______。
(2)该“84消毒液”的物质的量浓度约为_______ 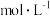 。(保留一位小数)
。(保留一位小数)
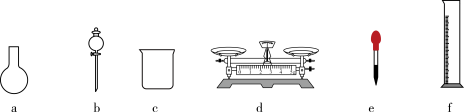
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。配制一定物质的量浓度的上述消毒液需要选用如图所示的部分仪器,还需要的玻璃仪器是_______ (填仪器名称)。
(4)请将下列各操作按正确的顺序将字母代号填写在横线上_______ 。
A.用托盘天平称取NaClO固体
B.塞好瓶塞,反复颠倒摇匀,装瓶,贴标签
C.加蒸馏水至离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线
D.用适量蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液一并转入容量瓶,并轻摇容量瓶使其混匀
E.待溶液冷却至室温,再将溶液转入容量瓶
F.将已称量的NaClO固体置于烧杯中,加适量蒸馏水溶解完全
(5)若所配制的次氯酸钠溶液的物质的量浓度偏小,则下列可能的原因分析中正确的是_______。
(6)某中学学生在宿舍将“84消毒液”与“洁厕灵”混合欲制取氯气。这是极度危险的,请用化学方程式表示其原理:_______ 。

(1)下列说法不正确的是_______。
| A.“84消毒液的有效成分是NaClO |
| B.“洁厕灵”(主要成分为盐酸)与“84消毒液”混用效果更好 |
C.检验该消毒液中是否含有 的原理为: 的原理为: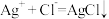 |
| D.盛装“84消毒液”的瓶子瓶盖忘盖,长时间后可能失效 |
(2)该“84消毒液”的物质的量浓度约为
 。(保留一位小数)
。(保留一位小数)(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。配制一定物质的量浓度的上述消毒液需要选用如图所示的部分仪器,还需要的玻璃仪器是

(4)请将下列各操作按正确的顺序将字母代号填写在横线上
A.用托盘天平称取NaClO固体
B.塞好瓶塞,反复颠倒摇匀,装瓶,贴标签
C.加蒸馏水至离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线
D.用适量蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液一并转入容量瓶,并轻摇容量瓶使其混匀
E.待溶液冷却至室温,再将溶液转入容量瓶
F.将已称量的NaClO固体置于烧杯中,加适量蒸馏水溶解完全
(5)若所配制的次氯酸钠溶液的物质的量浓度偏小,则下列可能的原因分析中正确的是_______。
| A.配制前,容量瓶中有少量蒸馏水 | B.洗涤液未转移到容量瓶中 |
| C.未经冷却立即转液 | D.定容时,仰视溶液的凹液面 |
(6)某中学学生在宿舍将“84消毒液”与“洁厕灵”混合欲制取氯气。这是极度危险的,请用化学方程式表示其原理:
您最近一年使用:0次

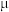 mol·L-1
mol·L-1

