1 . 某实验小组欲通过加热蒸发硝酸钾(KNO3)溶液的方法获得 固体。已知
固体。已知 固体在一定温度下能发生反应:
固体在一定温度下能发生反应: 。为了探究加热蒸发所得固体X中是否含有亚硝酸钾(KNO2),小组同学设计并完成了以下实验。
。为了探究加热蒸发所得固体X中是否含有亚硝酸钾(KNO2),小组同学设计并完成了以下实验。
【查阅资料】
i. 是微溶于水的白色(略带黄色)固体
是微溶于水的白色(略带黄色)固体
ii.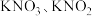 能在酸性条件下与
能在酸性条件下与 反应,生成
反应,生成
【实验过程】

【分析解释】
(1) 中N的化合价是
中N的化合价是___________ ,从化合价的角度预测, 具有的性质是
具有的性质是___________ (填标号)。
A.只有氧化性 B.只有还原性 C.既有氧化性,又有还原性
(2)试管①中,观察到有少量白色沉淀生成,该白色沉淀是___________ (填化学式)。
(3)试管②中,观察到的现象是___________ ; 发生
发生___________ (填“氧化”或“还原”)反应。
(4)试管③中,观察到新制氯水褪色,利用对比实验排除了稀释对溶液颜色变化的影响。该反应的离子方程式为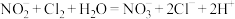 。该实验选择新制氯水的原因有二:一是具有强氧化性,二是
。该实验选择新制氯水的原因有二:一是具有强氧化性,二是___________ 。
【反思评价】
(5)综合上述实验,甲同学得出以下结论。你认为甲同学所得结论正确的是___________ (填标号)。
a.从试管②中的现象可得出酸性条件下,氧化性: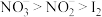
b.试管①和③中的实验现象均可以证明固体X中含有
 固体。已知
固体。已知 固体在一定温度下能发生反应:
固体在一定温度下能发生反应: 。为了探究加热蒸发所得固体X中是否含有亚硝酸钾(KNO2),小组同学设计并完成了以下实验。
。为了探究加热蒸发所得固体X中是否含有亚硝酸钾(KNO2),小组同学设计并完成了以下实验。【查阅资料】
i.
 是微溶于水的白色(略带黄色)固体
是微溶于水的白色(略带黄色)固体ii.
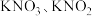 能在酸性条件下与
能在酸性条件下与 反应,生成
反应,生成
【实验过程】

【分析解释】
(1)
 中N的化合价是
中N的化合价是 具有的性质是
具有的性质是A.只有氧化性 B.只有还原性 C.既有氧化性,又有还原性
(2)试管①中,观察到有少量白色沉淀生成,该白色沉淀是
(3)试管②中,观察到的现象是
 发生
发生(4)试管③中,观察到新制氯水褪色,利用对比实验排除了稀释对溶液颜色变化的影响。该反应的离子方程式为
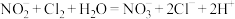 。该实验选择新制氯水的原因有二:一是具有强氧化性,二是
。该实验选择新制氯水的原因有二:一是具有强氧化性,二是【反思评价】
(5)综合上述实验,甲同学得出以下结论。你认为甲同学所得结论正确的是
a.从试管②中的现象可得出酸性条件下,氧化性:
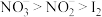
b.试管①和③中的实验现象均可以证明固体X中含有

您最近一年使用:0次
名校
解题方法
2 . 某校实验小组欲探究 溶液与
溶液与 的反应。
的反应。
Ⅰ.配制 溶液。
溶液。
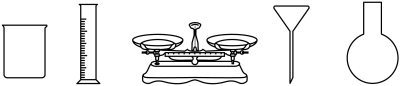
(1)由 固体配制
固体配制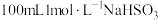 溶液,下列仪器中需要使用的有
溶液,下列仪器中需要使用的有_______ (写出名称)。
Ⅱ.探究 溶液与
溶液与 的反应。
的反应。
经查阅资料,该实验小组设计了如下实验,结合实验现象回答下列问题:
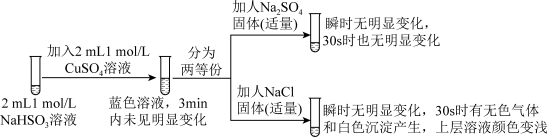
已知: 易溶于水;CuCl为白色难溶于水的固体。
易溶于水;CuCl为白色难溶于水的固体。
(2)若试管d中发生了氧化还原反应,写出该反应的离子方程式_______ 。
(3)该实验小组对试管d中加入NaCl固体后产生白色沉淀的原因提出了如下猜想:
猜想1: 改变了
改变了 的还原性。
的还原性。
猜想2: 改变了
改变了 的氧化性。
的氧化性。
为进一步证实上述猜想,该实验小组利用原电池原理设计了如下实验:
通过分析上表中对比实验现象可知_______ (填“猜想1”或“猜想2”)不合理。
(4)为证明猜想2的合理性,对实验1的装置做了如下改进:
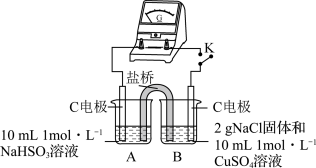
①烧杯B中的石墨电极是原电池的_______ 极,电极反应式为_______ 。
②闭合开关K,若_______ (描述实验现象),说明猜想2合理。
③请从化学反应原理的角度解释原因_______ ,使 与
与 的反应能够进行完全。
的反应能够进行完全。
 溶液与
溶液与 的反应。
的反应。Ⅰ.配制
 溶液。
溶液。(1)由
 固体配制
固体配制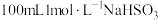 溶液,下列仪器中需要使用的有
溶液,下列仪器中需要使用的有
Ⅱ.探究
 溶液与
溶液与 的反应。
的反应。经查阅资料,该实验小组设计了如下实验,结合实验现象回答下列问题:

已知:
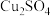 易溶于水;CuCl为白色难溶于水的固体。
易溶于水;CuCl为白色难溶于水的固体。(2)若试管d中发生了氧化还原反应,写出该反应的离子方程式
(3)该实验小组对试管d中加入NaCl固体后产生白色沉淀的原因提出了如下猜想:
猜想1:
 改变了
改变了 的还原性。
的还原性。猜想2:
 改变了
改变了 的氧化性。
的氧化性。为进一步证实上述猜想,该实验小组利用原电池原理设计了如下实验:
| 编号 | 实验1 | 实验2 |
| 实验装置 | 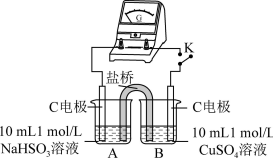 | 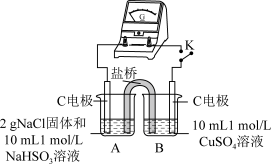 |
| 实验现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |
(4)为证明猜想2的合理性,对实验1的装置做了如下改进:

①烧杯B中的石墨电极是原电池的
②闭合开关K,若
③请从化学反应原理的角度解释原因
 与
与 的反应能够进行完全。
的反应能够进行完全。
您最近一年使用:0次
2023-02-07更新
|
526次组卷
|
3卷引用:福建省漳州市2023届高三毕业班1月教学质量检测化学试题
福建省漳州市2023届高三毕业班1月教学质量检测化学试题(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(实验综合题)湖南省永州市第一中学2022-2023学年高三下学期3月月考化学试题
12-13高一上·黑龙江大庆·期末
名校
3 . 物质在反应中可表现氧化性、还原性、酸性、碱性等,下面方程式中划线的物质,能在同一反应中同时表现上述两种或两种以上性质的有( )
①3FeO + 10HNO3 = 3Fe(NO3)3 + NO + 5H2O
②C + 2H2SO4(浓) = CO2 + 2SO2 + 2H2O
③8NH3 + 3Cl2 =6NH4Cl + N2
④2Na2O2 + 2H2O =4NaOH + O2
①3FeO + 10HNO3 = 3Fe(NO3)3 + NO + 5H2O
②C + 2H2SO4(浓) = CO2 + 2SO2 + 2H2O
③8NH3 + 3Cl2 =6NH4Cl + N2
④2Na2O2 + 2H2O =4NaOH + O2
| A.①② | B.①④ | C.③④ | D.全部 |
您最近一年使用:0次
2020-10-24更新
|
125次组卷
|
15卷引用:2015届福建省三明一中高三学年度上学期第一次月考化学试卷
(已下线)2015届福建省三明一中高三学年度上学期第一次月考化学试卷(已下线)2015届福建省三明一中高三上学期第一次月考化学试卷福建省龙海市第二中学2016-2017学年高二下学期期末考试化学试题(已下线)2011—2012学年度黑龙江大庆实验中学高一上学期期末考试化学试卷(已下线)2011-2012学年河北省邯郸市高一下学期期末教学质量检测化学试卷(已下线)2012-2013学年黑龙江省集贤县第一中学高一上学期期末考试化学试卷2016届湖南省衡阳市第八中学高三上学期第二次月考化学试卷2017届湖南省衡阳八中高三上学期9月月考化学试卷湖南省邵东县第一中学2017届高三上学期第三次月考化学试题(已下线)二轮复习 专题6 非金属及其化合物 押题专练(已下线)2019高考备考二轮复习精品资料-专题6 非金属及其化合物(押题专练)浙江省余姚中学2020-2021学年高二上学期10月质量检测化学试题浙江省宁波市余姚中学2020-2021学年高一上学期10月质量检测化学试题宁夏回族自治区中卫市海原县第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)【浙江新东方】62
解题方法
4 . 硫元素是动植物生长不可缺少的元素,如图是硫元素的价类二维图。

(1)A的化学式为___ ;Na2SO4的电离方程式为___ 。将气体A通入SO2的水溶液中,可观察到的现象是___ 。
(2)兴趣小组依据价类二维图,设计实验实现物质间的转化。
①从“价维”角度,写出一个实现“浓H2SO4→SO2”的化学方程式:____ 。
②兴趣小组从“价维”角度设计实验处理含SO2的废气。先将废气通入Fe2(SO4)3酸性溶液中,充分吸收后,再向所得溶液中鼓入空气,得到溶液X。
ⅰ.该实验利用SO2的___ (填标号)。
a.氧化性 b.还原性 c.漂白性 d.酸性
ⅱ.溶液X中可能含Fe2+和Fe3+,为了探究其成分设计以下实验。请在答题卡上完成表中内容。
ⅲ.在处理过程中,可替代空气的最佳试剂是____ (填标号)。
a.Cl2 b.Fe c.NaOH d.H2O2
③从“类维”角度设计一个吸收废气中SO2的反应,写出相应的离子方程式。___ 。

(1)A的化学式为
(2)兴趣小组依据价类二维图,设计实验实现物质间的转化。
①从“价维”角度,写出一个实现“浓H2SO4→SO2”的化学方程式:
②兴趣小组从“价维”角度设计实验处理含SO2的废气。先将废气通入Fe2(SO4)3酸性溶液中,充分吸收后,再向所得溶液中鼓入空气,得到溶液X。
ⅰ.该实验利用SO2的
a.氧化性 b.还原性 c.漂白性 d.酸性
ⅱ.溶液X中可能含Fe2+和Fe3+,为了探究其成分设计以下实验。请在答题卡上完成表中内容。
| 实验操作 | 现象 | 结论 |
| 取少量溶液X于试管中,滴加酸性高锰酸钾溶液 | 溶液X含Fe2+ | |
| 另取少量溶液X于试管中,滴加硫氰酸钾溶液 | 溶液变红色 |
ⅲ.在处理过程中,可替代空气的最佳试剂是
a.Cl2 b.Fe c.NaOH d.H2O2
③从“类维”角度设计一个吸收废气中SO2的反应,写出相应的离子方程式。
您最近一年使用:0次
解题方法
5 . 某研究性学习小组为了制取NH3,并探究NH3,铵盐相关的性质,进行了以下实验:

【制取氨气】
(1)A中发生反应的化学方程式为:_______________________ 。
(2)按图A装置制取NH3,生成的NH3,可用______ (填“浓H2SO4”或“碱石灰”)干燥,收集NH3应选择_______ (填“B”或“C”)装置。
(3)实验室制取O2、H2中,可选用A装置的气体是_________ 。
(4)若生成标准状况下22.4LNH3,至少需要NH4Cl的质量为___________ g(NH4Cl摩尔质量为53.5g·mol-1)。
【实验探究】
查阅资料可知:通常铵盐是白色晶体,易溶于水,受热易分,和碱反应能产生氨气。
(5)某同学用刚清洗过、含有较多水分的集气瓶收集氨气,__________ (填“能”或“不能”)收集到氨气。
(6)为确认某固体化肥样品中含有NH ,不必用到的试纸或试剂是
,不必用到的试纸或试剂是_____________ (只有一个正确选项)。
①NaOH溶液 ②红色石蕊试纸 ③稀H2SO4
(7)分别在两个集气瓶中滴入浓氨水和浓盐酸,盖上玻璃片,如图所示放置,然后抽去中间的玻璃片,观察到__________________ 现象。

【知识应用】
(8)为了防止碳酸氢铵肥效降低,你认为应该如何科学储存:_______________ (写出一种有效储存方法)。
(9)氨气的用途很广。如可利用氨气在催化剂存在的情况下与氧气反应来制取生产硝酸所需要的一氧化氮:4NH3+5O2 4NO+6H2O,在该反应中氨气体现
4NO+6H2O,在该反应中氨气体现 _________________ (选填“氧化性”或“还原性”)。请你列举氨气的另一种用途:______________ 。

【制取氨气】
(1)A中发生反应的化学方程式为:
(2)按图A装置制取NH3,生成的NH3,可用
(3)实验室制取O2、H2中,可选用A装置的气体是
(4)若生成标准状况下22.4LNH3,至少需要NH4Cl的质量为
【实验探究】
查阅资料可知:通常铵盐是白色晶体,易溶于水,受热易分,和碱反应能产生氨气。
(5)某同学用刚清洗过、含有较多水分的集气瓶收集氨气,
(6)为确认某固体化肥样品中含有NH
 ,不必用到的试纸或试剂是
,不必用到的试纸或试剂是①NaOH溶液 ②红色石蕊试纸 ③稀H2SO4
(7)分别在两个集气瓶中滴入浓氨水和浓盐酸,盖上玻璃片,如图所示放置,然后抽去中间的玻璃片,观察到

【知识应用】
(8)为了防止碳酸氢铵肥效降低,你认为应该如何科学储存:
(9)氨气的用途很广。如可利用氨气在催化剂存在的情况下与氧气反应来制取生产硝酸所需要的一氧化氮:4NH3+5O2
 4NO+6H2O,在该反应中氨气体现
4NO+6H2O,在该反应中氨气体现
您最近一年使用:0次
6 . 氯化亚硝酰(NOC1,沸点为-5.5 °C )是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2 + HNO3 =AgNO3+ HNO2。
(1)将5g在300°C下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002 mol NO2。反应12~36 min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为____________ , 氯化钾需要“干燥”的原因是_____________ 。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。
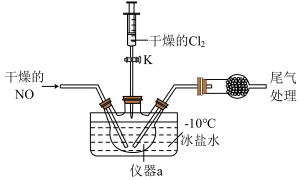
①仪器a的名称为__________ 。
②干燥管中盛放的试剂为____________ 。
③生成NOCl的化学方程式为________________ 。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
(1)将5g在300°C下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002 mol NO2。反应12~36 min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。

①仪器a的名称为
②干燥管中盛放的试剂为
③生成NOCl的化学方程式为
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
| 步骤 | 实验现象或反应的化学方程式 |
| ①取5ml三颈烧瓶中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O发应的化学方程式 |
| ②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为 |
| ③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为 |
您最近一年使用:0次
名校
7 . 研究指出:多种海产品如虾、蟹、牡蛎等体内含有+5价的砷(As)元素,它对人体是无毒的,吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:“大量海鲜+大量维生素C = 砒霜(As2O3)”,这说明维生素C具有
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
您最近一年使用:0次
2016-12-09更新
|
229次组卷
|
5卷引用:2014-2015福建省龙岩市非一级达标校高一上学期期末化学试卷
名校
8 . 下列有关性质的比较,不正确的是
| A.金属性:Na>K | B.氧化性: |
C.还原性: | D.碱性: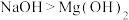 |
您最近一年使用:0次
2023-12-29更新
|
382次组卷
|
5卷引用:福建省福州市九师教学联盟2023-2024学年高一上学期期末学业联考化学试题
福建省福州市九师教学联盟2023-2024学年高一上学期期末学业联考化学试题云南省昆明市云南师范大学附属中学2023-2024学年高一上学期12月月考化学试题(已下线)寒假作业10 元素周期律-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)河北省衡水市安平中学2023-2024学年高一下学期开学考试化学试题云南省丽江润泽高级中学2023-2024学年高一下学期开学考试化学试题
名校
解题方法
9 . 氯及其化合物既是重要化工原料,又是高效、广谱消毒剂。
(1)漂白粉是常见的消毒剂,写出工业制取漂白粉的化学方程式:_____ 。漂白粉长时期露至在空气中会失效,用化学方程式表示其失效的原因:____ 。
(2)实验室利用如图装置制备KClO和KClO3。
已知:6OH-+3Cl2 5Cl-+ClO
5Cl-+ClO +3H2O
+3H2O
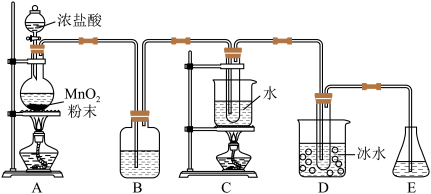
①盛放浓盐酸的仪器名称是____ ,A中发生反应的离子方程式为_____ 。
②B的作用是____ ;C中试管内盛放的试剂为____ 。
③用8.7gMnO2与足量浓盐酸充分反应,生成Cl2的质量为____ 。
(3)某同学设计实验探究84消毒液的漂白性。
I.在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。
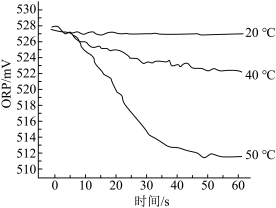
已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
(1)实验I、II现象不同的原因是为____ 。
(2)实验III中,随时间的变化ORP值不同的原因可能是____ 。
(1)漂白粉是常见的消毒剂,写出工业制取漂白粉的化学方程式:
(2)实验室利用如图装置制备KClO和KClO3。
已知:6OH-+3Cl2
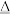 5Cl-+ClO
5Cl-+ClO +3H2O
+3H2O
①盛放浓盐酸的仪器名称是
②B的作用是
③用8.7gMnO2与足量浓盐酸充分反应,生成Cl2的质量为
(3)某同学设计实验探究84消毒液的漂白性。
I.在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
(1)实验I、II现象不同的原因是为
(2)实验III中,随时间的变化ORP值不同的原因可能是
您最近一年使用:0次
2021高三·全国·专题练习
名校
解题方法
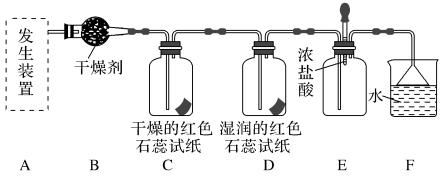
10 . 某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。
[实验探究]
(1)利用上述原理,实验室制取氨气应选用下图中___________ (填序号)发生装置进行实验。
(2)B装置中的干燥剂可选用___________ (填“碱石灰”或“浓硫酸”)。
(3)用5.35 g NH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为___________ L。(NH4Cl的摩尔质量为53.5 g·mol-1)
(4)气体通过C、D装置时,试纸颜色会发生变化的是___________ (填“C”或“D”)。
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是___________ 。
(6)F装置中倒置漏斗的作用是___________ 。
(7)某同学用氨气和滴加酚酞的水做喷泉实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有___________性质(填序号)。
(8)氨气的用途很广。如可用氨气处理二氧化氮:8NH3+6NO2=7N2+12H2O,该反应中氨气体现___________ (填“氧化性”或“还原性”)。请你列举出氨气的另一种用途:___________ 。

[实验探究]
(1)利用上述原理,实验室制取氨气应选用下图中

(2)B装置中的干燥剂可选用
(3)用5.35 g NH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为
(4)气体通过C、D装置时,试纸颜色会发生变化的是
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是
(6)F装置中倒置漏斗的作用是
(7)某同学用氨气和滴加酚酞的水做喷泉实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有___________性质(填序号)。
| A.还原性 | B.极易溶于水 | C.与水反应生成碱性物质 |
您最近一年使用:0次



