名校
解题方法
1 . 三氯化六氨合钴(III)([Co(NH3)6]Cl3,钴为+3价)在钴化合物的合成中是重要原料。实验室以CoCl2为原料制备[Co(NH3)6]Cl3,步骤如下:
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。
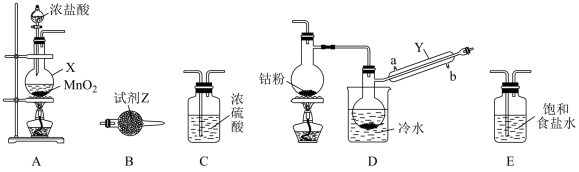
(1)仪器X的名称为____ 。
(2)X中发生反应的离子方程式为____ 。
(3)装置的连接顺序为A→____ →B;反应开始前应先点燃A处的酒精灯,其目的是___ 。
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是____ 。
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为____ 。
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
则该氧化还原滴定指示剂为____ ,该样品中钴元素的质量分数为____ 。
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。

(1)仪器X的名称为
(2)X中发生反应的离子方程式为
(3)装置的连接顺序为A→
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O
 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。则该氧化还原滴定指示剂为
您最近一年使用:0次
2022-09-20更新
|
246次组卷
|
2卷引用:河南省确山县第二高级中学2021-2022学年高三上学期期中考试化学试题
名校
解题方法
2 . 黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,实验方案如下。回答下列问题:
(1)配制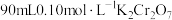 溶液
溶液
①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有___________ 、___________ 。
②计算,称量:需用天平称量___________ 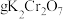 固体(
固体(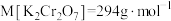 )。
)。
③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先___________ ,再改用胶头滴管加水至溶液凹液面最低处与刻度线相切。
④下列操作使结果偏低的是___________ 。
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
①“步骤一”中加入过量铜粉的目的是___________ 。
②请配平步骤②中发生反应的离子反应方程式:___________
6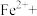 1
1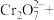 □
□ =□
=□ □
□ □
□ 。
。
③实验测得黑木耳中铁元素的质量分数为___________ 。
(1)配制
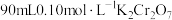 溶液
溶液①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有
②计算,称量:需用天平称量
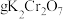 固体(
固体(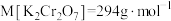 )。
)。③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先
④下列操作使结果偏低的是
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
| 步骤一 | 取112g黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉 |
| 步骤二 | 过滤,向滤液中加入0.10mol/L酸性 溶液10mL时,恰好完全反应 溶液10mL时,恰好完全反应 |
②请配平步骤②中发生反应的离子反应方程式:
6
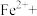 1
1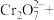 □
□ =□
=□ □
□ □
□ 。
。③实验测得黑木耳中铁元素的质量分数为
您最近一年使用:0次
2022-01-19更新
|
462次组卷
|
5卷引用:广东省佛山市2021-2022学年高一上学期高中教学质量检测化学试题
名校
解题方法
3 . 在下列转化关系中,烃A为石油的裂解气里含量较高的气体(碳元素的质量分数为0.857),B分子中含有三元环,分子式为C2H4O;1molD与足量Zn反应生成22.4H2(标准状况);E为六元环化合物。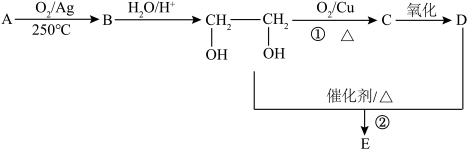
请回答:
(1)A的结构式___ ,B的结构简式___ 。
(2)①的反应类型为___ ,D中官能团的名称是___ 。
(3)写出反应②的化学方程式__ 。

请回答:
(1)A的结构式
(2)①的反应类型为
(3)写出反应②的化学方程式
您最近一年使用:0次
2021-06-28更新
|
193次组卷
|
2卷引用:浙江省绍兴市诸暨市2020-2021学年高一下学期期末考试化学试题
名校
解题方法
4 . 下列有关各实验说法不正确的是
| A.配制60mL0.1mol/L硫酸铜溶液,需称取胆矾晶体2.5g |
| B.制取乙酸乙酯的实验中,饱和Na2CO3溶液可以换成饱和NaHCO3溶液 |
| C.测定硫酸铜晶体中结晶水的含量实验中,加热后坩埚和药品总质量应至少连续两次称量质量差小于0.1g |
| D.用质量分数98%的浓H2SO4配制0.5mol/LH2SO4溶液,量取浓硫酸时俯视读数,将导致实验结果偏高 |
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
5 . 已知CaO2在350 ℃迅速分解生成CaO和O2.如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
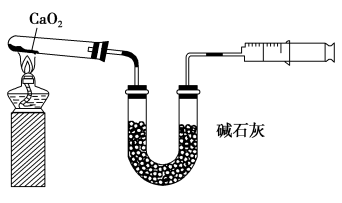
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为___________ (用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有___________ 。

若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 某兴趣小组利用废旧电池的铜帽(铜锌总含量约99%)制备了CuSO4·5H2O样品,制备流程如下:

(1)“溶解II”过程中,发生反应的离子方程式为________ 。
(2)“溶解II”过程中应控制反应温度,温度不能过高的原因是________ 。
(3)为测定所得CuSO4·5H2O样品的纯度,兴趣小组进行了如下实验:称取2.540g样品,配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入0.0400mol·L-1的Na2S2O3溶液至刚好完全反应,恰好完全反应时消耗Na2S2O3溶液的体积为25.00mL。实验过程中发生的反应如下:2Cu2++4I-=2CuI↓+I2; 2 +I2=
+I2= +2I-。
+2I-。
①配制250mL溶液所需的玻璃仪器除烧杯、玻璃棒外还有_____ 。
②计算出样品中CuSO4·5H2O的质量分数_____ 。(写出计算过程)

(1)“溶解II”过程中,发生反应的离子方程式为
(2)“溶解II”过程中应控制反应温度,温度不能过高的原因是
(3)为测定所得CuSO4·5H2O样品的纯度,兴趣小组进行了如下实验:称取2.540g样品,配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入0.0400mol·L-1的Na2S2O3溶液至刚好完全反应,恰好完全反应时消耗Na2S2O3溶液的体积为25.00mL。实验过程中发生的反应如下:2Cu2++4I-=2CuI↓+I2; 2
 +I2=
+I2= +2I-。
+2I-。①配制250mL溶液所需的玻璃仪器除烧杯、玻璃棒外还有
②计算出样品中CuSO4·5H2O的质量分数
您最近一年使用:0次
名校
解题方法
7 . 运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。

①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___________ (填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v逆___________ (填“>”“<”或“=”)v正。
③平衡常数K(A)___________ K(C)(填“>”“<”或“=”)
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g) 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是___________ (填编号)。
A.使用更高效的催化剂B.升高温度
C.及时分离出氨气D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。从第11 min起,升高温度,则n(N2)的变化曲线为___________ (填编号)。

(3)顺—1,2—二甲基环丙烷和反—1,2—二甲基环丙烷可发生如图转化:



该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
①该反应的活化能Ea(正)小于Ea(逆),则
___________ 0(填“小于”“等于”或“大于”)。
②t温度下,图中能表示顺式异构体的质量分数随时间变化的曲线是___________ (填曲线编号),平衡常数值K2=___________ (保留2位小数)。

(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡
②若反应进行到状态D时,v逆
③平衡常数K(A)
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g)
 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是
A.使用更高效的催化剂B.升高温度
C.及时分离出氨气D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。从第11 min起,升高温度,则n(N2)的变化曲线为

(3)顺—1,2—二甲基环丙烷和反—1,2—二甲基环丙烷可发生如图转化:



该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
①该反应的活化能Ea(正)小于Ea(逆),则

②t温度下,图中能表示顺式异构体的质量分数随时间变化的曲线是

您最近一年使用:0次
8 . X、Y、Z、Q四种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳中含量(质量分数)最多的元素,Q的核电荷数是X与Z的核电荷数之和。请回答下列问题。
(1)X、Y的元素符号依次为___________ 、___________ 。
(2)XZ2与YZ2分别属于___________ (填“极性分子”或“非极性分子”,下同)和___________ 。
(3)Q的元素符号是___________ ,它位于第___________ 周期,在形成化合物时它的最高化合价为___________ 。
(1)X、Y的元素符号依次为
(2)XZ2与YZ2分别属于
(3)Q的元素符号是
您最近一年使用:0次
名校
9 . 某纯碱样品只含NaCl杂质,为测定样品中 的含量进行如下实验。
的含量进行如下实验。
实验Ⅰ:甲小组称取样品5.00g,采用如下实验装置进行实验。实验结束时,分离③中所得固体,称其质量为7.88g。

(1)装置①的作用是___________ 。
(2)装置②中反应的离子方程式为___________ 。
(3)下列说法不正确的是___________(填标号)。
(4)样品中 的质量分数为
的质量分数为____ 。
实验Ⅱ:乙小组称取样品ag,采用如图实验装置进行实验。
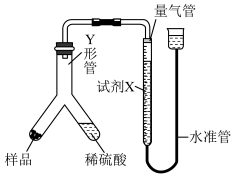
(5)试剂X应选择____ (填标号)。
A.饱和 溶液 B.饱和
溶液 B.饱和 溶液 C.饱和
溶液 C.饱和 溶液
溶液
(6)下列哪些因素会造成样品中 的含量偏低
的含量偏低___ (填标号)。
A.将稀硫酸替换为盐酸
B.读数时未冷却至室温
C.读数时水准管的液面高于量气管的液面
(7)实验结束时,所得气体体积为V mL。实验时的气体摩尔体积为 ,则样品
,则样品 的质量分数为
的质量分数为______ 。
 的含量进行如下实验。
的含量进行如下实验。实验Ⅰ:甲小组称取样品5.00g,采用如下实验装置进行实验。实验结束时,分离③中所得固体,称其质量为7.88g。

(1)装置①的作用是
(2)装置②中反应的离子方程式为
(3)下列说法不正确的是___________(填标号)。
| A.先通入空气一段时间,再滴加盐酸 |
| B.装置②、③间应增加除去HCl杂质的装置 |
| C.装置④的作用是吸收尾气,防止空气污染 |
| D.停止滴加盐酸后,还需继续通入空气一段时间 |
 的质量分数为
的质量分数为实验Ⅱ:乙小组称取样品ag,采用如图实验装置进行实验。

(5)试剂X应选择
A.饱和
 溶液 B.饱和
溶液 B.饱和 溶液 C.饱和
溶液 C.饱和 溶液
溶液(6)下列哪些因素会造成样品中
 的含量偏低
的含量偏低A.将稀硫酸替换为盐酸
B.读数时未冷却至室温
C.读数时水准管的液面高于量气管的液面
(7)实验结束时,所得气体体积为V mL。实验时的气体摩尔体积为
 ,则样品
,则样品 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
10 .  (过氧化钙)在医用防腐、消毒等方面应用广泛。它难溶于水、乙醇等溶剂,易溶于酸,温度过高易分解释放出氧气。实验室以大理石(含少量
(过氧化钙)在医用防腐、消毒等方面应用广泛。它难溶于水、乙醇等溶剂,易溶于酸,温度过高易分解释放出氧气。实验室以大理石(含少量 等杂质)为原料制备过氧化钙及含量测定如下:
等杂质)为原料制备过氧化钙及含量测定如下:
(一)过氧化钙的制备流程
大理石 滤液
滤液
 滤渣
滤渣
 产品
产品
已知:
(1)仪器B的名称为___________
(2)步骤①的具体操作为逐滴加入适量稀盐酸,将溶液煮沸,趁热过滤,将溶液煮沸的作用是___________
(3)步骤②的装置示意图如图,此步骤的关键是控制温度,步骤②涉及到的反应放热比较明显,所以通常用磁力搅拌、冷水浴、缓慢滴加反应物双氧水溶液,控制低温的目的是_____ (任说一点)

(二)过氧化钙的含量测定
(4)方法一:取0.1350g产品于锥形瓶中,先酸化生成 ,再用标准
,再用标准 溶液滴定生成的
溶液滴定生成的 ,平行测定多次。下列说法正确的是___________。
,平行测定多次。下列说法正确的是___________。
方法二:取0.1350g产品于硬质玻璃管中,加热,收集气体,平行测定多次。
(5)可用下图所示装置收集并测定气体的体积。

应该选择上述中的___________ (甲/乙)装置,原因是___________ 。
(6)方法二数据记录如下表(标况下),产品中过氧化钙的含量___________ (以质量分数表示)。
 (过氧化钙)在医用防腐、消毒等方面应用广泛。它难溶于水、乙醇等溶剂,易溶于酸,温度过高易分解释放出氧气。实验室以大理石(含少量
(过氧化钙)在医用防腐、消毒等方面应用广泛。它难溶于水、乙醇等溶剂,易溶于酸,温度过高易分解释放出氧气。实验室以大理石(含少量 等杂质)为原料制备过氧化钙及含量测定如下:
等杂质)为原料制备过氧化钙及含量测定如下:(一)过氧化钙的制备流程
大理石
 滤液
滤液
 滤渣
滤渣
 产品
产品已知:

(1)仪器B的名称为
(2)步骤①的具体操作为逐滴加入适量稀盐酸,将溶液煮沸,趁热过滤,将溶液煮沸的作用是
(3)步骤②的装置示意图如图,此步骤的关键是控制温度,步骤②涉及到的反应放热比较明显,所以通常用磁力搅拌、冷水浴、缓慢滴加反应物双氧水溶液,控制低温的目的是

(二)过氧化钙的含量测定
(4)方法一:取0.1350g产品于锥形瓶中,先酸化生成
 ,再用标准
,再用标准 溶液滴定生成的
溶液滴定生成的 ,平行测定多次。下列说法正确的是___________。
,平行测定多次。下列说法正确的是___________。A. 溶液配制之后需要标定,标定 溶液配制之后需要标定,标定 溶液可以选择用配制的一定浓度的 溶液可以选择用配制的一定浓度的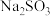 溶液进行滴定 溶液进行滴定 |
| B.称取0.1350g产品时,通电后,先将干燥、洁净的锥形瓶置于电子天平秤盘中央,待数字稳定后按归零键再缓缓加入所需质量的样品 |
C. 产品酸化在这里应该选择较低浓度的盐酸,若盐酸浓度过高会导致高锰酸钾氧化盐酸 产品酸化在这里应该选择较低浓度的盐酸,若盐酸浓度过高会导致高锰酸钾氧化盐酸 |
| D.读取滴定管中高锰酸钾溶液的体积的时候,可以把滴定管从滴定管夹上取下来,手持滴定管0刻度以上部分,读取管内液体的最高面 |
方法二:取0.1350g产品于硬质玻璃管中,加热,收集气体,平行测定多次。
(5)可用下图所示装置收集并测定气体的体积。

应该选择上述中的
(6)方法二数据记录如下表(标况下),产品中过氧化钙的含量
| 测定次数 | 收集前读数/mL | 收集后读数/mL |
| 第1次 |  | 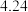 |
| 第2次 |  | 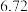 |
| 第3次 |  |  |
| 第4次 | 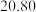 | 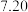 |
您最近一年使用:0次



