名校
解题方法
1 . 84消毒液是一种常见的含氯消毒剂。如图为某品牌84消毒液的说明书中的部分内容。

(1)84消毒液的主要成分为_______ (用化学式表示)。
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:_______ 。
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
Ⅰ.向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
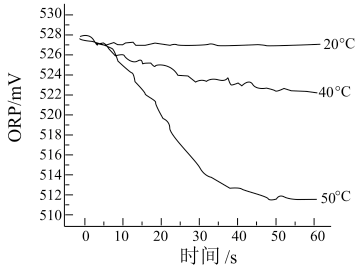
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。
①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是_______ 。
②实验表明,向84消毒液中加入较多稀硫酸时会产生氯气,生成氯气的离子方程式是_______ 。
③由实验Ⅲ可得出的结论是_______ 。ORP值不同的原因可能是_______ 。
(4)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为_______ mol∙L−1。

| 产品特点 本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项 1.本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。 2.不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 3.置于避光、阴凉处保存。 4.需稀释后使用,勿口服。 |
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
Ⅰ.向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。

①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是
②实验表明,向84消毒液中加入较多稀硫酸时会产生氯气,生成氯气的离子方程式是
③由实验Ⅲ可得出的结论是
(4)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
您最近一年使用:0次
2021-01-24更新
|
579次组卷
|
4卷引用:北京市东城区2020-2021学年高一上学期期末考试化学试题
2 . Ⅰ. 元素X、Y、Z、W、Q在元素周期表中的相对位置如下图所示。
(1)元素X在周期表中的位置是第_______ 周期,第_______ 族。
(2)五种元素中离子半径最小的是_______ 。
Ⅱ. 下图是部分短周期主族元素原子半径与原子序数的关系。

(3)X的元素符号:_______ 。
(4)Y与Z形成的是_______ 化合物。(填“离子”或“共价”)
(5)上述元素的最高价含氧酸中酸性最强的是_______ (填化学式)。
Ⅲ.(6)下列关于元素及其化合物性质的判断中,正确的是_______ (填序号)
A. 元素甲的氢氧化物只有碱性,而元素乙的氢氧化物具有两性,所以金属性:甲>乙
B. 元素甲最外层只有一个电子,而乙最外层有两个电子,所以金属性:甲>乙
C. 金属元素 、
、 能分别形成+2、+3价离子,所以氧化性:
能分别形成+2、+3价离子,所以氧化性: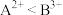
D. 因为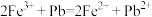 ,所以金属性:
,所以金属性:
E. 因为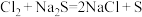 ,所以非金属性:
,所以非金属性:
F. 因为水溶液的酸性: ,所以非金属性:
,所以非金属性:
G. 是一元酸,而
是一元酸,而 是二元酸,所以酸性:
是二元酸,所以酸性: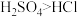
Ⅳ.(7)甲同学查阅资料知:氨气( )的分解温度在850℃以上,甲烷(
)的分解温度在850℃以上,甲烷( )的分解温度是655℃,据此得出结论:N元素的非金属性强于C元素。乙同学对此结论持怀疑态度,甲同学通过实验间接证明了自己的结论。你认为甲同学的实验方案是(请结合离子方程式简要说明):
)的分解温度是655℃,据此得出结论:N元素的非金属性强于C元素。乙同学对此结论持怀疑态度,甲同学通过实验间接证明了自己的结论。你认为甲同学的实验方案是(请结合离子方程式简要说明):_______ 。
| X | Y | ||||
| Z | W | Q |
(2)五种元素中离子半径最小的是
Ⅱ. 下图是部分短周期主族元素原子半径与原子序数的关系。

(3)X的元素符号:
(4)Y与Z形成的是
(5)上述元素的最高价含氧酸中酸性最强的是
Ⅲ.(6)下列关于元素及其化合物性质的判断中,正确的是
A. 元素甲的氢氧化物只有碱性,而元素乙的氢氧化物具有两性,所以金属性:甲>乙
B. 元素甲最外层只有一个电子,而乙最外层有两个电子,所以金属性:甲>乙
C. 金属元素
 、
、 能分别形成+2、+3价离子,所以氧化性:
能分别形成+2、+3价离子,所以氧化性: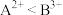
D. 因为
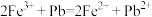 ,所以金属性:
,所以金属性:
E. 因为
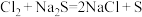 ,所以非金属性:
,所以非金属性:
F. 因为水溶液的酸性:
 ,所以非金属性:
,所以非金属性:
G.
 是一元酸,而
是一元酸,而 是二元酸,所以酸性:
是二元酸,所以酸性: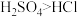
Ⅳ.(7)甲同学查阅资料知:氨气(
 )的分解温度在850℃以上,甲烷(
)的分解温度在850℃以上,甲烷( )的分解温度是655℃,据此得出结论:N元素的非金属性强于C元素。乙同学对此结论持怀疑态度,甲同学通过实验间接证明了自己的结论。你认为甲同学的实验方案是(请结合离子方程式简要说明):
)的分解温度是655℃,据此得出结论:N元素的非金属性强于C元素。乙同学对此结论持怀疑态度,甲同学通过实验间接证明了自己的结论。你认为甲同学的实验方案是(请结合离子方程式简要说明):
您最近一年使用:0次
3 . 亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。
(1)已知亚硝酸钠能发生如下反应,请将化学方程式配平:_____ 。
_______NaNO2 + _______HI =_______NO↑+_______NaI + _______I2 + _______H2O
(2)①用单线桥法标出该反应中电子转移的方向及数目:_______ 。
②被氧化的原子与被还原的原子数目之比为_______ 。
③若反应中转移0.1 mol电子,则被消耗的NaNO2为_______ g。
(3)HI在反应中表现的性质是_______ (填序号)
① 还原性 ② 氧化性 ③ 酸性
(4)自来水中的NO 对人类健康会产生危害,碱性条件下用Mg还原NO
对人类健康会产生危害,碱性条件下用Mg还原NO ,主要产物是Mg(OH)2 、N2等,写出该反应过程的离子方程式
,主要产物是Mg(OH)2 、N2等,写出该反应过程的离子方程式_______ 。
(1)已知亚硝酸钠能发生如下反应,请将化学方程式配平:
_______NaNO2 + _______HI =_______NO↑+_______NaI + _______I2 + _______H2O
(2)①用单线桥法标出该反应中电子转移的方向及数目:
②被氧化的原子与被还原的原子数目之比为
③若反应中转移0.1 mol电子,则被消耗的NaNO2为
(3)HI在反应中表现的性质是
① 还原性 ② 氧化性 ③ 酸性
(4)自来水中的NO
 对人类健康会产生危害,碱性条件下用Mg还原NO
对人类健康会产生危害,碱性条件下用Mg还原NO ,主要产物是Mg(OH)2 、N2等,写出该反应过程的离子方程式
,主要产物是Mg(OH)2 、N2等,写出该反应过程的离子方程式
您最近一年使用:0次
解题方法
4 . 利用下图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:
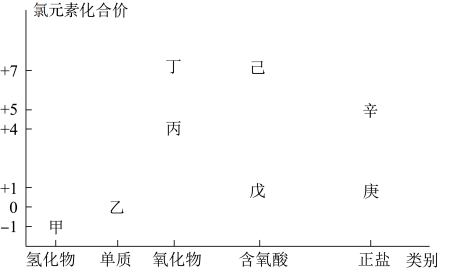
(1)丁属于___________ (“酸性”或“碱性”)氧化物;
(2)图中甲、乙、丙、戊中,属于电解质的是___________ (填化学式);根据氯元素的化合价判断,乙物质___________ ;
A. 只有氧化性 B. 只有还原性 C. 既有氧化性又有还原性
(3)电解甲溶液制备己的化学反应为: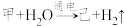 (未配平),则配平后参与反应的甲与H2O的物质的量之比是
(未配平),则配平后参与反应的甲与H2O的物质的量之比是___________ ;
(4)庚是漂白粉的有效成分,用乙制取庚的化学方程式为___________ ;
(5)已知己是最强的无机酸,写出己的电离方程式___________ 。

(1)丁属于
(2)图中甲、乙、丙、戊中,属于电解质的是
A. 只有氧化性 B. 只有还原性 C. 既有氧化性又有还原性
(3)电解甲溶液制备己的化学反应为:
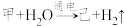 (未配平),则配平后参与反应的甲与H2O的物质的量之比是
(未配平),则配平后参与反应的甲与H2O的物质的量之比是(4)庚是漂白粉的有效成分,用乙制取庚的化学方程式为
(5)已知己是最强的无机酸,写出己的电离方程式
您最近一年使用:0次
2021-11-17更新
|
1156次组卷
|
4卷引用:辽宁省沈阳市五校协作体2021-2022学年高一上学期期中联考化学试题
名校
解题方法
5 . 下列说法正确的有
①在周期表中,同周期第ⅡA族和第ⅢA族元素质子数相差可能是1、11或25
②同主族元素从上至下,单质的氧化性逐渐减弱,熔点逐渐降低
③碱性:LiOH>NaOH>KOH>RbOH
④酸性:H2SO4>HClO4>HBrO4>HIO4
⑤卤族元素由上至下,阴离子的还原性增强,单质的颜色加深
⑥碱金属单质物理通性是硬度小,密度小,熔点低
⑦碱金属元素的原子半径和离子半径都随核电荷数的增大而增大
⑧可以利用非金属单质与H2反应的难易程度来证明其元素非金属性的强弱
①在周期表中,同周期第ⅡA族和第ⅢA族元素质子数相差可能是1、11或25
②同主族元素从上至下,单质的氧化性逐渐减弱,熔点逐渐降低
③碱性:LiOH>NaOH>KOH>RbOH
④酸性:H2SO4>HClO4>HBrO4>HIO4
⑤卤族元素由上至下,阴离子的还原性增强,单质的颜色加深
⑥碱金属单质物理通性是硬度小,密度小,熔点低
⑦碱金属元素的原子半径和离子半径都随核电荷数的增大而增大
⑧可以利用非金属单质与H2反应的难易程度来证明其元素非金属性的强弱
| A.4个 | B.5个 | C.6个 | D.7个 |
您最近一年使用:0次
2021-12-03更新
|
348次组卷
|
2卷引用:辽宁省辽河油田第一高级中学2020-2021学年高一上学期期末考试化学试题(A部)
名校
解题方法
6 . 下列关于元素周期表和元素周期律的说法不正确的是
| A.从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 |
| B.因为钠原子比铝原子容易失去电子,所以钠比铝的还原性强 |
| C.从氯到碘,生成的氢化物熔、沸点逐渐升高,稳定性逐渐增强 |
| D.氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的氧化性强 |
您最近一年使用:0次
7 . 下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式 回答,(5)~(8)小题按题目要求回答。
(1)表中元素,化学性质最不活泼的是_______ ,只有负价而无正价的是_______ ,氧化性最强的单质是_______ ,还原性最强的单质是_______ 。
(2)最高价氧化物的水化物碱性最强的是_______ ,酸性最强的是_______ ,呈两性的是_______ 。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的_______ 。
(4)在B、C、E、F、G、H中,原子半径最大的是_______ 。
(5)A和D组成化合物的电子式_______ 。
(6)用电子式表示B和H组成化合物的形成过程_______ 。
(7)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式_______
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的
(4)在B、C、E、F、G、H中,原子半径最大的是
(5)A和D组成化合物的电子式
(6)用电子式表示B和H组成化合物的形成过程
(7)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式
您最近一年使用:0次
解题方法
8 . 除第一周期外,关于同周期主族元素的下列变化规律的叙述中不正确的是
| A.从左到右,原子半径逐渐减小 |
| B.从左到右,元素原子的氧化性增强,还原性减弱 |
| C.从左到右,元素最高正价数从+1递增到+7,负价由-4递变到-1 |
| D.从左到右,元素最高价氧化物对应水化物碱性减弱,酸性增强 |
您最近一年使用:0次
2021-03-31更新
|
95次组卷
|
2卷引用:江西省赣州市潭口中学2020-2021学年高一下学期第一次月考化学试题
名校
9 . 下列结论正确的是
①原子半径:K>Cl>S ②氢化物稳定性:HF<H2S<PH3;
③离子还原性:S2->Cl-> Br->I- ④单质氧化性:Cl2>S>Si;
⑤酸性:H2SO4>HClO ⑥碱性强弱:KOH>NaOH>Mg(OH)2
①原子半径:K>Cl>S ②氢化物稳定性:HF<H2S<PH3;
③离子还原性:S2->Cl-> Br->I- ④单质氧化性:Cl2>S>Si;
⑤酸性:H2SO4>HClO ⑥碱性强弱:KOH>NaOH>Mg(OH)2
| A.①④⑤ | B.③⑥ | C.③⑤⑥ | D.④⑤⑥ |
您最近一年使用:0次
解题方法
10 . 下表是元素周期表中的一部分。
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是___________ ,氧化性最强的单质是___________ ,还原性最强的单质是___________ 。
(2)最高价氧化物对应的水化物中,碱性最强的是___________ ,酸性最强的是___________
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是___________ 。
(4)在B、C、D、G、I中,离子半径最大的是___________ 。
(5)元素C与I形成的化合物的电子式是___________ 。
(6)53号元素在元素周期表中的位置___________ 。
(7)D单质与B的最高价氧化物对应水化物反应的离子方程式___________
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | E | F | H | J | ||||
| 3 | B | C | D | G | I |
(1)化学性质最不活泼的元素是
(2)最高价氧化物对应的水化物中,碱性最强的是
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是
(4)在B、C、D、G、I中,离子半径最大的是
(5)元素C与I形成的化合物的电子式是
(6)53号元素在元素周期表中的位置
(7)D单质与B的最高价氧化物对应水化物反应的离子方程式
您最近一年使用:0次



