名校
1 . 回答下列问题:
(1)关于甲、乙、丙、丁四套装置的说法正确的是_______ 。

(2)以下物质(或粒子)与其用途之间关联正确的是_______ 。
(3)实验室制取Cl2的化学方程式:_______ 。浓盐酸表现的性质是_______ 。
(4)已知:在稀硫酸中,MnO 与H2O2也能发生以下反应:2KMnO4+3H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O。由上述反应得出物质氧化性强弱的结论是_______>_______(填化学式)。
与H2O2也能发生以下反应:2KMnO4+3H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O。由上述反应得出物质氧化性强弱的结论是_______>_______(填化学式)。_______
(1)关于甲、乙、丙、丁四套装置的说法正确的是

| A.用装置甲制取氯气 | B.用丙装置可以较长时间看到白色Fe(OH)2白色沉淀 |
| C.用丁装置证明碳酸氢钠受热易分解 | D.用装置乙除去氢气中的少量氯化氢 |
| A.硬铝——制导线 | B.14C——测定文物年代 |
| C.锗——作半导体材料 | D.Ti-Fe合金——作不锈钢材料 |
(4)已知:在稀硫酸中,MnO
 与H2O2也能发生以下反应:2KMnO4+3H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O。由上述反应得出物质氧化性强弱的结论是_______>_______(填化学式)。
与H2O2也能发生以下反应:2KMnO4+3H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O。由上述反应得出物质氧化性强弱的结论是_______>_______(填化学式)。
您最近一年使用:0次
2023-09-24更新
|
325次组卷
|
4卷引用:山西运城盐湖五中2023-2024学年高一上学期化学期末练兵卷(三)
山西运城盐湖五中2023-2024学年高一上学期化学期末练兵卷(三)天津市宁河区芦台第一中学2022-2023学年高一上学期期末考试化学试题(已下线)专题07 铁及其化合物 金属材料-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)(已下线)专项02 氧化还原反应的概念、规律及综合应用-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)
名校
2 . 有机物的性质与其所具有的官能团直接相关,辨析有机物的官能团,运用官能团的性质分析、理解有机物发生的反应是掌握有机物的金钥匙。某有机化合物A的结构简式为 ,回答下列问题:
,回答下列问题:
(1)A中含有的官能团名称分别有___________ ,下列反应中①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦还原,其中A可以发生的有___________ 填字母序号)
a.①②③④⑤⑥⑦ b.①③④⑤⑦ c.①③④⑤⑥⑦ d.②③④⑤⑥
(2)取一定量Na、NaOH、NaHCO3分别与等物质的量A充分反应,则消耗Na、NaOH、NaHCO3三种物质的物质的量之比为___________
(3)A与足量Na2CO3反应所得有机产物的结构简式是___________ 。
某种兴奋剂的结构简式如图所示,回答下列问题: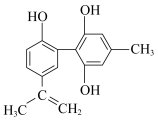
(4)该兴奋剂与FeCl3溶液混合,现象是___________ 。
(5)滴入KMnO4酸性溶液,振荡,紫色褪去,并不能证明其结构中含有碳碳双键,理由是______ ,下列证明其结构中含有碳碳双键的方法中,合理且简单易行的是_______ 。
A.加入浓溴水,溴水褪色
B.先加入足量NaOH溶液再加入浓溴水,溴水褪色
C.先加入足量NaOH溶液再加入酸性KMnO4溶液,溶液褪色
D.先滴加NaOH溶液到刚好反应,再加入溴水,溴水褪色
(6)1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为___________ mol和___________ mol。
(7)油脂在人体新陈代谢中发挥着重要的作用。有关油脂的说法错误的是___________。
 ,回答下列问题:
,回答下列问题:(1)A中含有的官能团名称分别有
a.①②③④⑤⑥⑦ b.①③④⑤⑦ c.①③④⑤⑥⑦ d.②③④⑤⑥
(2)取一定量Na、NaOH、NaHCO3分别与等物质的量A充分反应,则消耗Na、NaOH、NaHCO3三种物质的物质的量之比为
(3)A与足量Na2CO3反应所得有机产物的结构简式是
某种兴奋剂的结构简式如图所示,回答下列问题:

(4)该兴奋剂与FeCl3溶液混合,现象是
(5)滴入KMnO4酸性溶液,振荡,紫色褪去,并不能证明其结构中含有碳碳双键,理由是
A.加入浓溴水,溴水褪色
B.先加入足量NaOH溶液再加入浓溴水,溴水褪色
C.先加入足量NaOH溶液再加入酸性KMnO4溶液,溶液褪色
D.先滴加NaOH溶液到刚好反应,再加入溴水,溴水褪色
(6)1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为
(7)油脂在人体新陈代谢中发挥着重要的作用。有关油脂的说法错误的是___________。
| A.油脂的水解叫皂化反应。 |
| B.天然油脂大多为混甘油酯 |
| C.硬脂酸(C17H35COOH)甘油酯沸点比软脂酸甘油酯高 |
| D.油脂的主要成分是高级脂肪酸的甘油酯,属于酯类 |
您最近一年使用:0次
11-12高一下·山西临汾·期中
3 . 判断下列说法是否正确。
1.一个D2O分子所含的中子数为8。_______
2.HI、HBr、HCl、HF的稳定性依次增强。_______
3.同主族元素从上到下,单质的熔点逐渐降低。_______
4.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快。_______
5.从能量角度看,断开化学键要放热,形成化学键要吸热。一个化学反应是释放能量,还是吸收能量,取决于二者的相对大小。_______
6.将锌片和铜片用导线连接,并平行插入稀硫酸中,由于锌片是负极,所以溶液中的H+向负极迁移。_______
7.在二氧化硫与氧气的反应中,适当提高氧气浓度,可提高二氧化硫的转化率。_______
8.二氯甲烷没有同分异构体,证明甲烷分子具有正四面体结构。_______
9.用点燃或通入酸性高锰酸钾溶液中的方法均可以鉴别甲烷和乙烯。_______
10.苯不与酸性高锰酸钾溶液、溴水发生反应,证明苯不具有类似乙烯中的双键。_______
1.一个D2O分子所含的中子数为8。
2.HI、HBr、HCl、HF的稳定性依次增强。
3.同主族元素从上到下,单质的熔点逐渐降低。
4.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快。
5.从能量角度看,断开化学键要放热,形成化学键要吸热。一个化学反应是释放能量,还是吸收能量,取决于二者的相对大小。
6.将锌片和铜片用导线连接,并平行插入稀硫酸中,由于锌片是负极,所以溶液中的H+向负极迁移。
7.在二氧化硫与氧气的反应中,适当提高氧气浓度,可提高二氧化硫的转化率。
8.二氯甲烷没有同分异构体,证明甲烷分子具有正四面体结构。
9.用点燃或通入酸性高锰酸钾溶液中的方法均可以鉴别甲烷和乙烯。
10.苯不与酸性高锰酸钾溶液、溴水发生反应,证明苯不具有类似乙烯中的双键。
您最近一年使用:0次
4 . 食醋是生活中常见调味品,其中含有3%~5%的乙酸。已知:25℃时,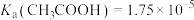 。请回答:
。请回答:
(1)乙酸在水中的电离方程式为___________ 。
(2)将 溶液稀释,配制
溶液稀释,配制 浓度约为
浓度约为 溶液,需要的仪器有玻璃棒、
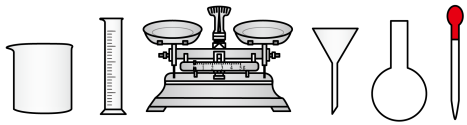
溶液,需要的仪器有玻璃棒、___________ (从下图中选择,写出名称)。
① 溶液的pH约为
溶液的pH约为___________ 。(已知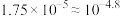 )
)
②用pH试纸测量 溶液的pH,方法是
溶液的pH,方法是___________ 。
(3)某小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是___________ 。
②根据表中数据,醋酸加水稀释过程中,醋酸的电离程度___________ (填“增大”“不变”或“减小”)。
③有同学提出也可以利用水解理论证明醋酸是弱电解质,请简述实验方案:________
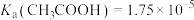 。请回答:
。请回答:(1)乙酸在水中的电离方程式为
(2)将
 溶液稀释,配制
溶液稀释,配制 浓度约为
浓度约为 溶液,需要的仪器有玻璃棒、
溶液,需要的仪器有玻璃棒、
①
 溶液的pH约为
溶液的pH约为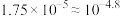 )
)②用pH试纸测量
 溶液的pH,方法是
溶液的pH,方法是(3)某小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度 | 0.0020 | 0.0100 | 0.0200 | 0.2000 |
pH | 3.73 | 3.38 | 3.23 | 2.73 |
②根据表中数据,醋酸加水稀释过程中,醋酸的电离程度
③有同学提出也可以利用水解理论证明醋酸是弱电解质,请简述实验方案:
您最近一年使用:0次
解题方法
5 . 高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为3ClO-+2Fe3++xOH-=2FeO +3Cl-+yH2O。
+3Cl-+yH2O。
(1)上述反应中的x =___________ ,y=___________ 。
(2)上述反应中氧化剂为___________ ;还原产物为___________ 。
(3)由上述反应可知,氧化性强弱:ClO-___________ (填“>”或“<”,下同)FeO ;还原性强弱:Cl-
;还原性强弱:Cl-___________ Fe3+。
(4)请用单线桥法表示该反应中电子的转移情况:___________ 。
(5)已知:Na2FeO4在处理饮用水的过程中铁元素会被转化为Fe3+,进而Fe3+在水中产生Fe(OH)3胶体,Fe(OH)3胶体具有吸附性。
①Na2FeO4在处理饮用水的过程中___________ (填“发生了”或“未发生”)氧化还原反应。
②Fe(OH)3胶体呈___________ 色,写出区分胶体与溶液的操作及现象:___________ 。
③已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的方法是___________ ,装置是下列中的___________ (填序号)。
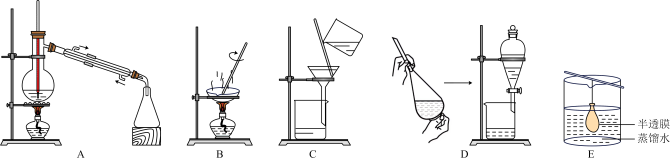
④现有10 mL明胶的水溶液与5mL Na2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明 能够透过半透膜
能够透过半透膜___________ 。
 +3Cl-+yH2O。
+3Cl-+yH2O。(1)上述反应中的x =
(2)上述反应中氧化剂为
(3)由上述反应可知,氧化性强弱:ClO-
 ;还原性强弱:Cl-
;还原性强弱:Cl-(4)请用单线桥法表示该反应中电子的转移情况:
(5)已知:Na2FeO4在处理饮用水的过程中铁元素会被转化为Fe3+,进而Fe3+在水中产生Fe(OH)3胶体,Fe(OH)3胶体具有吸附性。
①Na2FeO4在处理饮用水的过程中
②Fe(OH)3胶体呈
③已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的方法是

④现有10 mL明胶的水溶液与5mL Na2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明
 能够透过半透膜
能够透过半透膜
您最近一年使用:0次
6 . 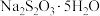 俗称“大苏打”,它是一种常用的试剂.
俗称“大苏打”,它是一种常用的试剂.
(1)工业上,常用 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 .写出离子方程式:
.写出离子方程式:__________________ .理论上,能发生的氧化还原反应都可以设计成原电池.如果将上述反应设计成原电池,则正极反应式为____________ .
(2)已知: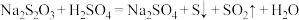
某小组设计实验探究影响化学反应速率的外界因素:
①
_________ ,设计实验I,Ⅱ的目的是_________ .
②实验测得: .由实验I、Ⅲ得出结论是
.由实验I、Ⅲ得出结论是________________ .
③根据表格信息,__________ (填“能”或“不能”)比较a和d的大小,原因是________ .
(3)已知: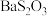 是白色难溶物.大苏打易变质生成
是白色难溶物.大苏打易变质生成 .设计实验证明某大苏打样品是否变质:
.设计实验证明某大苏打样品是否变质:__________________ .
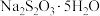 俗称“大苏打”,它是一种常用的试剂.
俗称“大苏打”,它是一种常用的试剂.(1)工业上,常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 .写出离子方程式:
.写出离子方程式:(2)已知:
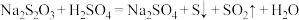
某小组设计实验探究影响化学反应速率的外界因素:
| 序号 | 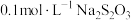 溶液 溶液 | 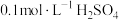 溶液 溶液 | 蒸馏水 | 温度 | 变浑浊时间 |
| I |  |  | 0 | 35℃ | a s |
| II |  | 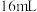 | V mL | 35℃ | b s |
| III |  |  | 0 | 45℃ | c s |
| IV |  |  | 5 mL | 40℃ | d s |

②实验测得:
 .由实验I、Ⅲ得出结论是
.由实验I、Ⅲ得出结论是③根据表格信息,
(3)已知:
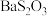 是白色难溶物.大苏打易变质生成
是白色难溶物.大苏打易变质生成 .设计实验证明某大苏打样品是否变质:
.设计实验证明某大苏打样品是否变质:
您最近一年使用:0次
7 . 为了探究同周期、同主族元素性质的递变规律,某小组同学设计并实施了如下实验,并在此基础上进行推测。
(1)①同学甲取一小段镁条,用砂纸打磨后,放到试管中,再加入2 mL水,滴入2滴酚酞溶液,加热试管,可以观察到的现象是_________________________ 。对比金属钠与水的反应,该同学由此得出实验结论为金属性:Na________ (填“大于”或“小于”)Mg。
②向两支试管分别加入 溶液和
溶液和 溶液,然后滴加氨水,直到不再产生白色沉淀为止。再分别将沉淀取出,分别装在两支试管中滴加2 mol/L NaOH溶液,边滴边振荡,观察到的现象是
溶液,然后滴加氨水,直到不再产生白色沉淀为止。再分别将沉淀取出,分别装在两支试管中滴加2 mol/L NaOH溶液,边滴边振荡,观察到的现象是__________________ ,写出该现象中发生反应的离子方程式:____________________ 。
(2)①同学乙在点滴板的3个孔穴中分别滴入3滴NaBr溶液、NaI溶液和水,然后向NaBr溶液和NaI溶液各滴入3滴新制的氯水(如图所示),能说明非金属性Cl大于Br的实验现象是_________________________ 。
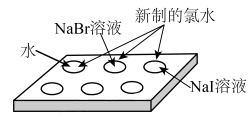
②写出少量新制氯水与NaI溶液反应的离子方程式:____________________ 。
③以上实验________ (填“能”或“不能”)证明氧化性: 。
。
(3)二硫化硒洗剂具有抗皮脂溢出作用,还具有一定的抗真菌作用。已知元素硒(Se)位于周期表第四周期,且与氧、硫位于同一主族。同学丙根据单质S在空气中燃烧生成 ,推测单质Se在空气中燃烧可生成
,推测单质Se在空气中燃烧可生成______ 。(填化学式)
(4)碳酸铯常温常压下为白色固体,极易溶于水,在空气中放置迅速吸湿,水溶液呈强碱性。已知元素铯(Cs)位于周期表中第六周期、第ⅠA族,碳酸铯的化学式是________ 。
(1)①同学甲取一小段镁条,用砂纸打磨后,放到试管中,再加入2 mL水,滴入2滴酚酞溶液,加热试管,可以观察到的现象是
②向两支试管分别加入
 溶液和
溶液和 溶液,然后滴加氨水,直到不再产生白色沉淀为止。再分别将沉淀取出,分别装在两支试管中滴加2 mol/L NaOH溶液,边滴边振荡,观察到的现象是
溶液,然后滴加氨水,直到不再产生白色沉淀为止。再分别将沉淀取出,分别装在两支试管中滴加2 mol/L NaOH溶液,边滴边振荡,观察到的现象是(2)①同学乙在点滴板的3个孔穴中分别滴入3滴NaBr溶液、NaI溶液和水,然后向NaBr溶液和NaI溶液各滴入3滴新制的氯水(如图所示),能说明非金属性Cl大于Br的实验现象是

②写出少量新制氯水与NaI溶液反应的离子方程式:
③以上实验
 。
。(3)二硫化硒洗剂具有抗皮脂溢出作用,还具有一定的抗真菌作用。已知元素硒(Se)位于周期表第四周期,且与氧、硫位于同一主族。同学丙根据单质S在空气中燃烧生成
 ,推测单质Se在空气中燃烧可生成
,推测单质Se在空气中燃烧可生成(4)碳酸铯常温常压下为白色固体,极易溶于水,在空气中放置迅速吸湿,水溶液呈强碱性。已知元素铯(Cs)位于周期表中第六周期、第ⅠA族,碳酸铯的化学式是
您最近一年使用:0次
8 . 铁及其化合物是重要的物质。回答下列问题:
(1)实验室可用稀盐酸除去铜粉中混有的铁粉,用离子方程式表示其原理:___________ 。
(2)在野外,可用铝热反应来焊接铁轨,其化学方程式为 ,该反应中还原剂为
,该反应中还原剂为___________ ,还原产物为___________ 。
(3)高铁酸钠( )是一种新型的绿色消毒剂,主要用于饮用水处理,其中一种制备方法如下,配平该离子方程式(仅填配平系数)。
)是一种新型的绿色消毒剂,主要用于饮用水处理,其中一种制备方法如下,配平该离子方程式(仅填配平系数)。________

(4)我国晋代《抱朴子》中描述了“以曾青涂铁,铁赤色如铜”,写出该反应的离子方程式:___________ 。
(5)现有甲、乙、丙三名同学分别进行 胶体的制备实验。
胶体的制备实验。
Ⅰ.甲同学向饱和氯化铁溶液中加入少量的NaOH溶液;
Ⅱ.乙同学直接加热饱和 溶液;
溶液;
Ⅲ.丙同学向25mL沸水中逐滴加入几滴 饱和溶液,继续煮沸至液体呈透明的红褐色,停止加热。
饱和溶液,继续煮沸至液体呈透明的红褐色,停止加热。
①其中操作正确的同学是___________ ,甲同学所做实验中发生的实验现象为___________ 。
②证明有 胶体生成的简单实验操作是
胶体生成的简单实验操作是___________ 。
③现有以下两种胶体: 胶体和
胶体和 胶体。已知
胶体。已知 胶粒能够净水,则
胶粒能够净水,则 胶粒(填“能”或“不能”)
胶粒(填“能”或“不能”)___________ 净水。
(1)实验室可用稀盐酸除去铜粉中混有的铁粉,用离子方程式表示其原理:
(2)在野外,可用铝热反应来焊接铁轨,其化学方程式为
 ,该反应中还原剂为
,该反应中还原剂为(3)高铁酸钠(
 )是一种新型的绿色消毒剂,主要用于饮用水处理,其中一种制备方法如下,配平该离子方程式(仅填配平系数)。
)是一种新型的绿色消毒剂,主要用于饮用水处理,其中一种制备方法如下,配平该离子方程式(仅填配平系数)。
(4)我国晋代《抱朴子》中描述了“以曾青涂铁,铁赤色如铜”,写出该反应的离子方程式:
(5)现有甲、乙、丙三名同学分别进行
 胶体的制备实验。
胶体的制备实验。Ⅰ.甲同学向饱和氯化铁溶液中加入少量的NaOH溶液;
Ⅱ.乙同学直接加热饱和
 溶液;
溶液;Ⅲ.丙同学向25mL沸水中逐滴加入几滴
 饱和溶液,继续煮沸至液体呈透明的红褐色,停止加热。
饱和溶液,继续煮沸至液体呈透明的红褐色,停止加热。①其中操作正确的同学是
②证明有
 胶体生成的简单实验操作是
胶体生成的简单实验操作是③现有以下两种胶体:
 胶体和
胶体和 胶体。已知
胶体。已知 胶粒能够净水,则
胶粒能够净水,则 胶粒(填“能”或“不能”)
胶粒(填“能”或“不能”)
您最近一年使用:0次
2023-10-13更新
|
127次组卷
|
2卷引用:山西省孝义市2023-2024学年高一上学期10月月考化学试题
9 . 分类法是常用的科学研究方法,通过对物质进行分类,我们可以更方便的认识物质变化的规律。
I.下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、N2O5、CuO
②H2CO3、H2S、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Ba(OH)2
(1)三种物质依次是(填化学式):
①______ ;②______ ;③______ 。
(2)N2O5和CO2都属于酸性氧化物,尝试写出N2O5与氢氧化钠溶液反应的离子方程式:_______ 。
II.下列物质中:①固体氯化钠;②CO2;③蔗糖晶体;④乙醇;⑤NaHSO4溶液;⑥CuSO4•5H2O;⑦盐酸;⑧Ba(OH)2溶液;⑨熔融氢氧化钠;⑩固体BaSO4。
(3)属于混合物的是_________ (填写相应序号,下同);属于电解质的是________ ;可以导电的是________ 。
III.胶体属于分散系的一种,制备Fe(OH)3胶体的操作方法如下,回答下列问题:
(4)制备Fe(OH)3胶体:向煮沸的蒸馏水中逐滴加入_______ ,继续煮沸至_______ ,停止加热,可制得Fe(OH)3胶体。
(5)如何用实验证明上述所制备的液体是胶体:________ 。
I.下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、N2O5、CuO
②H2CO3、H2S、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Ba(OH)2
(1)三种物质依次是(填化学式):
①
(2)N2O5和CO2都属于酸性氧化物,尝试写出N2O5与氢氧化钠溶液反应的离子方程式:
II.下列物质中:①固体氯化钠;②CO2;③蔗糖晶体;④乙醇;⑤NaHSO4溶液;⑥CuSO4•5H2O;⑦盐酸;⑧Ba(OH)2溶液;⑨熔融氢氧化钠;⑩固体BaSO4。
(3)属于混合物的是
III.胶体属于分散系的一种,制备Fe(OH)3胶体的操作方法如下,回答下列问题:
(4)制备Fe(OH)3胶体:向煮沸的蒸馏水中逐滴加入
(5)如何用实验证明上述所制备的液体是胶体:
您最近一年使用:0次
解题方法
10 . 化学小组同学通过实验探究某补铁药品中含亚铁盐,实验过程如下:
(1)甲同学取少量溶液,先加入2滴 溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为
溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为__________ 。
(2)乙同学也取少量溶液,滴加 溶液,有沉淀生成;将其露置于空气中可观察到的现象是
溶液,有沉淀生成;将其露置于空气中可观察到的现象是__________ ;产生该现象原因是__________ (用化学方程式解释)。
(3)丙同学取少量甲同学实验后的溶液,加入过量铁粉,溶液红色又消失。此实验能证明的是__________ 。
(1)甲同学取少量溶液,先加入2滴
 溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为
溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为(2)乙同学也取少量溶液,滴加
 溶液,有沉淀生成;将其露置于空气中可观察到的现象是
溶液,有沉淀生成;将其露置于空气中可观察到的现象是(3)丙同学取少量甲同学实验后的溶液,加入过量铁粉,溶液红色又消失。此实验能证明的是
您最近一年使用:0次