真题
名校
1 . 某同学设计实验确定Al(NO3)3·xH2O的结晶水数目。称取样品7.50g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06g;残留的固体产物是Al2O3,质量为1.02g。计算:
(1)x=_______ (写出计算过程)。
(2)气体产物中n(O2)_______ mol。
(1)x=
(2)气体产物中n(O2)
您最近一年使用:0次
2022-01-12更新
|
4647次组卷
|
7卷引用:微专题 化学计算的思想方法
(已下线)微专题 化学计算的思想方法2022 年1月浙江省普通高校招生选考科目考试化学试题(已下线)2022年浙江1月高考真题变式题(26-31)(已下线)微专题04 以物质的量为中心的计算-备战2023年高考化学一轮复习考点微专题河南省濮阳市第一高级中学2022-2023学年高三上学期第一次月考化学试题浙江省东阳市横店高级中学2022-2023学年高三上学期10月份检测化学试题(已下线)第03讲 物质的量在化学方程式计算中的应用(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
2020高三·全国·专题练习
解题方法
2 . CO2是一种廉价的碳资源,其综合利用具有重要意义,CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)  2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:
2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH=___________ 。
 2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:
2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
您最近一年使用:0次
2022-01-22更新
|
1524次组卷
|
16卷引用:二轮专题强化练 专题10 热化学方程式的书写与盖斯定律
(已下线)二轮专题强化练 专题10 热化学方程式的书写与盖斯定律(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)专题6.1 化学能与热能(练)——2020年高考化学一轮复习讲练测(已下线)专题6.1 化学能与热能(讲)——2020年高考化学一轮复习讲练测高中必刷题高二选择性必修1第一章 化学反应的热效应 第一章素养检测人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第一节 反应热 高考帮广西岑溪市第一中学2020-2021学年高二9月月考化学试题(已下线)第19讲 化学能与热能 (精讲)——2021年高考化学一轮复习讲练测(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)难点3 反应热的相关计算-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)
真题
名校
3 . 玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,发生如下反应:
3S+6KOH 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O
(x-1)S+K2S K2Sx(x=2~6)
K2Sx(x=2~6)
S+ K2SO3 K2S2O3
K2S2O3
请计算:
(1)0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V=______ 。
(2)2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=______ 。(写出计算过程)
3S+6KOH
 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O(x-1)S+K2S
 K2Sx(x=2~6)
K2Sx(x=2~6)S+ K2SO3
 K2S2O3
K2S2O3请计算:
(1)0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V=
(2)2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=
您最近一年使用:0次
2021-01-09更新
|
4134次组卷
|
13卷引用:浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试化学(学考)试题
浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试化学(学考)试题(已下线)专题03 阿伏加德罗常数与化学计算 -2023年高考化学真题题源解密(新高考专用)浙江省宁波市鄞州中学(宁波鄞州蓝青高级中学)2023-2024学年高一上学期12月月考化学学科试题2021年1月新高考浙江化学高考真题(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考向02 物质的量浓度及其相关计算-备战2022年高考化学一轮复习考点微专题(已下线)专题18.化学计算-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年1月浙江高考化学试题变式题26-31(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题(已下线)第03讲 物质的量在化学方程式计算中的应用(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
解题方法
4 . 某温度下,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:

(1)从开始至2min,X的平均反应速率为_______ 。
(2)2min后气体z的体积分数为_______ (保留两位有效数字)。
(3)该反应的化学方程式为_______ 。
(4)1min时,v正(X)_______ v逆(X),2min时,v正(Y)_______ v逆(Z)(填“>”或“<”或“=”)。
(5)上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(X)=9mol·L-1·min-1,乙中v(Y)=0.5mol·L-1·s-1,则_______ 中反应更快(用甲、乙回答问题)。
(6)在2min时向容器中通入氩气(容器体积不变),X的化学反应速率将_______ (填变大或不变或变小)。
(7)若X、Y、Z均为气体(容器体积不变),下列能说明反应已达平衡的是_______ 。
a.X、Y、Z三种气体的浓度相等
b.气体混合物平均相对分子质量不随时间变化
c.反应已经停止
d.反应速率v(X)︰v(Y)=3︰1
e.2v(X)正 = 3v(Z)逆
f.混合气体的密度不随时间变化

(1)从开始至2min,X的平均反应速率为
(2)2min后气体z的体积分数为
(3)该反应的化学方程式为
(4)1min时,v正(X)
(5)上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(X)=9mol·L-1·min-1,乙中v(Y)=0.5mol·L-1·s-1,则
(6)在2min时向容器中通入氩气(容器体积不变),X的化学反应速率将
(7)若X、Y、Z均为气体(容器体积不变),下列能说明反应已达平衡的是
a.X、Y、Z三种气体的浓度相等
b.气体混合物平均相对分子质量不随时间变化
c.反应已经停止
d.反应速率v(X)︰v(Y)=3︰1
e.2v(X)正 = 3v(Z)逆
f.混合气体的密度不随时间变化
您最近一年使用:0次
2022-11-02更新
|
1441次组卷
|
2卷引用:江西省南昌市铁路第一中学2022-2023学年高一下学期5月月考化学试题
真题
5 . 将3.00g某有机物(仅含C、H、O元素,相对分子质量为150)样品置于燃烧器中充分燃烧,依次通过吸水剂、CO2吸收剂,燃烧产物被完全吸收。实验数据如下表:
请回答:
(1)燃烧产物中水的物质的量为_______ mol。
(2)该有机物的分子式为_______ (写出计算过程)。
| 吸水剂 | CO2吸收剂 | |
| 实验前质量/g | 20.00 | 26.48 |
| 实验后质量/g | 21.08 | 30.00 |
(1)燃烧产物中水的物质的量为
(2)该有机物的分子式为
您最近一年使用:0次
2021-06-15更新
|
3633次组卷
|
13卷引用:第二章 物质的量化学实验基本技能 第8讲 化学计算的常用方法
第二章 物质的量化学实验基本技能 第8讲 化学计算的常用方法(已下线)【知识图鉴】单元讲练测选择性必修3第1单元02基础练(已下线)题型3 以物质的量为中心的相关计算(已下线)考点31 研究有机化合物的一般方法(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)2021年6月新高考浙江化学高考真题(已下线)考点27 饮食中的常见的有机物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题18.化学计算-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年6月浙江高考化学试题变式题26-31(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点31 研究有机物的一般方法-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题02 阿伏加德罗常数及其化学计算 (练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第03讲 物质的量在化学方程式计算中的应用(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
解题方法
6 . 将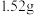 铜镁合金完全溶解于50mL8mol/L的浓硝酸中,得到NO和NO2的混合气体896mL(标准状况),向反应后的溶液中加入
铜镁合金完全溶解于50mL8mol/L的浓硝酸中,得到NO和NO2的混合气体896mL(标准状况),向反应后的溶液中加入 溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
(1)50mL8mol/L的浓硝酸中含有HNO3的物质的量为_______  。
。
(2)该合金含铜_______ g。
(3)混合气体中,NO和NO2的物质的量之比为_______ 。
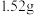 铜镁合金完全溶解于50mL8mol/L的浓硝酸中,得到NO和NO2的混合气体896mL(标准状况),向反应后的溶液中加入
铜镁合金完全溶解于50mL8mol/L的浓硝酸中,得到NO和NO2的混合气体896mL(标准状况),向反应后的溶液中加入 溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:(1)50mL8mol/L的浓硝酸中含有HNO3的物质的量为
 。
。(2)该合金含铜
(3)混合气体中,NO和NO2的物质的量之比为
您最近一年使用:0次
2023-09-15更新
|
990次组卷
|
2卷引用:浙江省绍兴市稽山中学2022-2023学年高一下学期期中检测化学试题
名校
解题方法
7 . 将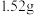 铜镁合金完全溶解于
铜镁合金完全溶解于 的浓硝酸中,得到
的浓硝酸中,得到 和
和 的混合气体
的混合气体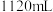 (标准状况),向反应后的溶液中加入
(标准状况),向反应后的溶液中加入 溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
(1) 的浓硝酸中含有
的浓硝酸中含有 的物质的量为
的物质的量为_______  。
。
(2)该合金含铜_______ g。
(3)混合气体中, 和
和 的物质的量之比为
的物质的量之比为_______ 。
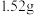 铜镁合金完全溶解于
铜镁合金完全溶解于 的浓硝酸中,得到
的浓硝酸中,得到 和
和 的混合气体
的混合气体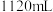 (标准状况),向反应后的溶液中加入
(标准状况),向反应后的溶液中加入 溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:(1)
 的浓硝酸中含有
的浓硝酸中含有 的物质的量为
的物质的量为 。
。(2)该合金含铜
(3)混合气体中,
 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2022-06-24更新
|
1678次组卷
|
3卷引用:江西省南昌市第二中学2022-2023学年高一下学期5月月考化学试题
8 . 向27.2gCu和Cu2O的固体混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成4.48LNO(标准状况)和Cu(NO3)2,在所得溶液中加入1.0mol•L-1的NaOH溶液1.0L,此时溶液中的溶质为NaNO3,铜离子已完全沉淀,沉淀质量为39.2g。(提示:Cu2O稀硝酸反应的方程式为:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O)
(1)在上述Cu2O与硝酸的反应中,硝酸表现出的性质有______ 。
(2)计算原固体混合物Cu2O中Cu与的物质的量之比_____ 。
(3)计算原硝酸溶液的物质的量浓度_____ 。
(1)在上述Cu2O与硝酸的反应中,硝酸表现出的性质有
(2)计算原固体混合物Cu2O中Cu与的物质的量之比
(3)计算原硝酸溶液的物质的量浓度
您最近一年使用:0次
2023-05-05更新
|
796次组卷
|
3卷引用:浙江省长河中学2022-2023学年高一下学期期中考试化学试题
浙江省长河中学2022-2023学年高一下学期期中考试化学试题 (已下线)【2023】【高一下】【期中考】【长河】【高中化学】【刘尼尼收集】山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题
解题方法
9 . 300°C时,向2 L的恒容密闭容器中,充入2 mol CO2(g)和2 mol H2(g)使之发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得各物质的物质的量浓度变化如图所示:
CH3OH(g)+H2O(g),测得各物质的物质的量浓度变化如图所示:
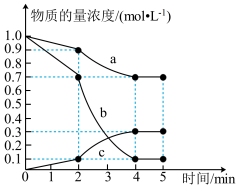
(1)由图可知,CO2(g)的浓度随时间的变化为曲线___________ (填“a”“b”或“c”);0~2 min内的平均反应速率v(CO2 )为___________ 。
(2)已知:反应至2 min时,改变了某一反应条件。由图可知,0~2 min内CH3OH(g)的生成速率___ (填“大于”“小于”或“等于”)2~4 min内CH3OH(g) 的生成速率。
(3)5 min时,CO2(g)的转化率(反应时消耗CO2的物质的量占起始投入CO2的物质的量的百分比)为___________ ,此时容器内气体总压强与反应前容器内气体总压强之比为___ 。
 CH3OH(g)+H2O(g),测得各物质的物质的量浓度变化如图所示:
CH3OH(g)+H2O(g),测得各物质的物质的量浓度变化如图所示:
(1)由图可知,CO2(g)的浓度随时间的变化为曲线
(2)已知:反应至2 min时,改变了某一反应条件。由图可知,0~2 min内CH3OH(g)的生成速率
(3)5 min时,CO2(g)的转化率(反应时消耗CO2的物质的量占起始投入CO2的物质的量的百分比)为
您最近一年使用:0次
2020·浙江·模拟预测
真题
10 . 为测定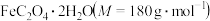 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用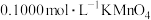 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:
已知: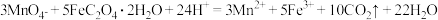
假设杂质不参加反应。
该样品中 的质量分数是
的质量分数是________ %(保留小数点后一位);
写出简要计算过程:________ 。
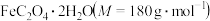 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用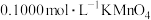 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:| 序号 | 滴定前读数/mL | 滴定终点读数/mL |
| 1 | 0.00 | 19.98 |
| 2 | 1.26 | 22.40 |
| 3 | 1.54 | 21.56 |
已知:
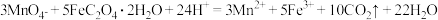
假设杂质不参加反应。
该样品中
 的质量分数是
的质量分数是写出简要计算过程:
您最近一年使用:0次
2020-01-10更新
|
3701次组卷
|
17卷引用:题型43 氧化还原滴定——高锰酸钾法
(已下线)题型43 氧化还原滴定——高锰酸钾法(已下线)题型41 氧化还原滴定——高锰酸钾法(已下线)浙江省2020年1月选考(学考)化学试题2020年浙江省高考化学试卷(1月选考)专题5.3 化学计算(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题18.化学计算-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)专题13 化学实验-备战2022年高考化学学霸纠错(全国通用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题2 样品纯度专练(已下线)考点52 定量分析-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第03讲 物质的量在化学方程式计算中的应用(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)



