名校
1 . 根据要求回答问题:
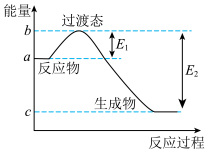
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,活化能E1的变化是_____ (填“增大”“减小”或“不变”,下同),ΔH的变化是_____ 。图中最稳定的是_____ (填“反应物”“过渡态”或“生成物”)。
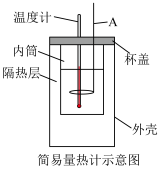
(2)50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热(设溶液的密度均为1g•cm-3,反应后溶液的比热容c=4.18J•g-1•℃-1)。回答下列问题:
从实验装置上看,图中仪器A的名称是_____ ,隔热层的作用是_____ 。根据表中数据,结合题干信息,请写出生成1molH2O的热化学方程式_____ (保留3位有效数字)。
(3)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的1.2~2.0万倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
写出N2(g)与F2(g)反应合成NF3(g)的热化学方程式_____ 。
(4)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。这两步反应的能量变化如图:
。这两步反应的能量变化如图:
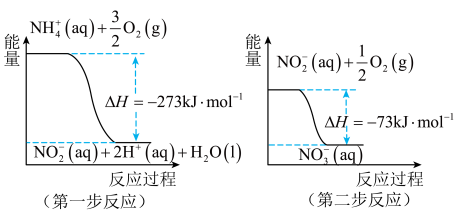
第二步反应是_____ (填“放热”或“吸热”)反应。1molNH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_____ 。
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,活化能E1的变化是

(2)50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热(设溶液的密度均为1g•cm-3,反应后溶液的比热容c=4.18J•g-1•℃-1)。回答下列问题:
 | 实验次数 | 反应物的温度/℃ | 反应前体系的温度 | 反应后体系的温度 | 温度差 | |
| 盐酸 | NaOH溶液 | t1/℃ | t2/℃ | (t2-t1)/℃ | ||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 | |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 | |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 | |
(3)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的1.2~2.0万倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
| 化学键 | N≡N | F-F | N-F |
| 键能/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
(4)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。这两步反应的能量变化如图:
。这两步反应的能量变化如图:
第二步反应是
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是
您最近一年使用:0次
名校
解题方法
2 . 将CO2与H2反应转化为甲醇(CH3OH)是变废为宝的好方法,其原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。
CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。

(1)在0~3min内用CO2表示该反应的速率是_____ 。(保留2位有效数字)。该反应达到最大限度时H2的转化率_____ ,此时CH3OH在平衡混合物中的体积分数为_____ (均用百分数表示,且保留3位有效数字)。
(2)10min后,反应处于化学平衡状态,下列说法中能作为该反应处于平衡状态的依据的是_____ 。
a.3v正(H2)=v逆(CO2)
b.混合气体的密度不再发生变化
c.混合气体的平均相对分子质量不再发生改变
d.体系的温度不再发生改变
e.混合气体的颜色不再发生改变
f.CO2与H2的物质的量之比不再发生改变
g.甲醇的质量分数不再发生改变
h.体系压强不再发生改变
(3)若上述反应在甲、乙、丙三个相同容器内同时进行,测得甲中v(CO2)=0.1mol•L-1•min-1,乙中v(H2)=0.2mol•L-1•min-1,丙中v(CH3OH)=0.3mol•L-1•s-1,则反应速率最快的是_____ 。
(4)甲醇(CH3OH)是一种有毒物质,常温下检测甲醇含量的测试仪工作原理示意图如图:
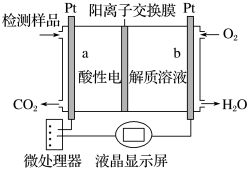
a电极发生的电极反应式为_____ 。
 CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。
CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。
(1)在0~3min内用CO2表示该反应的速率是
(2)10min后,反应处于化学平衡状态,下列说法中能作为该反应处于平衡状态的依据的是
a.3v正(H2)=v逆(CO2)
b.混合气体的密度不再发生变化
c.混合气体的平均相对分子质量不再发生改变
d.体系的温度不再发生改变
e.混合气体的颜色不再发生改变
f.CO2与H2的物质的量之比不再发生改变
g.甲醇的质量分数不再发生改变
h.体系压强不再发生改变
(3)若上述反应在甲、乙、丙三个相同容器内同时进行,测得甲中v(CO2)=0.1mol•L-1•min-1,乙中v(H2)=0.2mol•L-1•min-1,丙中v(CH3OH)=0.3mol•L-1•s-1,则反应速率最快的是
(4)甲醇(CH3OH)是一种有毒物质,常温下检测甲醇含量的测试仪工作原理示意图如图:

a电极发生的电极反应式为
您最近一年使用:0次
2023-05-06更新
|
247次组卷
|
2卷引用:湖北省巴东县第一高级中学2020-2021学年高一下学期第四次月考化学试题
名校
3 . 下列操作不能达到目的的是
| A.欲除去乙烷中混有的少量乙烯气体,可将混合气体通入盛装酸性KMnO4溶液的洗气瓶 |
| B.欲除去乙酸乙酯中的乙醇及乙酸,可将混合物加入到饱和碳酸钠溶液中并分液 |
| C.欲检验淀粉的水解产物是否具有还原性,取少量水解液于试管中,加入NaOH溶液至呈碱性,再向其中加入新制的银氨溶液并水浴加热,观察是否有银镜产生 |
| D.欲探究温度对反应速率的影响,取两只试管各加入5mL0.1mol•L-1Na2S2O3,另取两只试管各加入5mL0.1mol•L-1H2SO4溶液,将4只试管分成两组,一组放入热水中,另一组放入冷水中,经过一段时间,分别混合并搅拌,记录溶液出现浑浊的时间 |
您最近一年使用:0次
2023-05-06更新
|
684次组卷
|
2卷引用:湖北省巴东县第一高级中学2020-2021学年高一下学期第四次月考化学试题
4 . 下列说法错误的是
| A.天然橡胶的主要成分是聚异戊二烯,其不能发生加聚反应 |
| B.蛋白质在强酸、强碱、加热、紫外线等的作用下会发生变性,并失去生理活性 |
| C.聚甲基丙烯酸甲酯俗称有机玻璃,可制成挡风玻璃、光学仪器、医疗器械等 |
| D.氢化植物油性质稳定,可用来生产人造奶、代可可脂等食品工业原料 |
您最近一年使用:0次
2023-05-06更新
|
544次组卷
|
2卷引用:湖北省巴东县第一高级中学2020-2021学年高一下学期第四次月考化学试题
名校
5 . 化学与生活密切相关。下列说法错误的是
| A.煤的干馏产品中有出炉煤气、煤焦油、焦炭等产品 |
| B.绿色化学中最理想的原子经济性反应是反应中原子利用率达到100% |
| C.食品添加剂包含着色剂、增味剂、防腐剂、抗氧化剂、营养强化剂等 |
| D.通过石油的催化重整可以得到乙烯、丙烯、甲烷等重要基本化工原料 |
您最近一年使用:0次
名校
6 . 氧化还原反应和离子反应在化工生产中有重要应用。请运用所学知识回答下列问题:
(1)氰化钠(NaCN)有剧毒,废水中一旦有氰化钠要立即处理。下列物质可以处理氰化钠的是_______(填写序号)。
(2)煤燃烧产生的二氧化硫是大气污染物,常用石灰浆处理,写出反应的化学方程式_______ 。
(3)工业上,可以用钾、钙、镁等金属与二氧化铀反应制得铀单质。若制得等质量的铀单质,钾、钙、镁三种金属中,消耗质量最多的金属是_______ 。
(4)在一定条件下向废水中加入甲醇(CH3OH被氧化为CO2)能实现硝酸转化为氮气,写出反应的化学方程式_______ ,当有1个硝酸完全转化时,转移的电子数是_______ 。
(5)碳捕集技术是减少二氧化碳排放的一种途径,其基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后生成碳酸盐和碳酸氢盐的物质的量比为1:1,反应的离子方程式是_______ 。
(1)氰化钠(NaCN)有剧毒,废水中一旦有氰化钠要立即处理。下列物质可以处理氰化钠的是_______(填写序号)。
| A.铁粉 | B.过氧化氢溶液 | C.氢氧化钠溶液 | D.次氯酸钠溶液 |
(3)工业上,可以用钾、钙、镁等金属与二氧化铀反应制得铀单质。若制得等质量的铀单质,钾、钙、镁三种金属中,消耗质量最多的金属是
(4)在一定条件下向废水中加入甲醇(CH3OH被氧化为CO2)能实现硝酸转化为氮气,写出反应的化学方程式
(5)碳捕集技术是减少二氧化碳排放的一种途径,其基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后生成碳酸盐和碳酸氢盐的物质的量比为1:1,反应的离子方程式是
您最近一年使用:0次
名校
解题方法
7 . 根据题目填写内容
(1)下列物质:①纯H2SO4②硝酸钾溶液③铜④二氧化碳⑤Ba(OH)2固体⑥KHSO4固体⑦蔗糖⑧熔融KCl⑨氨水
能导电的是___________ (填序号,下同),属于电解质的是___________ ,属于非电解质的是_______ 。
检验②中金属阳离子的实验方法是______________________________ (填实验操作的名称)。
(2)Fe(OH)3是难溶于水的固体,那么分离Fe(OH)3与水的悬浊液常用的方法是_____________ 。
Fe(OH)3胶体呈红褐色,具有良好的净水效果。由饱和FeCl3溶液制备Fe(OH)3胶体的方法是_____________ 。
(3)酸性条件下,高锰酸钾可与草酸(H2C2O4)溶液发生反应,其反应如下,补上产物,配平化学方程式,并用单线桥法标出电子转移的方向和数目_____________ 。
____KMnO4+____H2C2O4+____H2SO4→____K2SO4+____MnSO4+____CO2+________
(4)①0.5mol C2H6O的质量是____ 克,含____ 个C2H6O分子,含____ mol氢原子,与____ g H2O分子中的氢的原子数目相同。
②在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为____ 。
③有K2SO4和Al2(SO)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol·L-1, 的物质的量浓度为0.7 mol·L-1,,则此溶液中K+的物质的量浓度为
的物质的量浓度为0.7 mol·L-1,,则此溶液中K+的物质的量浓度为____ 。
(1)下列物质:①纯H2SO4②硝酸钾溶液③铜④二氧化碳⑤Ba(OH)2固体⑥KHSO4固体⑦蔗糖⑧熔融KCl⑨氨水
能导电的是
检验②中金属阳离子的实验方法是
(2)Fe(OH)3是难溶于水的固体,那么分离Fe(OH)3与水的悬浊液常用的方法是
Fe(OH)3胶体呈红褐色,具有良好的净水效果。由饱和FeCl3溶液制备Fe(OH)3胶体的方法是
(3)酸性条件下,高锰酸钾可与草酸(H2C2O4)溶液发生反应,其反应如下,补上产物,配平化学方程式,并用单线桥法标出电子转移的方向和数目
____KMnO4+____H2C2O4+____H2SO4→____K2SO4+____MnSO4+____CO2+________
(4)①0.5mol C2H6O的质量是
②在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为
③有K2SO4和Al2(SO)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol·L-1,
 的物质的量浓度为0.7 mol·L-1,,则此溶液中K+的物质的量浓度为
的物质的量浓度为0.7 mol·L-1,,则此溶液中K+的物质的量浓度为
您最近一年使用:0次
名校
解题方法
8 . 下列关于氯单质及其化合物的相关说法正确的是
| A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾 |
| B.将NaHCO3固体加入新制氯水,因为氯水中的HClO而有无色气泡产生 |
| C.Fe与Cl2在点燃条件下反应,如果铁粉过量,可能生成FeCl2 |
| D.氯气有毒,如果发生了氯气泄漏,用蘸有纯碱水的毛巾捂住口鼻撤离 |
您最近一年使用:0次
名校
解题方法
9 . 胶体是分散系的一种。下列关于胶体的说法正确的是
| A.胶体:本质是可以产生丁达尔效应的分散系 |
| B.“血液透析”和“静电除尘”利用了胶体相同的性质 |
| C.向Fe(OH)3胶体中加入盐酸至过量,最终出现红褐色Fe(OH)3沉淀 |
| D.不同品牌的墨水不能混用,与胶体聚沉有关 |
您最近一年使用:0次
解题方法
10 . 在“海带提碘”实验中,通常以四氯化碳为萃取剂对生成的碘单质进行萃取、富集。那么,如何使碘单质从碘的四氯化碳溶液中提取出来呢?某小组查阅资料表明:可采用反萃取法(将富集在四氯化碳中的碘单质利用化学转化法重新富集在水中)。具体步骤如下:

(1)反萃取的第一步在_______ (填仪器名称)中进行,加入浓NaOH溶液后振荡并及时放气,判断碘元素由有机层完全进入水层的现象是_______ ,该步骤发生的离子反应为:_______ 。
(2)将含碘元素的水层从仪器的_______ (填“上”或“下”)口倒入烧杯中,加入45%的H2SO4溶液发生的离子反应为:_______ 。
(3)获得碘单质的传统方法为蒸馏法,已知:I2的沸点184℃,45℃左右就开始缓慢升华,CCl4沸点77℃,则蒸馏时宜采用_______ 加热(填加热方式),反萃取法较蒸馏法的优点为:_______ (答出一条即可)。

(1)反萃取的第一步在
(2)将含碘元素的水层从仪器的
(3)获得碘单质的传统方法为蒸馏法,已知:I2的沸点184℃,45℃左右就开始缓慢升华,CCl4沸点77℃,则蒸馏时宜采用
您最近一年使用:0次



