解题方法
1 . 含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式:_____ 。
(2)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面_________ ,则发生了钝化;若铁棒表面________ ,则未发生反应。
(3)Na2SO3吸收法是治理SO2污染的一种方法,其原理为(用化学方程式表示)________ 。
(4)为了减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式:______________________ 。
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式:
(2)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面
(3)Na2SO3吸收法是治理SO2污染的一种方法,其原理为(用化学方程式表示)
(4)为了减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式:
您最近一年使用:0次
2 . 薰衣草醇的分子结构如图所示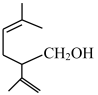 ,下列有关薰衣草醇的说法不正确的是
,下列有关薰衣草醇的说法不正确的是
| A.分子式为C10H20O | B.含有羟基官能团 |
| C.不能使酸性高锰酸钾溶液褪色 | D.能被O2氧化为醛 |
您最近一年使用:0次
名校
3 . 某有机物的结构简式如图所示,下列有关该有机物的说法正确的是
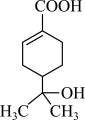
| A.该有机物可以发生取代、加成、氧化、水解反应 |
| B.与钠和氢氧化钠溶液都能发生反应,且得到的有机产物相同 |
| C.分子中含有两种官能团 |
| D.该有机物的分子式为C10H16O3 |
您最近一年使用:0次
2023-12-20更新
|
499次组卷
|
4卷引用:阶段重点练(六)
解题方法
4 . 完成下列问题。
(1)中科院的科研人员在Na−Fe3O4和HMCM−22的表面将CO2转化为烷烃,其过程如图。
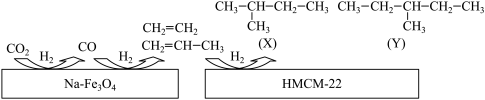
①Na−Fe3O4和HMCM−22在反应中的作用为________ 。
②写出X的所有同分异构体的结构简式________ 。
③关于X和Y的说法正确的是________ (填字母)。
A.最简式相同 B.都有4种一氯代物
C.都易使酸性KMnO4溶液褪色 D.X和Y互称同分异构体
(2)“立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示。

①“立方烷”的分子式是___________ ;“立方烷”有多种同分异构体,其中一种属于芳香烃的同分异构体的结构简式是___________ 。
②“立方烷”的二氯代物具有同分异构体的数目是___________ 。“立方烷”的三氯代物具有同分异构体的数目是___________ 。
(1)中科院的科研人员在Na−Fe3O4和HMCM−22的表面将CO2转化为烷烃,其过程如图。

①Na−Fe3O4和HMCM−22在反应中的作用为
②写出X的所有同分异构体的结构简式
③关于X和Y的说法正确的是
A.最简式相同 B.都有4种一氯代物
C.都易使酸性KMnO4溶液褪色 D.X和Y互称同分异构体
(2)“立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示。

①“立方烷”的分子式是
②“立方烷”的二氯代物具有同分异构体的数目是
您最近一年使用:0次
5 . 下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是
| 选项 | 金属(粉末状) | 酸的浓度 | 体积 | 反应温度 |
| A | 0.1molMg | 6mol·L-1硝酸 | 10mL | 60℃ |
| B | 0.1molMg | 3mol·L-1盐酸 | 10mL | 60℃ |
| C | 0.1molFe | 3mol·L-1盐酸 | 10mL | 60℃ |
| D | 0.1molMg | 3mol·L-1硫酸 | 10mL | 60℃ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
6 . 32.5 g的锌与50 mL 18.4 mol/L浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体V L。将反应后的溶液稀释到500 mL,测得溶液中氢离子的浓度为0.08 mol/L。则下列说法中不正确的是
| A.反应中转移电子的物质的量为1 mol |
| B.V=11.2 |
| C.生成的气体中H2的物质的量为0.4 mol |
| D.生成的气体中SO2与H2的物质的量之比为1:4 |
您最近一年使用:0次
7 . 某亚硫酸钠试剂已部分被氧化。为确定它的纯度,要进行如下实验:①称取样品W1 g;②将样品溶解;③给溶液加入稍过量的盐酸酸化的BaCl2溶液;④过滤、洗涤、干燥沉淀,称其质量为W2 g。
(1)BaCl2要用盐酸酸化的原因是___________ 。
(2)BaCl2溶液要稍过量的原因是___________ 。
(3)判断操作③是否完成的方法是___________ 。
(4)判断沉淀是否洗净的方法是___________ 。
(5)列式计算Na2SO3的纯度___________ 。
(1)BaCl2要用盐酸酸化的原因是
(2)BaCl2溶液要稍过量的原因是
(3)判断操作③是否完成的方法是
(4)判断沉淀是否洗净的方法是
(5)列式计算Na2SO3的纯度
您最近一年使用:0次
8 . Ⅰ.某化学小组欲进行如下的实验探究金属与浓硫酸反应。试回答下列问题:
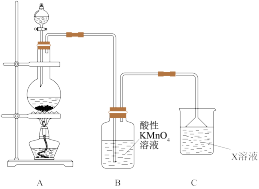
(1)利用上图装置研究铜与浓硫酸反应,反应的化学方程式为___________ 。C装置的作用___________ 。
(2)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是___________ 。在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为___________ 。
(3)验证该气体的实验方案如下:
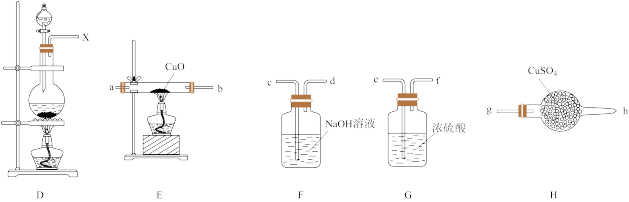
①装置连接顺序:________
X→___________→___________→___________→___________→a→b→___________。
②能证明上述假设成立的实验现象是___________ 。
③某学习小组经过讨论认为该实验方案还不够严谨,你认为是否合理,若合理,则不作答,若不合理,请指出不严谨之处___________ 。

(1)利用上图装置研究铜与浓硫酸反应,反应的化学方程式为
(2)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是
(3)验证该气体的实验方案如下:

①装置连接顺序:
X→___________→___________→___________→___________→a→b→___________。
②能证明上述假设成立的实验现象是
③某学习小组经过讨论认为该实验方案还不够严谨,你认为是否合理,若合理,则不作答,若不合理,请指出不严谨之处
您最近一年使用:0次
9 . 一定条件下,将2molA气体和2molB气体加入2L的恒容密闭容器中进行反应:2A(g)+B(g)⇌2C(g)。2min后达化学平衡,测得C的浓度为0.8mol·L-1,填写下列空白:
(1)2min内用A表示的平均反应速率为___________ 。
(2)平衡时B的物质的量浓度为___________ 。
(3)平衡时A的转化率是B的转化率的___________ 倍。
(4)能说明该反应达到化学平衡状态的是:___________。
(5)要使该反应的化学反应速率加快,可采取的措施是:___________ (任写两种)。
(1)2min内用A表示的平均反应速率为
(2)平衡时B的物质的量浓度为
(3)平衡时A的转化率是B的转化率的
(4)能说明该反应达到化学平衡状态的是:___________。
| A.A表示的平均反应速率等于C表示的平均反应速率 |
| B.消耗1molA的同时生成0.5molB |
| C.分别用A、B、C表示的反应速率之比为2∶1∶2 |
| D.C的物质的量不再变化 |
您最近一年使用:0次
10 . 在密闭容器中加入2.0molSO2和1.0molO2,一定条件下发生如下反应:2SO2+O2 2SO3。反应达到平衡后,各物质的物质的量可能为
2SO3。反应达到平衡后,各物质的物质的量可能为
 2SO3。反应达到平衡后,各物质的物质的量可能为
2SO3。反应达到平衡后,各物质的物质的量可能为| 选项 | n(SO2)/mol | n(O2)/mol | n(SO3)/mol |
| A | 2.0 | 1.0 | 0 |
| B | 1.0 | 0.5 | 1.0 |
| C | 0.20 | 0.10 | 1.80 |
| D | 0 | 0 | 2.0 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



