真题
1 . 25℃下, 水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
 水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是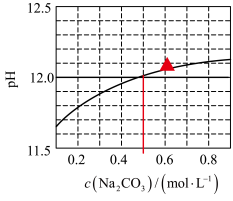
A. 时,溶液中 时,溶液中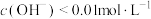 |
B. 水解程度随其浓度增大而减小 水解程度随其浓度增大而减小 |
C.在水中 的 的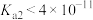 |
D. 的 的 溶液和 溶液和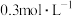 的 的 溶液等体积混合,得到的溶液 溶液等体积混合,得到的溶液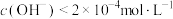 |
您最近一年使用:0次
2023-08-03更新
|
4583次组卷
|
6卷引用:实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
(已下线)实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)2023年高考海南卷化学真题(已下线)不定项选择题(已下线)第31讲盐类的水解(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)【精品卷】3.3.1 盐类的水解课堂例题-人教版2023-2024学年选择性必修1
2 . 2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
(1)在一定温度下,向体积固定的密闭容器中加入足量的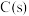 和
和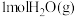 ,起始压强为
,起始压强为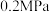 时,发生下列反应生成水煤气:
时,发生下列反应生成水煤气:
Ⅰ.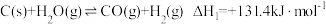
Ⅱ.
①下列说法正确的是_______ ;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为
的转化率为 ,CO的物质的量为
,CO的物质的量为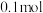 。此时,整个体系
。此时,整个体系_______ (填“吸收”或“放出”)热量_______ kJ,反应Ⅰ的平衡常数
_______ (以分压表示,分压=总压×物质的量分数)。
(2)一种脱除和利用水煤气中 方法的示意图如下:
方法的示意图如下:
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的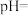
_______ (该温度下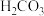 的
的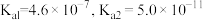 );
);
②再生塔中产生 的离子方程式为
的离子方程式为_______ ;
③利用电化学原理,将 电催化还原为
电催化还原为 ,阴极反应式为
,阴极反应式为_______ 。
(1)在一定温度下,向体积固定的密闭容器中加入足量的
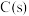 和
和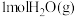 ,起始压强为
,起始压强为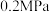 时,发生下列反应生成水煤气:
时,发生下列反应生成水煤气:Ⅰ.
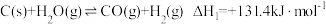
Ⅱ.

①下列说法正确的是
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时
 的体积分数可能大于
的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时,
 的转化率为
的转化率为 ,CO的物质的量为
,CO的物质的量为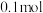 。此时,整个体系
。此时,整个体系
(2)一种脱除和利用水煤气中
 方法的示意图如下:
方法的示意图如下: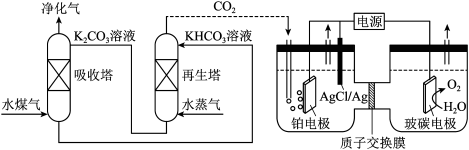
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的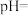
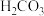 的
的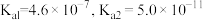 );
);②再生塔中产生
 的离子方程式为
的离子方程式为③利用电化学原理,将
 电催化还原为
电催化还原为 ,阴极反应式为
,阴极反应式为
您最近一年使用:0次
2022-06-10更新
|
11449次组卷
|
21卷引用:模块综合检测卷2
模块综合检测卷2安徽省六安第一中学2022-2023学年高二上学期期末考试化学试题山东省潍坊市昌乐第一中学2022-2023学年高二上学期期末拉练二化学试题(已下线)回归教材重难点08 聚焦热、速率、平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)第20练 化学反应原理综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)2022年新高考湖南化学高考真题(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)专题14 化学反应原理综合题-2022年高考真题模拟题分项汇编(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题18 化学反应原理综合题-备战2023年高考化学母题题源解密(广东卷)广东省汕头市金山中学2022-2023学年高三上学期第二次月考化学试题山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题广东省佛山市顺德区第一中学2023届高三上学期12月综合训练化学试题四川省眉山市彭山区第一中学2023-2024学年高三上学期11月月考理综试题 河南省南阳市第一中学校2024届高三上学期阶段检测化学试题(12月)湖南省浏阳景雅高级中学2024届高三下学期5月全真仿真模拟考试化学试题
名校
3 .  时,
时, 的电离常数:
的电离常数: ,
,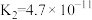 ,下列说法中正确的是
,下列说法中正确的是
 时,
时, 的电离常数:
的电离常数: ,
,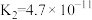 ,下列说法中正确的是
,下列说法中正确的是A.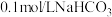 溶液中: 溶液中: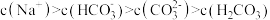 |
B.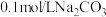 溶液中: 溶液中: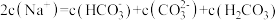 |
C. 和 和 混合液中: 混合液中: |
D.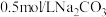 溶液与 溶液与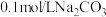 溶液中 溶液中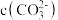 之比小于5 之比小于5 |
您最近一年使用:0次
2022-01-18更新
|
1039次组卷
|
3卷引用:作业(十九) 溶液中粒子浓度的大小比较
名校
解题方法
4 . 某烃的结构简式为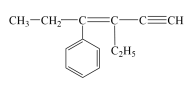 ,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )
,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )
 ,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )
,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )| A.3、4、5 | B.3、10、4 |
| C.3、14、4 | D.4、10、4 |
您最近一年使用:0次
2020-05-14更新
|
6335次组卷
|
40卷引用:烃——课时7烃的燃烧与共面
(已下线)烃——课时7烃的燃烧与共面有机物分子中原子共线共面问题和芳香烃的同分异构专题-【百强校】河南省洛阳市第一高级中学高三化学复习练习高二选择性必修3(人教版2019)第二章 烃 专题2 有机化合物共线 共面问题的判断河南省安阳市第一中学2023届高三第四次全真模拟化学试题第二章 烃(A卷·知识通关练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修3)山西省晋城市第一中学校2022-2023学年高二下学期5月月考化学试题湖北省武汉外国语学校2022-2023学年高一下学期期末考试化学试题湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题2016-2017学年内蒙古赤峰二中高二上月考二化学卷【全国百强校】陕西省西安市长安区第一中学2017-2018学年高一下学期期末考试(理)化学试题广西壮族自治区贵港市覃塘高级中学2018-2019学年高二上学期9月月考化学试题【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二上学期第二次月考化学试题【全国百强校】江西省南昌市第十中学2018-2019学年高二下学期3月月考化学试题(已下线)2019年6月8日 《每日一题》选修5-周末培优内蒙古呼和浩特开来中学2018-2019学年高二5月期中考试化学试题云南省丘北二中2018-2019学年高二下学期期末考试化学试题河北省鸡泽县第一中学2019-2020学年高二10月月考化学试题江西省宜春市宜丰中学2019-2020学年高二上学期第三次月考化学试题云南省陆良县联办高级中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区崇左市大新县大新中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区崇左市宁明中学2019-2020学年高二上学期期末考试化学试题吉林省白城市第四中学2019-2020学年高二下学期网上阶段检测化学试题山西省长治市2019-2020学年高二下学期第一次在线月考化学试题广西隆林县第二中学2019-2020学年高二上学期期末考试化学试题福建省莆田市荔城区第二十四中学2019-2020学年高二下学期期中化学试题河北省张家口市涿鹿县涿鹿中学2019-2020学年高二下学期3月月考化学试题甘肃省张掖市临泽县第一中学2019-2020学年高二下学期期中考试化学试题江西省新余市2020-2021学年高一下学期期末质量检测化学试题河北省唐山市曹妃甸第一中学2020-2021学年高一下学期6月月考化学试题(已下线)专题讲座(十) 有机物分子中原子共线、共面的判断(精练)-2022年高考化学一轮复习讲练测黑龙江省哈尔滨工业大学附属中学校2021-2022学年高二上学期期末考试化学试题(已下线)第11讲 烃的燃烧、共面问题(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)辽宁省建平县实验中学2021-2022学年高二下学期第三次月考化学试题黑龙江省哈尔滨市德强高中2021-2022学年高二下学期期中考试化学试题上海市宝山区2022届高三模拟考试化学试题山东省青岛市2022届高三下学期五月模拟考试化学试题辽宁省部分中学2019-2020高一下学期期末考试化学试题安徽省芜湖市第一中学2022-2023学年高二上学期12月份教学质量检测化学试题7.2.2 烃、有机高分子材料 随堂练习天津市崇化中学2023-2024学年高二下学期期中阶段质量监测化学试卷
5 . 中学实验室常用如图所示装置制取少量溴苯,请回答下列问题。

(1)烧瓶a中盛装的试剂是苯、液溴和铁屑。导管b的作用有两个:一是导气,二是起________ 的作用。
(2)反应过程中在导管c的下口附近可以观察到有白雾出现,这是由于反应生成的________ (填化学式)遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入 溶液,有
溶液,有________ 生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯中,可以观察到烧杯底部有棕色不溶于水的液体。这是溶解了溴的粗溴苯,可选用试剂________________ 除去溴。

(1)烧瓶a中盛装的试剂是苯、液溴和铁屑。导管b的作用有两个:一是导气,二是起
(2)反应过程中在导管c的下口附近可以观察到有白雾出现,这是由于反应生成的
(3)反应完毕后,向锥形瓶d中滴入
 溶液,有
溶液,有(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯中,可以观察到烧杯底部有棕色不溶于水的液体。这是溶解了溴的粗溴苯,可选用试剂
您最近一年使用:0次
2020-04-10更新
|
738次组卷
|
3卷引用:2.1.2有机化学反应类型的应用——卤代烃的性质和制备(课后)-鲁科版选择性必修3
2.1.2有机化学反应类型的应用——卤代烃的性质和制备(课后)-鲁科版选择性必修3课时2 苯——A学习区 夯实基础(人教版必修2)(已下线)第15单元 实验设计与评价(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷
6 . A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称是_______ ,B含有的官能团是_______________ 。
(2)①的反应类型是____________ ,⑦的反应类型是________________ 。
(3)C和D的结构简式分别为______________ 、_________________ 。
(4)异戊二烯分子中最多有________ 个原子共平面,顺式聚异戊二烯的结构简式为___________ 。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体__________ (填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线___________________ 。

回答下列问题:
(1)A的名称是
(2)①的反应类型是
(3)C和D的结构简式分别为
(4)异戊二烯分子中最多有
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线
您最近一年使用:0次
2019-01-30更新
|
5628次组卷
|
12卷引用:3.1.2有机合成路线的设计 有机合成的应用(课后)-鲁科版选择性必修3
3.1.2有机合成路线的设计 有机合成的应用(课后)-鲁科版选择性必修3人教版2017-2018学年高二化学同步练习:选修五 3-4-1 有机合成2015年全国普通高等学校招生统一考试化学(新课标I卷)2014-2015学年辽宁师大附中高二下学期期末考试化学试卷2016届福建省福安市高级中学高三3月月考化学试卷2015-2016学年青海师大附二中高二下期中化学试卷陕西省黄陵中学2016-2017学年高二(普通班)下学期期末考试化学试题重庆市垫江县2018届高三上学期模底考试理综化学试题陕西省城固县第一中学2019届高三上学期第一次月考化学试题(已下线)2019年6月9日 《每日一题》选修5-每周一测2020届高三化学二轮对题必练——有机化学基础大题安徽省合肥市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题
真题
名校
7 . 用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
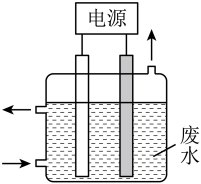

| A.用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O |
| C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- |
| D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O |
您最近一年使用:0次
2019-01-30更新
|
5602次组卷
|
56卷引用:第4节 金属的腐蚀与防护
第4节 金属的腐蚀与防护作业(七) 电解原理的应用鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第3节 电能转化为化学能——电解人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第二节 电解池 教材帮(已下线)4.2.2 电解原理的应用(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)2015年全国普通高等学校招生统一考试化学(四川卷)2016届湖南省浏阳第一中学高三上学期入学考试化学试卷2016届湖北省天门中学高三优录班8月月考化学试卷2016届福建省三明市第一中学高三上学期第二次月考化学试卷2015-2016学年辽宁省沈阳二中高二上12月月考化学试卷2016届河北省衡水市冀州中学高三上一轮复习检测二化学试卷2016届河南省三门峡市陕州中学高三上学期第二次精英对抗赛化学试卷2015-2016学年浙江省东阳中学高二上学期12月阶段测化学试卷2015-2016学年湖南省株洲二中高二上学期期末化学试卷2015-2016学年吉林大学附属中学高二上期末化学试卷2015-2016学年河北省石家庄一中高二上学期期末化学试卷2015-2016学年浙江省湖州中学高二上学期期中化学试卷浙江省宁波市效实中学2015-2016学年高一下期中化学卷2016届海南省农垦中学高三考前押题理综化学试卷2015-2016学年山东济宁微山一中高二下第二次月考化学试卷2016届河南省三门峡市灵宝三中高三上第四次质检化学试卷2017届湖北省孝感高级中学高三上9月调考化学试卷2017届湖北省沙市中学高三上学期第三次考试化学试卷2017届广西桂林十八中高三上10月月考化学试卷2016-2017学年辽宁省实验中学分校高二上期中化学卷2017届河北省冀州中学高三(高复班)上学期一轮检测(二)化学试卷2017届天津市红桥区高三上学期期末考试(下学期开学考试)化学试卷山西省怀仁县第一中学(两校区)2016-2017学年高二下学期期末考试化学试题2018版化学(苏教版)高考总复习专题六对接高考精练--电解池、金属的腐蚀与防护安徽省淮北市第一中学2017-2018学年高二上学期第一次月考化学试题安徽省淮北市第一中学2017-2018学年高一上学期第一次月考(开学考)化学试题辽宁省实验中学分校2016-2017学年高二上学期期中考试化学试题福建省厦门双十中学2017-2018学年高二下学期期中考试化学试题鲁科版高二上学期化学选修一:检测题(三)【全国百强校】河北省衡水市武邑中学2018-2019学年高二上学期第一次月考化学试题(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)福建省晋江市南侨中学2019-2020学年高二上学期第一阶段考试化学试题黑龙江省哈尔滨市尚志市尚志中学2019-2020学年高二上学期第三次月考化学试题云南省丽江市宁蒗县第一中学2019—2020学年高二上学期期末考试化学试题2020年人教版高二化学选修4化学反应原理第4章《电化学基础》练习3-1广西桂林第十八中学2016届高三上学期第三次月考化学试题(已下线)专题十 化学能与电能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训黑龙江省绥化市安达市第七中学2019-2020学年高二下学期期中考试化学试题河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分北京市新学道临川学校2021届高三上学期第一次月考化学试题(已下线)第12单元 电化学基础(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷四川省南充市阆中中学2020-2021学年高二上学期期中考试化学试题福建省福州市第十一中学2020-2021学年高二上学期期中质量检测化学试题吉林油田高级中学2019-2020学年高一下学期期末考试化学试题(已下线)练习3 电解池2020-2021学年【补习教材·寒假作业】高二化学(苏教版)湖北省沙洋县沙洋中学2020-2021学年高二12月月考化学试题上海市吴淞中学2021-2022学年高三上学期期中考试化学试题广东省华南师范大学附属中学2021-2022学年高三上学期1月模拟考试化学试题河南省南阳市六校2022-2023学年高二上学期第一次月考化学试题 广东省梅州市梅江区梅州中学2021-2022学年高三下学期开学模拟考试化学试题广东省江门市新会第一中学2023-2024学年高三下学期热身考试化学试题
名校
解题方法
8 . 常温下,下列说法正确的是
| A.pH加和为12的强酸与弱酸混合,pH可能为6 |
| B.pH加和为12的强酸与弱碱等体积混合,溶液一定呈碱性 |
| C.pH加和为12的弱酸与强碱混合,若成中性,则v(酸)>v(碱) |
| D.pH加和为12的强酸与强碱混合,若成中性,则两溶液体积比为100:1 |
您最近一年使用:0次
2018-11-08更新
|
1747次组卷
|
5卷引用:作业(十五) 溶液 pH的计算
名校
9 . 向浓度相等、体积均为50 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①________ ,②________ ,③________ ,④________ 。
(2)在稀释后的溶液中逐滴加入0.1 mol ·L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。
①A曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是________ mL(标准状况)。
②B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为_____________________________ 。
③原NaOH溶液的物质的量浓度为________________________ 。
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①
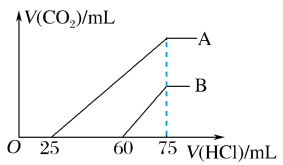
(2)在稀释后的溶液中逐滴加入0.1 mol ·L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。
①A曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是
②B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为
③原NaOH溶液的物质的量浓度为
您最近一年使用:0次
2017-02-17更新
|
1653次组卷
|
10卷引用:作业(二十) 物质的量在化学方程式计算中的应用
作业(二十) 物质的量在化学方程式计算中的应用2016-2017学年辽宁省庄河高级中学高一上期中化学卷2016-2017学年河南省南阳一中高一上月考二化学卷2016-2017学年河南省南阳一中高一月考二化学卷2016-2017学年江西省景德镇一中高一12月月考化学卷河北省邢台市第一中学2016-2017学年高二下学期第三次月考化学试题2018版化学(苏教版)高考总复习课时跟踪训练:钠、镁及其重要化合物(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第1讲 钠及其氧化物【押题专练】(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第1讲 钠及化合物 (题型专练)云南省弥勒市第二中学2020届高三上学期开学考试化学试题
名校
10 . 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料。某化学小组用水杨酸(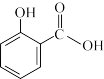 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
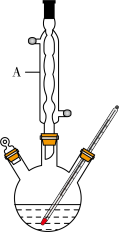
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g。
常用物理常数:
请根据以上信息回答下列问题:
(1)仪器A的名称是_______ ,加入沸石的作用是_______ 。若加热后发现未加沸石,应采取的正确方法是_______ 。
(2)制备水杨酸甲酯时,最合适的加热方法是_______ 。
(3)实验中加入甲苯对合成水杨酸甲酯的作用是_______ 。
(4)反应结束后,分离出甲醇采用的方法是_______ 。
(5)实验中加入无水硫酸镁的作用是_______ 。本实验的产率为_______ (保留两位有效数字)。
 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:

Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g。
常用物理常数:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
(1)仪器A的名称是
(2)制备水杨酸甲酯时,最合适的加热方法是
(3)实验中加入甲苯对合成水杨酸甲酯的作用是
(4)反应结束后,分离出甲醇采用的方法是
(5)实验中加入无水硫酸镁的作用是
您最近一年使用:0次
2016-12-09更新
|
1645次组卷
|
8卷引用:【知识图鉴】单元讲练测选择性必修3第3单元02基础练



