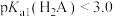25℃下, 水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
 水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是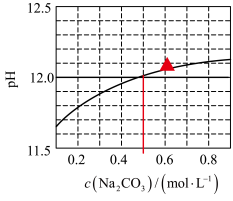
A.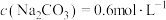 时,溶液中 时,溶液中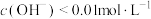 |
B. 水解程度随其浓度增大而减小 水解程度随其浓度增大而减小 |
C.在水中 的 的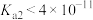 |
D. 的 的 溶液和 溶液和 的 的 溶液等体积混合,得到的溶液 溶液等体积混合,得到的溶液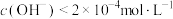 |
2023·海南·高考真题 查看更多[6]
2023年高考海南卷化学真题(已下线)不定项选择题(已下线)实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)第31讲盐类的水解(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)【精品卷】3.3.1 盐类的水解课堂例题-人教版2023-2024学年选择性必修1
更新时间:2023-08-03 19:35:17
|
相似题推荐
多选题
|
困难
(0.15)
名校
解题方法
【推荐1】H2S为二元弱酸。20℃时,向 0.100 mol/L的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是
| A.通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+) |
| B.pH=7的溶液中:c(Cl-)=c(HS-)+2c(H2S) |
| C.c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100 mol/L+c(H2S) |
| D.c(Cl-)=0.100 mol/L的溶液中:c(OH-)-c(H+)=c(H2S)-c(S2-) |
您最近一年使用:0次
多选题
|
困难
(0.15)
【推荐2】t℃时,配制一组c(H2CO3)+c( )+c(
)+c( )=1.000×10−3 mol∙L−1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如图所示。下列说法错误的是
)=1.000×10−3 mol∙L−1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如图所示。下列说法错误的是
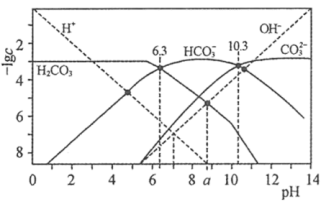
 )+c(
)+c( )=1.000×10−3 mol∙L−1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如图所示。下列说法错误的是
)=1.000×10−3 mol∙L−1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如图所示。下列说法错误的是
A.pH=a的溶液中:c( )>c(H2CO3)>c( )>c(H2CO3)>c( )>c(H+) )>c(H+) |
| B.pH=7的溶液中:c(Na+)>c(H2CO3) |
| C.pH=10.3的溶液中:c(Na+)<1.000×10−3 mol∙L−1 |
D.25℃时,反应H2CO3+  2 2 的平衡常数为1.0×104 的平衡常数为1.0×104 |
您最近一年使用:0次
多选题
|
困难
(0.15)
【推荐3】室温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.050 0 mol·L-1H2C2O4溶液所得滴定曲线如图所示。下列关于溶液中微粒的物质的量浓度关系一定正确的是
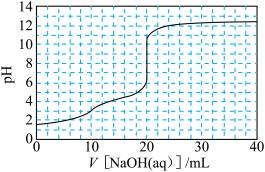

| A.在整个滴定过程中,始终存在:c(H+)+ c(Na+) =c(OH-)+c(C2O42-)+ c(HC2O4-) |
| B.当V[NaOH(aq)]=10.00 mL时:c(Na+)> c(HC2O4-)>c(C2O42-)> c(H2C2O4) |
| C.当V[NaOH(aq)]=15.00 mL时:3c(Na+)= 2c(C2O42-)+ 2c(HC2O4-)+2c(H2C2O4) |
| D.当 V[NaOH(aq)]=30.00 mL时:c(C2O42-)+2c(HC2O4-)+3c(H2C2O4)=c(OH-)-c(H+) |
您最近一年使用:0次
多选题
|
困难
(0.15)
名校
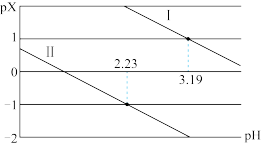
【推荐1】25℃时,向一定浓度的 溶液中逐滴加入
溶液中逐滴加入 ,以X表示
,以X表示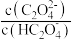 或
或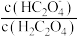 。已知
。已知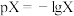 ,混合溶液
,混合溶液 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 溶液中逐滴加入
溶液中逐滴加入 ,以X表示
,以X表示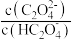 或
或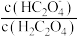 。已知
。已知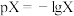 ,混合溶液
,混合溶液 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.曲线Ⅱ表示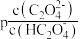 与 与 的关系 的关系 |
B. 第一步电离常数的数量级为 第一步电离常数的数量级为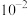 |
C. 时, 时,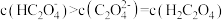 |
D. 时, 时, |
您最近一年使用:0次
多选题
|
困难
(0.15)
【推荐2】t℃时,配制一组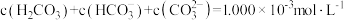 的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如下图所示。下列说法正确的是( )
的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如下图所示。下列说法正确的是( )

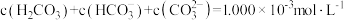 的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如下图所示。下列说法正确的是( )
的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如下图所示。下列说法正确的是( )
| A.pH=6.3的溶液中: c(Na+)>1.000×10-3mol·L-1 |
B.pH=7的溶液中: 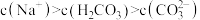 |
C.pH=a的溶液中: 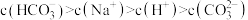 |
D.25℃时,反应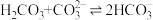 的平衡常数为1.0×104 的平衡常数为1.0×104 |
您最近一年使用:0次

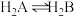
 (无催化剂不考虑转化)。常温下,催化剂存在时,调节0.1mol⋅L-1H2A溶液的pH(催化剂自身对pH无影响),H2B、HB-、B2-的平衡分布系数
(无催化剂不考虑转化)。常温下,催化剂存在时,调节0.1mol⋅L-1H2A溶液的pH(催化剂自身对pH无影响),H2B、HB-、B2-的平衡分布系数 变化如图。例如H2B的分布系数为
变化如图。例如H2B的分布系数为 。下列说法正确的是
。下列说法正确的是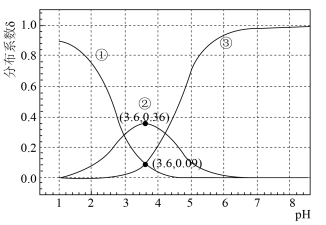
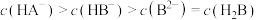
 ,
,