互为同分异构体的二元弱酸在催化剂作用下的相互转化可表示为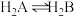
 (无催化剂不考虑转化)。常温下,催化剂存在时,调节0.1mol⋅L-1H2A溶液的pH(催化剂自身对pH无影响),H2B、HB-、B2-的平衡分布系数
(无催化剂不考虑转化)。常温下,催化剂存在时,调节0.1mol⋅L-1H2A溶液的pH(催化剂自身对pH无影响),H2B、HB-、B2-的平衡分布系数 变化如图。例如H2B的分布系数为
变化如图。例如H2B的分布系数为 。下列说法正确的是
。下列说法正确的是
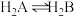
 (无催化剂不考虑转化)。常温下,催化剂存在时,调节0.1mol⋅L-1H2A溶液的pH(催化剂自身对pH无影响),H2B、HB-、B2-的平衡分布系数
(无催化剂不考虑转化)。常温下,催化剂存在时,调节0.1mol⋅L-1H2A溶液的pH(催化剂自身对pH无影响),H2B、HB-、B2-的平衡分布系数 变化如图。例如H2B的分布系数为
变化如图。例如H2B的分布系数为 。下列说法正确的是
。下列说法正确的是
| A.无催化剂存在时,NaHB溶液显碱性 |
B.有催化剂存在且pH=3.6时,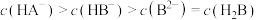 |
C. , ,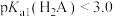 |
| D.Na2A溶液中加入催化剂后,溶液碱性增强 |
2024·山东青岛·一模 查看更多[1]
更新时间:2024-03-20 10:31:03
|
相似题推荐
多选题
|
困难
(0.15)
名校
解题方法
【推荐1】H2S为二元弱酸。20℃时,向 0.100 mol/L的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是
| A.通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+) |
| B.pH=7的溶液中:c(Cl-)=c(HS-)+2c(H2S) |
| C.c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100 mol/L+c(H2S) |
| D.c(Cl-)=0.100 mol/L的溶液中:c(OH-)-c(H+)=c(H2S)-c(S2-) |
您最近一年使用:0次
多选题
|
困难
(0.15)
【推荐2】室温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.050 0 mol·L-1H2C2O4溶液所得滴定曲线如图所示。下列关于溶液中微粒的物质的量浓度关系一定正确的是
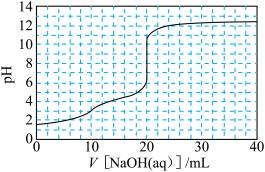

| A.在整个滴定过程中,始终存在:c(H+)+ c(Na+) =c(OH-)+c(C2O42-)+ c(HC2O4-) |
| B.当V[NaOH(aq)]=10.00 mL时:c(Na+)> c(HC2O4-)>c(C2O42-)> c(H2C2O4) |
| C.当V[NaOH(aq)]=15.00 mL时:3c(Na+)= 2c(C2O42-)+ 2c(HC2O4-)+2c(H2C2O4) |
| D.当 V[NaOH(aq)]=30.00 mL时:c(C2O42-)+2c(HC2O4-)+3c(H2C2O4)=c(OH-)-c(H+) |
您最近一年使用:0次
多选题
|
困难
(0.15)
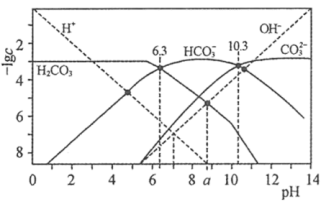
【推荐3】t℃时,配制一组c(H2CO3)+c( )+c(
)+c(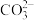 )=1.000×10−3 mol∙L−1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如图所示。下列说法错误的是
)=1.000×10−3 mol∙L−1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如图所示。下列说法错误的是
 )+c(
)+c(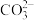 )=1.000×10−3 mol∙L−1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如图所示。下列说法错误的是
)=1.000×10−3 mol∙L−1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如图所示。下列说法错误的是
A.pH=a的溶液中:c( )>c(H2CO3)>c( )>c(H2CO3)>c(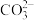 )>c(H+) )>c(H+) |
| B.pH=7的溶液中:c(Na+)>c(H2CO3) |
| C.pH=10.3的溶液中:c(Na+)<1.000×10−3 mol∙L−1 |
D.25℃时,反应H2CO3+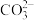  2 2 的平衡常数为1.0×104 的平衡常数为1.0×104 |
您最近一年使用:0次
多选题
|
困难
(0.15)
名校
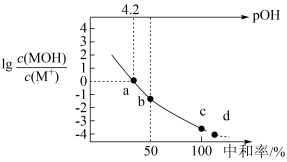
【推荐1】常温下,向 某一元碱
某一元碱 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液中
溶液,溶液中 、
、 、中和率的变化如图所示。
、中和率的变化如图所示。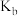 为
为 的电离常数,
的电离常数,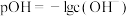 ,中和率
,中和率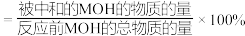 。下列说法正确的是
。下列说法正确的是
 某一元碱
某一元碱 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液中
溶液,溶液中 、
、 、中和率的变化如图所示。
、中和率的变化如图所示。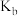 为
为 的电离常数,
的电离常数,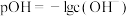 ,中和率
,中和率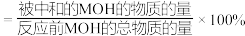 。下列说法正确的是
。下列说法正确的是
A.根据a点数据计算,常温下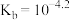 |
| B.溶液中水的电离程度从a点到d点逐渐增大 |
C.b点时, |
D.c点溶液中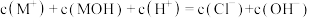 |
您最近一年使用:0次
多选题
|
困难
(0.15)
名校
解题方法
【推荐2】25℃时,用0.1mol·L-1的KOH溶液滴定10mL0.1mol·L-1的H2C2O4溶液,所得滴定曲线如图所示。忽略混合时溶液体积的变化,下列有关各点溶液中粒子浓度关系正确的是
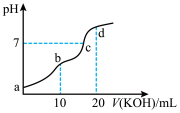

| A.a点溶液中:c(H+)=0.1mol·L-1+c(OH-)-c(H2C2O4)+c(C2O42-) |
| B.b点溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) |
| C.c点溶液中:c(K+)<c(C2O42-)-c(H2C2O4)+0.1mol·L-1 |
| D.d点溶液中:c(OH-)-c(H+)=c(H2C2O4)+c(HC2O4-) |
您最近一年使用:0次
多选题
|
困难
(0.15)
名校
解题方法
【推荐3】H2S为二元弱酸。20℃时,向 0.100 mol/L的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是
| A.通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+) |
| B.pH=7的溶液中:c(Cl-)=c(HS-)+2c(H2S) |
| C.c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100 mol/L+c(H2S) |
| D.c(Cl-)=0.100 mol/L的溶液中:c(OH-)-c(H+)=c(H2S)-c(S2-) |
您最近一年使用:0次
多选题
|
困难
(0.15)
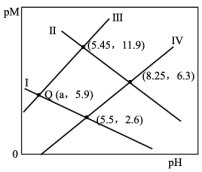
【推荐1】工业上常用 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的
。通过调节溶液的 可使
可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度(mol/L)的负对数
浓度(mol/L)的负对数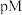 与
与 的关系如图所示。已知:
的关系如图所示。已知: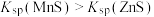 。下列说法错误的是
。下列说法错误的是
 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的
。通过调节溶液的 可使
可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度(mol/L)的负对数
浓度(mol/L)的负对数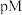 与
与 的关系如图所示。已知:
的关系如图所示。已知: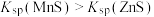 。下列说法错误的是
。下列说法错误的是
A.Ⅱ表示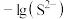 与 与 的关系曲线 的关系曲线 |
B. 点对应 点对应 的数量级为 的数量级为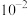 |
C.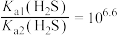 |
D.溶液中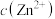 和 和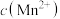 均为 均为 , , 完全沉淀时溶液的最小 完全沉淀时溶液的最小 为2(金属离子的浓度≤10-5mol/L可认为沉淀完全) 为2(金属离子的浓度≤10-5mol/L可认为沉淀完全) |
您最近一年使用:0次
多选题
|
困难
(0.15)
【推荐2】室温下,在0.1mol·L-1三元弱酸H3A溶液中,微粒H3A、H2A-、HA2-、A3-的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是
[已知:δ(X)= ]
]

[已知:δ(X)=
 ]
]
| A.反应A3-+H2A-⇌2HA2-的平衡常数的值为105.2 |
| B.物质的量浓度均为0.1mol·L-1的KH2A、K2HA混合溶液中:c(K+)>c(HA2-)>c(H2A-)>c(H+)>c(A3-)>c(OH-) |
| C.欲用H3A和K2HA配制pH=7.2的缓冲溶液(KH2A和K2HA的混合溶液),则需n(H3A):n(K2HA)=1:2 |
| D.将KOH溶液还滴加入到H3A溶液中,反应H2A-+OH-=HA2-+H2O发生的pH范围是4.7~9.8 |
您最近一年使用:0次
多选题
|
困难
(0.15)
名校
【推荐3】某温度下,改变 溶液的pH时,各种含X元素粒子及
溶液的pH时,各种含X元素粒子及 浓度变化如图所示。下列有关说法正确的是
浓度变化如图所示。下列有关说法正确的是
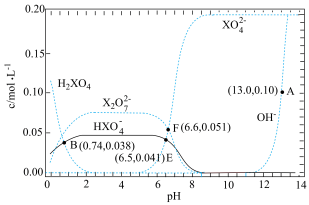
 溶液的pH时,各种含X元素粒子及
溶液的pH时,各种含X元素粒子及 浓度变化如图所示。下列有关说法正确的是
浓度变化如图所示。下列有关说法正确的是
A.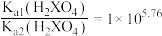 |
B.E点溶液中存在: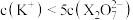 |
C.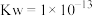 |
D.反应 的平衡常数 的平衡常数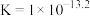 |
您最近一年使用:0次



