名校
解题方法
1 . 设NA是阿伏加德罗常数的值。下列说法正确的是
| A.1molCH≡CH分子中所含的σ键数目为5NA |
| B.22.4LCH4分子中含有的C-H数目为4NA |
| C.标准状况下,28gCH2=CH2中含π键数目为NA |
| D.CH4和2.2.4LCl2恰好完全反应,生成的CH3Cl数目为0.1NA |
您最近一年使用:0次
7日内更新
|
98次组卷
|
2卷引用:山西省运城市三晋卓越联盟2023-2024学年高二下学期期中考试化学试题
名校
解题方法
2 . A~G的转化关系如图1所示(部分产物略去),其中E为红棕色气体,G为单质。常温下,将Al片浸在不同质量分数的C溶液中,经过相同时间的腐蚀后,Al片的质量损失情况如图2所示。
(1)写出下列物质的化学式:A___________ 、E___________ 。
(2)反应④、⑤的化学方程式:④___________ 、⑤___________ 。
(3)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为___________ 。
(4)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是___________ mL。
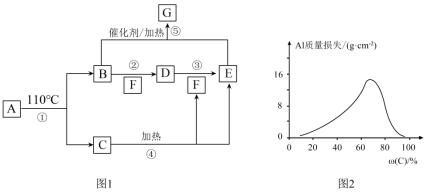
(1)写出下列物质的化学式:A
(2)反应④、⑤的化学方程式:④
(3)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为
(4)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是
您最近一年使用:0次
3 . 设 为阿伏加德罗常数的值.工业上,接触法制备硫酸的原理:①
为阿伏加德罗常数的值.工业上,接触法制备硫酸的原理:① ;②
;② 催化氧化制备
催化氧化制备 ;③用98.3%的浓硫酸吸收
;③用98.3%的浓硫酸吸收 .已知:
.已知: 具有
具有 类似结构.下列叙述正确的是
类似结构.下列叙述正确的是
 为阿伏加德罗常数的值.工业上,接触法制备硫酸的原理:①
为阿伏加德罗常数的值.工业上,接触法制备硫酸的原理:① ;②
;② 催化氧化制备
催化氧化制备 ;③用98.3%的浓硫酸吸收
;③用98.3%的浓硫酸吸收 .已知:
.已知: 具有
具有 类似结构.下列叙述正确的是
类似结构.下列叙述正确的是A.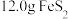 含阴离子数为 含阴离子数为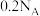 |
B.①中每生成 时转移电子数为 时转移电子数为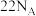 |
C.标准状况下,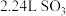 含原子数为 含原子数为 |
D.②中 和 和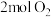 反应生成 反应生成 分子数为 分子数为 |
您最近一年使用:0次
4 . 水体中氨氮含量超标会造成水体富营养化,用次氯酸钙除去氨氮的原理如图所示。下列说法错误的是
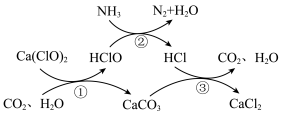
A.标准状况下, 所含的共用电子对数目为 所含的共用电子对数目为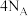 |
B.标准状况下, 所含的原子总数为 所含的原子总数为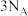 |
C.标准状况下, 气体溶于 气体溶于 水中形成的溶液浓度为 水中形成的溶液浓度为 |
D.反应②每生成 消耗 消耗 分子数目为 分子数目为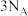 |
您最近一年使用:0次
解题方法
5 . 向一定量的饱和石灰水中加入少量CaO固体,恢复到原来温度时,下列说法正确的是
| A.溶液中的Ca2+总数不变 | B.溶液中OH-数目增加 |
| C.溶质的物质的量浓度不变 | D.溶液的质量不变 |
您最近一年使用:0次
名校
解题方法
6 . 实验室用32g铜与足量的一定浓度的硝酸充分反应,生成11.2LNO、NO2混合气体(标准状况下),则参加反应的HNO3的物质的量是
| A.1.0mol | B.1.5mol | C.2.0mol | D.2.5mol |
您最近一年使用:0次
解题方法
7 . 已知2-氯-1-丙醇的结构为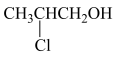 ,设为阿伏加德罗常数的值。下列说法错误的是
,设为阿伏加德罗常数的值。下列说法错误的是
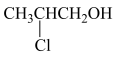 ,设为阿伏加德罗常数的值。下列说法错误的是
,设为阿伏加德罗常数的值。下列说法错误的是A. 该物质中含有 该物质中含有 键的数目为 键的数目为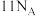 |
B. 该物质中含有手性碳原子的数目为 该物质中含有手性碳原子的数目为 |
C.该物质与足量金属钠反应,转移的电子数为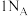 |
D.在 溶液中水解生成 溶液中水解生成 1,2-丙二醇时,该物质断裂的共价键总数为 1,2-丙二醇时,该物质断裂的共价键总数为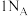 |
您最近一年使用:0次
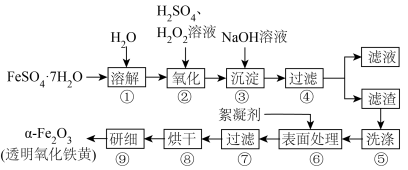
8 . 透明氧化铁黄具有优良着色性能和保色性且使用安全,受到广泛重视,某研究性学习小组拟用硫酸亚铁做原料进行制备,实验流程如图所示:
(1)步骤④用到的仪器除铁架台(带铁圈)、烧杯、玻璃棒之外还需要_______ ;步骤⑨用到的仪器是_______ 。
(2)步骤②发生反应的离子方程式为_______ 。
(3)步骤④所得滤渣的主要成分是_______ (写化学式)。
(4)证明步骤⑤已洗涤干净的方法是_______ 。
(5)步骤②中除用 氧化之外,还可以用
氧化之外,还可以用 氧化,若有2.78g
氧化,若有2.78g 溶解后通氧气,至少需通入标准状况下
溶解后通氧气,至少需通入标准状况下
_______ mL。
(6)将透明氧化铁黄溶于水制得的胶体不具有的性质或用途是_______(填字母)。
(1)步骤④用到的仪器除铁架台(带铁圈)、烧杯、玻璃棒之外还需要
(2)步骤②发生反应的离子方程式为
(3)步骤④所得滤渣的主要成分是
(4)证明步骤⑤已洗涤干净的方法是
(5)步骤②中除用
 氧化之外,还可以用
氧化之外,还可以用 氧化,若有2.78g
氧化,若有2.78g 溶解后通氧气,至少需通入标准状况下
溶解后通氧气,至少需通入标准状况下
(6)将透明氧化铁黄溶于水制得的胶体不具有的性质或用途是_______(填字母)。
| A.分散质的直径为1nm~100nm | B.用激光笔照射时,有一条光亮的通路 |
| C.可用作除氧剂 | D.肉眼很难区分该胶体和溶液 |
您最近一年使用:0次
2024-04-03更新
|
88次组卷
|
2卷引用:山西省部分学校2023-2024学年高一上学期1月期末化学试题
名校
9 . 氯化亚铜化学式为CuCl,白色立方结晶或白色粉末,难溶于水,在潮湿的空气中易氧化,不溶于乙醇,常用作催化剂、杀菌剂、媒染剂、脱色剂等。
I.CuCl的制备
取25g CuSO4∙5H2O和6.43gNaCl并加少量水溶解,将溶液倒入如图所示的三颈烧瓶中,加热至50℃,向三颈烧瓶中缓慢滴加Na2SO3和Na2CO3的混合溶液,使其持续反应30min。待反应结束后将混合物静置一段时间,抽滤,沉淀依次用36%的乙酸、无水乙醇、无水乙醚洗涤多次,得白色固体,真空或者充氮气保存。___________ 。
(2)反应时使用NaCl浓溶液,主要目的是___________ 。
(3)三颈烧瓶中CuSO4、NaCl、Na2SO3反应生成CuCl的离子方程式为___________ ;缓慢滴加Na2SO3和Na2CO3的混合溶液的主要原因是___________ 。
(4)沉淀用无水乙醇洗涤的目的是___________ 。
II.CuCl样品纯度的测定
准确称取CuCl样品0.25g,将其置于足量FeCl3溶液中,待固体完全溶解后,加水50mL和邻菲啰啉指示剂2滴,立即用amol∙L-1 Ce(SO4)2标准溶液滴定至绿色出现且30s不褪色,即为终点,重复2~3次,平均消耗Ce(SO4)2标准溶液bmL(已知: ,
, )
)
(5)滴定时应将Ce(SO4)2标准溶液加入___________ (填“酸式滴定管”或“碱式滴定管”)中;该样品中CuCl的质量分数为___________ ×100%。(用含a、b的代数式表示,列出计算式即可)
(6)下列操作可能会导致样品纯度测量结果偏低的是___________。(填标号)
I.CuCl的制备
取25g CuSO4∙5H2O和6.43gNaCl并加少量水溶解,将溶液倒入如图所示的三颈烧瓶中,加热至50℃,向三颈烧瓶中缓慢滴加Na2SO3和Na2CO3的混合溶液,使其持续反应30min。待反应结束后将混合物静置一段时间,抽滤,沉淀依次用36%的乙酸、无水乙醇、无水乙醚洗涤多次,得白色固体,真空或者充氮气保存。

(2)反应时使用NaCl浓溶液,主要目的是
(3)三颈烧瓶中CuSO4、NaCl、Na2SO3反应生成CuCl的离子方程式为
(4)沉淀用无水乙醇洗涤的目的是
II.CuCl样品纯度的测定
准确称取CuCl样品0.25g,将其置于足量FeCl3溶液中,待固体完全溶解后,加水50mL和邻菲啰啉指示剂2滴,立即用amol∙L-1 Ce(SO4)2标准溶液滴定至绿色出现且30s不褪色,即为终点,重复2~3次,平均消耗Ce(SO4)2标准溶液bmL(已知:
 ,
, )
)(5)滴定时应将Ce(SO4)2标准溶液加入
(6)下列操作可能会导致样品纯度测量结果偏低的是___________。(填标号)
| A.样品在空气中放置时间过长 |
| B.盛装Ce(SO4)2标准溶液的滴定管未用标准溶液润洗 |
| C.锥形瓶中装待测液前未干燥 |
| D.滴定管内部滴定前无气泡,滴定后有气泡 |
您最近一年使用:0次
2024-04-02更新
|
613次组卷
|
4卷引用:山西省太原市2024届高三一模理综试卷-高中化学
山西省太原市2024届高三一模理综试卷-高中化学(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)河南省郑州市宇华实验学校2024届高三下学期第三次模拟考试化学试题(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
10 . 乙炔水化法、乙烯氧化法是工业上制备乙醛的两个重要方法,反应原理分别为: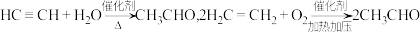 。以下叙述不正确的是
。以下叙述不正确的是
 。以下叙述不正确的是
。以下叙述不正确的是A. 的电子式为 的电子式为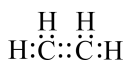 |
| B.根据价层电子互斥模型,18g水的中心原子含有2mol孤电子对 |
C.乙烯氧化法中,生成0.1mol乙醛时,转移的电子数约为 |
D.标准状况下,11.2L 中含有π键的数目约为 中含有π键的数目约为 |
您最近一年使用:0次
2024-03-31更新
|
148次组卷
|
2卷引用:山西省朔州市怀仁市第九中学高中部2023-2024学年高三上学期11月期中考试化学试题



