名校
1 . 氯化氰 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为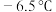 ,沸点为
,沸点为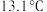 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。
(1)D装置中盛放 的仪器名称为
的仪器名称为_______ ,检验A装置气密性的方法是_______ 。
(2)A装置中发生反应生成 的离子方程式为
的离子方程式为_______ , 的作用是
的作用是_______ 。
(3)B、C装置中盛放的试剂相同,其作用是_______ 。F装置的作用是降低温度,其中干冰起作用的原因是_______ 。
(4)在 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为_______ ,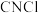 的电子式为
的电子式为_______ 。
(5)上述实验中, 完全反应时收集到
完全反应时收集到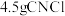 ,则产率为
,则产率为_______ %(保留2位小数)。
 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为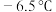 ,沸点为
,沸点为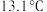 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。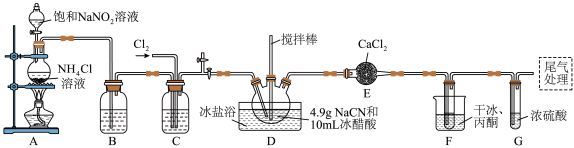
(1)D装置中盛放
 的仪器名称为
的仪器名称为(2)A装置中发生反应生成
 的离子方程式为
的离子方程式为 的作用是
的作用是(3)B、C装置中盛放的试剂相同,其作用是
(4)在
 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为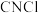 的电子式为
的电子式为(5)上述实验中,
 完全反应时收集到
完全反应时收集到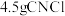 ,则产率为
,则产率为
您最近一年使用:0次
解题方法
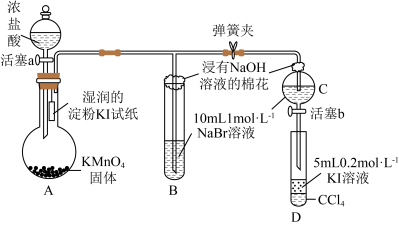
2 . 为证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
已知:①溴水呈黄色,而且颜色随浓度增大而加深。
② 容易从水中转移到
容易从水中转移到 中,导致下层(
中,导致下层( 层)因溶有
层)因溶有 显紫色。
显紫色。
实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液黄色加深时关闭活塞a。
④……
(1)NaOH的电子式为___________ 。
(2)A装置中制备氯气的离子方程式为___________ ,HCl的作用是做___________ 。
(3)B装置中主要反应的化学方程式为___________ 。
(4)为验证溴的氧化性强于碘,过程④的操作和现象分别是___________ 。
(5)过程③的实验目的是___________ 。
(6)结合元素周期表,从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:___________ 。
(7)下列事实能说明元素Y的非金属性比硫元素强的是___________ 。
a.Y单质通入 溶液中,溶液出现淡黄色浑浊
溶液中,溶液出现淡黄色浑浊
b.与 反应时,1mol Y单质得到的电子比1mol S多
反应时,1mol Y单质得到的电子比1mol S多
c.Y和S的简单氢化物受热时,前者的分解温度较高
d.Y元素的氧化物对应水化物的酸性比S强
已知:①溴水呈黄色,而且颜色随浓度增大而加深。
②
 容易从水中转移到
容易从水中转移到 中,导致下层(
中,导致下层( 层)因溶有
层)因溶有 显紫色。
显紫色。实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液黄色加深时关闭活塞a。
④……
(1)NaOH的电子式为
(2)A装置中制备氯气的离子方程式为
(3)B装置中主要反应的化学方程式为
(4)为验证溴的氧化性强于碘,过程④的操作和现象分别是
(5)过程③的实验目的是
(6)结合元素周期表,从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:
(7)下列事实能说明元素Y的非金属性比硫元素强的是
a.Y单质通入
 溶液中,溶液出现淡黄色浑浊
溶液中,溶液出现淡黄色浑浊b.与
 反应时,1mol Y单质得到的电子比1mol S多
反应时,1mol Y单质得到的电子比1mol S多c.Y和S的简单氢化物受热时,前者的分解温度较高
d.Y元素的氧化物对应水化物的酸性比S强
您最近一年使用:0次
名校
解题方法
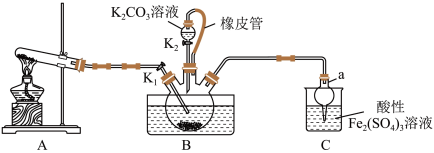
3 . 硫氰化钾(KSCN)是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图实验装置模拟工业制备 KSCN 并进行相关探究实验。___________ 。
(2)装置A用于实验室制备氨气,反应的化学方程式为___________ 。
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是___________ (写两点)。
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至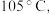 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是___________ 。
(5)尾气处理:装置C 中仪器a的名称是___________ ,酸性Fe₂(SO₄)₃溶液用于除去尾气中两种污染性气体,其中一种气体M能使酚酞溶液变红,另一种气体N能使溶液产生淡黄色沉淀,写出除去气体N的离子方程式___________ 。
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知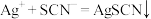 (白色)]:
(白色)]:___________ [可供选择的试剂: 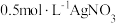 溶液、
溶液、 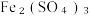 溶液、
溶液、 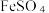 溶液、
溶液、  溶液]。
溶液]。

(2)装置A用于实验室制备氨气,反应的化学方程式为
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至
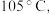 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是(5)尾气处理:装置C 中仪器a的名称是
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知
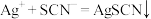 (白色)]:
(白色)]: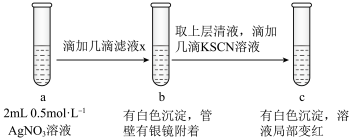
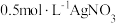 溶液、
溶液、 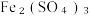 溶液、
溶液、 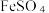 溶液、
溶液、  溶液]。
溶液]。
您最近一年使用:0次
名校
解题方法
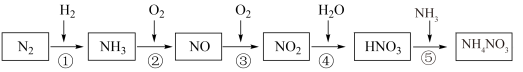
4 . 氮元素及其化合物的转化关系如图所示:___________ ,写出 的电子式
的电子式___________ 。
(2)浓、稀 的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:
的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:___________ 。
(3)氮氧化物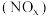 是大气污染物之一,处理
是大气污染物之一,处理 对于环境保护具有重要的意义。在一定条件下
对于环境保护具有重要的意义。在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。 ,反应的化学方程式为
,反应的化学方程式为___________ ;装置B内的试剂是___________ 。
②在装置 中
中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中  和
和 的物质的量之比为
的物质的量之比为___________ 。
③工厂里常采用 溶液吸收
溶液吸收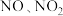 的混合气体,使其转化为化工产品
的混合气体,使其转化为化工产品 ,试写出其化学方程式:
,试写出其化学方程式:___________ 。
④用不同浓度的 溶液吸收
溶液吸收 含量不同的尾气,关系如图:(
含量不同的尾气,关系如图:( 表示尾气里
表示尾气里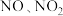 中
中 的含量)
的含量) 含量越大,氮氧化物的吸收率越大,当
含量越大,氮氧化物的吸收率越大,当 小于
小于 时,加入
时,加入  能提升氮氧化物的吸收率,原因是
能提升氮氧化物的吸收率,原因是___________ 。
(4) 是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:
是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:___________ (写出操作步骤、现象和结论)。
 的电子式
的电子式(2)浓、稀
 的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:
的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:(3)氮氧化物
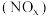 是大气污染物之一,处理
是大气污染物之一,处理 对于环境保护具有重要的意义。在一定条件下
对于环境保护具有重要的意义。在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。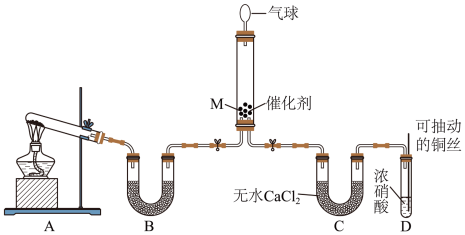
 ,反应的化学方程式为
,反应的化学方程式为②在装置
 中
中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中  和
和 的物质的量之比为
的物质的量之比为③工厂里常采用
 溶液吸收
溶液吸收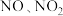 的混合气体,使其转化为化工产品
的混合气体,使其转化为化工产品 ,试写出其化学方程式:
,试写出其化学方程式:④用不同浓度的
 溶液吸收
溶液吸收 含量不同的尾气,关系如图:(
含量不同的尾气,关系如图:( 表示尾气里
表示尾气里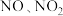 中
中 的含量)
的含量)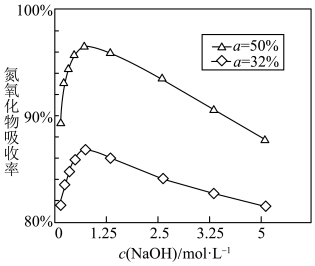
 含量越大,氮氧化物的吸收率越大,当
含量越大,氮氧化物的吸收率越大,当 小于
小于 时,加入
时,加入  能提升氮氧化物的吸收率,原因是
能提升氮氧化物的吸收率,原因是(4)
 是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:
是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:
您最近一年使用:0次
名校
5 . 氮是自然界中生物体生命活动不可缺少的重要元素,其化合物种类丰富。
Ⅰ.氨是重要的化工原料,某同学设计如图装置制备氨气并进行氨气的性质检验,部分夹持装置己省略,请回答下列问题: 的电子式为
的电子式为___________ 。
(2)试管内发生反应的化学方程式为___________ 。
(3)①实验之前先检验装置的气密性,然后放入试剂,打开止水夹a、c,关闭止水夹b,再点燃酒精灯,实验过程中丙装置的作用是___________ 。
②一段时间后, 充满三颈烧瓶,关闭止水夹a、c,打开止水夹b,将注射器内的蒸馏水注入三颈烧瓶中,片刻后三颈烧瓶内可以观察到的现象为
充满三颈烧瓶,关闭止水夹a、c,打开止水夹b,将注射器内的蒸馏水注入三颈烧瓶中,片刻后三颈烧瓶内可以观察到的现象为___________ 。
③为提高乙装置中实验的成功率,将盛放有___________ 的干燥管连接在甲、乙装置之间。
Ⅱ.研究氮的循环和转化对生产、生活有重要的价值,某工厂制硝酸的流程如图所示。___________ (填“ⅰ”“ⅱ”或“ⅲ”)。
(5)写出“氧化炉”中反应的化学方程式___________ 。
(6)“吸收塔”排出的尾气中会含有NO、 等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。请将纯碱溶液与
等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。请将纯碱溶液与 反应的化学方程式补充完整:
反应的化学方程式补充完整:______ 。
 ___________
___________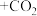 。
。
Ⅰ.氨是重要的化工原料,某同学设计如图装置制备氨气并进行氨气的性质检验,部分夹持装置己省略,请回答下列问题:
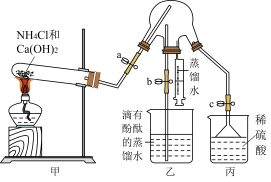
 的电子式为
的电子式为(2)试管内发生反应的化学方程式为
(3)①实验之前先检验装置的气密性,然后放入试剂,打开止水夹a、c,关闭止水夹b,再点燃酒精灯,实验过程中丙装置的作用是
②一段时间后,
 充满三颈烧瓶,关闭止水夹a、c,打开止水夹b,将注射器内的蒸馏水注入三颈烧瓶中,片刻后三颈烧瓶内可以观察到的现象为
充满三颈烧瓶,关闭止水夹a、c,打开止水夹b,将注射器内的蒸馏水注入三颈烧瓶中,片刻后三颈烧瓶内可以观察到的现象为③为提高乙装置中实验的成功率,将盛放有
Ⅱ.研究氮的循环和转化对生产、生活有重要的价值,某工厂制硝酸的流程如图所示。
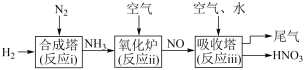
(5)写出“氧化炉”中反应的化学方程式
(6)“吸收塔”排出的尾气中会含有NO、
 等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。请将纯碱溶液与
等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。请将纯碱溶液与 反应的化学方程式补充完整:
反应的化学方程式补充完整: ___________
___________ 。
。
您最近一年使用:0次
解题方法
6 . 氯化钠是日常生活必需品和重要的化工原料。
(1)NaCl固体是否属于电解质?______ ,是否能导电?______ (填写“是”或“否”)。
(2)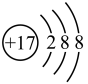 表示
表示______ 。
A.氯原子的结构示意图
B.氯离子的结构示意图
(3)实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去Ca2+、Mg2+、SO 等可溶性杂质。
等可溶性杂质。
①写出NaCl溶于水时的电离方程式______ 。
②为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和______ 。
(4)“84消毒液”是常见的消毒剂,其有效成分是NaClO。
①Cl2和NaOH制备NaClO的离子方程式为_______ 。
如图是某品牌“84消毒液”的使用注意事项。
②注意事项4“易使有色衣物脱色”,是因为“84消毒液”具有______ 。
A.碱性 B.强氧化性
③注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式_______ 。
(1)NaCl固体是否属于电解质?
(2)
 表示
表示A.氯原子的结构示意图
B.氯离子的结构示意图
(3)实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去Ca2+、Mg2+、SO
 等可溶性杂质。
等可溶性杂质。①写出NaCl溶于水时的电离方程式
②为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和
(4)“84消毒液”是常见的消毒剂,其有效成分是NaClO。
①Cl2和NaOH制备NaClO的离子方程式为
如图是某品牌“84消毒液”的使用注意事项。
| 注意事项 1、外用消毒液,勿口服; 2、现用现配,使用时注意戴手套防护; 3、不适用于钢和铝制品的消毒; 4、易使有色衣物脱色; 5、避光、阴凉处保存; 6、不可与酸性物质同时使用. |
A.碱性 B.强氧化性
③注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式
您最近一年使用:0次
解题方法
7 . X、Y、Z、W、Q是元素周期表中原子序数依次增大的五种短周期主族元素,相关信息如下:
X最外层电子数是内层电子数的2倍,Y其单质与氢气在暗处能剧烈化合并发生爆炸,Z短周期元素中原子半径最大,W其氧化物是两性氧化物,Q同周期元素中,最高价氧化物对应水化物的酸性最强
(1)元素Y在元素周期表中的位置是_______ 。
(2)Z在氧气中完全燃烧所得产物的电子式为_______ 。
(3)Y、W、Q的简单离子半径由大到小的顺序是_______ (用离子符号表示)。
(4)某同学为了比较X元素和硅元素非金属性的相对强弱,用如图所示装置进行实验。
已知: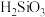 是一种难溶于水的白色物质。
是一种难溶于水的白色物质。
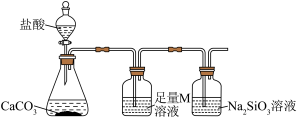
①盛放盐酸和碳酸钙的仪器名称分别是:_______ 、_______ ;M为_______ (填化学式),其作用是_______ 。
②能说明X元素的非金属性比硅元素强的实验现象是_______ 。
(5)元素Z与W相比,金属性较弱的是_______ (填元素名称),请写出能证明这一结论的实验事实_______ (列举一条)。
X最外层电子数是内层电子数的2倍,Y其单质与氢气在暗处能剧烈化合并发生爆炸,Z短周期元素中原子半径最大,W其氧化物是两性氧化物,Q同周期元素中,最高价氧化物对应水化物的酸性最强
(1)元素Y在元素周期表中的位置是
(2)Z在氧气中完全燃烧所得产物的电子式为
(3)Y、W、Q的简单离子半径由大到小的顺序是
(4)某同学为了比较X元素和硅元素非金属性的相对强弱,用如图所示装置进行实验。
已知:
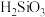 是一种难溶于水的白色物质。
是一种难溶于水的白色物质。
①盛放盐酸和碳酸钙的仪器名称分别是:
②能说明X元素的非金属性比硅元素强的实验现象是
(5)元素Z与W相比,金属性较弱的是
您最近一年使用:0次
8 . 有机物是重要的化工原料和能源物资。回答下列问题:
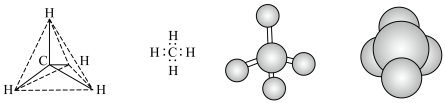
(1)下列各图均能表示甲烷的分子结构,其中最能反映其真实存在情况的是___________(填字母)。
(2)某课外活动小组利用如图所示装置探究甲烷和氯气的反应:

①甲烷与氯气在光照条件下的反应属于___________ 反应。
②请写出生成一氯甲烷的化学反应方程式:___________ 。
③将1molCH4与Cl2发生反应,若充分反应后生成的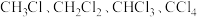 四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为
四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为___________  。
。
(3)有机物 中,与甲烷互为同系物的是
中,与甲烷互为同系物的是___________ 。写出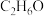 的一种结构
的一种结构 与金属钠反应的化学方程式
与金属钠反应的化学方程式___________ 。
(4)某链状烷烃的相对分子质量为72,该烷烃的分子式为___________ ,该烷烃存在同分异构现象,写出该有机物的所有结构的结构简式___________ 。
(1)下列各图均能表示甲烷的分子结构,其中最能反映其真实存在情况的是___________(填字母)。

| A.分子结构示意图 | B.电子式 | C.球棍模型 | D.空间填充模型 |
(2)某课外活动小组利用如图所示装置探究甲烷和氯气的反应:

①甲烷与氯气在光照条件下的反应属于
②请写出生成一氯甲烷的化学反应方程式:
③将1molCH4与Cl2发生反应,若充分反应后生成的
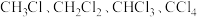 四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为
四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为 。
。(3)有机物
 中,与甲烷互为同系物的是
中,与甲烷互为同系物的是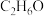 的一种结构
的一种结构 与金属钠反应的化学方程式
与金属钠反应的化学方程式(4)某链状烷烃的相对分子质量为72,该烷烃的分子式为
您最近一年使用:0次
名校
9 . 硫脲 在药物制备、金属矿物浮选等方面有广泛应用。实验室中合成
在药物制备、金属矿物浮选等方面有广泛应用。实验室中合成 的方法是先制备
的方法是先制备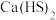 ,再与
,再与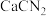 (氰氨基化钙)反应得到
(氰氨基化钙)反应得到 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。 易溶于水,易被氧化,受热(150℃左右)时会部分发生异构化生成同分异构体
易溶于水,易被氧化,受热(150℃左右)时会部分发生异构化生成同分异构体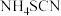 。
。
实验步骤如下:
①实验前先检查装置气密性,然后加入药品,关闭 ,打开
,打开 ,通入
,通入 一段时间。
一段时间。
②关闭 ,打开
,打开 ,至反应结束后关闭
,至反应结束后关闭 ,打开
,打开 ,再通入
,再通入 一段时间。
一段时间。
③撤走搅拌器,打开 ,水浴加热
,水浴加热 中三颈烧瓶,在80℃时合成硫脲。
中三颈烧瓶,在80℃时合成硫脲。
④将 中三颈烧瓶内的混合物过滤后,结晶得到粗产品。
中三颈烧瓶内的混合物过滤后,结晶得到粗产品。
回答下列问题:
(1)写出硫脲 的结构式:
的结构式:_______ 。
(2)工业上制备硫脲时,常利用足量碳将 高温下还原为
高温下还原为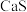 ,然后再利用
,然后再利用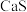 进一步合成硫脲,试写出足量碳与
进一步合成硫脲,试写出足量碳与 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)B中最合适的试剂可选择_______ (填序号)。
①饱和 溶液 ②饱和
溶液 ②饱和 溶液 ③饱和
溶液 ③饱和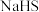 溶液 ④
溶液 ④ 溶液
溶液
(4)步骤①中通入 的目的是
的目的是_______ 。
(5)请配平合成硫脲的反应方程式:_______ 。
_______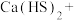 _______
_______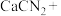 _______
_______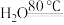 _______
_______ _______
_______
(6)步骤③中控制温度在80℃,不宜过高的原因是_______ 。
(7)产品纯度的测定:称取 粗产品,配制成
粗产品,配制成 溶液,量取
溶液,量取 该溶液,用
该溶液,用 的酸性
的酸性 溶液滴定(假设杂质不参加反应),滴至终点时平均消耗酸性
溶液滴定(假设杂质不参加反应),滴至终点时平均消耗酸性 溶液的体积为
溶液的体积为 。该产品的纯度为
。该产品的纯度为_______  (化为最简式)。已知:
(化为最简式)。已知: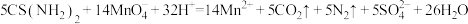 。
。
 在药物制备、金属矿物浮选等方面有广泛应用。实验室中合成
在药物制备、金属矿物浮选等方面有广泛应用。实验室中合成 的方法是先制备
的方法是先制备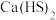 ,再与
,再与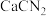 (氰氨基化钙)反应得到
(氰氨基化钙)反应得到 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。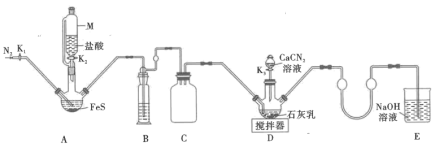
 易溶于水,易被氧化,受热(150℃左右)时会部分发生异构化生成同分异构体
易溶于水,易被氧化,受热(150℃左右)时会部分发生异构化生成同分异构体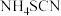 。
。实验步骤如下:
①实验前先检查装置气密性,然后加入药品,关闭
 ,打开
,打开 ,通入
,通入 一段时间。
一段时间。②关闭
 ,打开
,打开 ,至反应结束后关闭
,至反应结束后关闭 ,打开
,打开 ,再通入
,再通入 一段时间。
一段时间。③撤走搅拌器,打开
 ,水浴加热
,水浴加热 中三颈烧瓶,在80℃时合成硫脲。
中三颈烧瓶,在80℃时合成硫脲。④将
 中三颈烧瓶内的混合物过滤后,结晶得到粗产品。
中三颈烧瓶内的混合物过滤后,结晶得到粗产品。回答下列问题:
(1)写出硫脲
 的结构式:
的结构式:(2)工业上制备硫脲时,常利用足量碳将
 高温下还原为
高温下还原为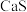 ,然后再利用
,然后再利用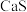 进一步合成硫脲,试写出足量碳与
进一步合成硫脲,试写出足量碳与 发生反应的化学方程式为
发生反应的化学方程式为(3)B中最合适的试剂可选择
①饱和
 溶液 ②饱和
溶液 ②饱和 溶液 ③饱和
溶液 ③饱和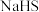 溶液 ④
溶液 ④ 溶液
溶液(4)步骤①中通入
 的目的是
的目的是(5)请配平合成硫脲的反应方程式:
_______
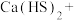 _______
_______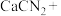 _______
_______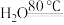 _______
_______ _______
_______
(6)步骤③中控制温度在80℃,不宜过高的原因是
(7)产品纯度的测定:称取
 粗产品,配制成
粗产品,配制成 溶液,量取
溶液,量取 该溶液,用
该溶液,用 的酸性
的酸性 溶液滴定(假设杂质不参加反应),滴至终点时平均消耗酸性
溶液滴定(假设杂质不参加反应),滴至终点时平均消耗酸性 溶液的体积为
溶液的体积为 。该产品的纯度为
。该产品的纯度为 (化为最简式)。已知:
(化为最简式)。已知: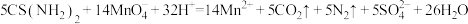 。
。
您最近一年使用:0次
2024-02-25更新
|
423次组卷
|
3卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期月考(七)理综化学试题
名校
解题方法
10 . 某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其他铁的化合物.某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
步骤一:取10片补血剂研磨成粉末,加入 的稀硫酸,充分溶解后过滤.
的稀硫酸,充分溶解后过滤.
步骤二:取上述过滤后的滤液,滴加 溶液,再加入过量的
溶液,再加入过量的 溶液,充分反应后,过滤.
溶液,充分反应后,过滤.
步骤三:将步骤二过滤所得固体灼烧至恒重,称量,质量为 .
.
请回答下列问题:
(1)实验室用 的浓硫酸配制
的浓硫酸配制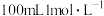 的硫酸溶液,所需浓硫酸的体积为
的硫酸溶液,所需浓硫酸的体积为____________  (计算结果精确到小数点后一位).
(计算结果精确到小数点后一位).
(2)可使用容量瓶进行下列操作中的____________ (填标号).
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.代替量筒量取一定体积的液体
(3) 的电子式为
的电子式为____________ ,步骤二中加入过量 发生反应的离子方程式为
发生反应的离子方程式为____________ .
(4)每片补血剂中含硫酸亚铁的质量为____________ g(用含a的代数式表示).
(5) 用作补血剂使用时,医生建议与维生素C片同服,同学甲猜测维生素C可将
用作补血剂使用时,医生建议与维生素C片同服,同学甲猜测维生素C可将 转化为
转化为 以利于人体吸收.为了验证这一猜想,设计如下实验:
以利于人体吸收.为了验证这一猜想,设计如下实验:
由上述实验能否得出维生素C可将 转化为
转化为 的结论?
的结论?____________ (填“能”或“否”),请说明理由:____________ .
(6)往 溶液中滴加
溶液中滴加 溶液,有白色沉淀A生成.某实验小组对所得白色沉淀A展开研究:
溶液,有白色沉淀A生成.某实验小组对所得白色沉淀A展开研究:
查阅资料:在溶液中不存在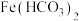 .
.
Ⅰ.取少量白色沉淀A,充分洗涤后,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
Ⅱ.向Ⅰ所得溶液中滴入 试剂,溶液几乎不变色;
试剂,溶液几乎不变色;
Ⅲ.向Ⅱ溶液中再滴入少量氯水,溶液立即变为红色.
根据以上现象,生成的白色沉淀A的化学式为____________ .
步骤一:取10片补血剂研磨成粉末,加入
 的稀硫酸,充分溶解后过滤.
的稀硫酸,充分溶解后过滤.步骤二:取上述过滤后的滤液,滴加
 溶液,再加入过量的
溶液,再加入过量的 溶液,充分反应后,过滤.
溶液,充分反应后,过滤.步骤三:将步骤二过滤所得固体灼烧至恒重,称量,质量为
 .
.请回答下列问题:
(1)实验室用
 的浓硫酸配制
的浓硫酸配制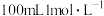 的硫酸溶液,所需浓硫酸的体积为
的硫酸溶液,所需浓硫酸的体积为 (计算结果精确到小数点后一位).
(计算结果精确到小数点后一位).(2)可使用容量瓶进行下列操作中的
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.代替量筒量取一定体积的液体
(3)
 的电子式为
的电子式为 发生反应的离子方程式为
发生反应的离子方程式为(4)每片补血剂中含硫酸亚铁的质量为
(5)
 用作补血剂使用时,医生建议与维生素C片同服,同学甲猜测维生素C可将
用作补血剂使用时,医生建议与维生素C片同服,同学甲猜测维生素C可将 转化为
转化为 以利于人体吸收.为了验证这一猜想,设计如下实验:
以利于人体吸收.为了验证这一猜想,设计如下实验:| 实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 溶液紫红色褪去 |
 转化为
转化为 的结论?
的结论?(6)往
 溶液中滴加
溶液中滴加 溶液,有白色沉淀A生成.某实验小组对所得白色沉淀A展开研究:
溶液,有白色沉淀A生成.某实验小组对所得白色沉淀A展开研究:查阅资料:在溶液中不存在
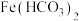 .
.Ⅰ.取少量白色沉淀A,充分洗涤后,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
Ⅱ.向Ⅰ所得溶液中滴入
 试剂,溶液几乎不变色;
试剂,溶液几乎不变色;Ⅲ.向Ⅱ溶液中再滴入少量氯水,溶液立即变为红色.
根据以上现象,生成的白色沉淀A的化学式为
您最近一年使用:0次
2024-02-03更新
|
53次组卷
|
3卷引用:陕西省商洛市2023-2024学年高一上学期期末统测化学试题



