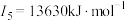名校
解题方法
1 . I 亚硝酰氯(NOCl)是有机药物制备的重要试剂,可按以下流程合成和利用。
(1)NOCl的电子式为___________ ,化合物X的结构简式为___________ 。
(2)下列说法正确的是___________。
(3)已知浓盐酸和浓硝酸混合配制王水时会产生亚硝酰氯,写出该反应的化学方程式___________ 。
Ⅱ 请回答下列问题:
(4)由磷原子核形成的三种微粒:a.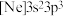 、b.
、b. 、c.
、c. ,半径由大到小的顺序为
,半径由大到小的顺序为___________ (填标号,下同);再失去一个电子所需最低能量由大到小的顺序为___________ 。
(5)比较H-O-H键角大小;H3O+___________ H2O(填“>”、“<”或“=”)。
(6)C为有机材料的主角,Si为无机材料的主角,SiC结构类似金刚石,下图为SiC的晶胞图,其中两个正方体中心重合、各面分别平行,其中心为Si原子(用•表示),试在小立方体画出相应C原子(用 表示)的位置,在大正方体画出相应Si原子(用•表示)的位置。
表示)的位置,在大正方体画出相应Si原子(用•表示)的位置。___________

(1)NOCl的电子式为
(2)下列说法正确的是___________。
| A.NOCl中的氮元素呈正价 |
| B.NOCl分子的空间结构为直线形 |
C.化合物X的沸点低于氯乙酰胺(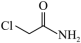 ) ) |
| D.工业上可以用蒸馏水吸收多余的NOCl,防止污染环境 |
(3)已知浓盐酸和浓硝酸混合配制王水时会产生亚硝酰氯,写出该反应的化学方程式
Ⅱ 请回答下列问题:
(4)由磷原子核形成的三种微粒:a.
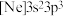 、b.
、b. 、c.
、c. ,半径由大到小的顺序为
,半径由大到小的顺序为(5)比较H-O-H键角大小;H3O+
(6)C为有机材料的主角,Si为无机材料的主角,SiC结构类似金刚石,下图为SiC的晶胞图,其中两个正方体中心重合、各面分别平行,其中心为Si原子(用•表示),试在小立方体画出相应C原子(用
 表示)的位置,在大正方体画出相应Si原子(用•表示)的位置。
表示)的位置,在大正方体画出相应Si原子(用•表示)的位置。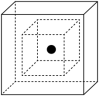
您最近一年使用:0次
解题方法
2 . A、B、C、D、E、F为短周期元素, 原子序数依次增大。非金属元素A 最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。E+与D2-具有相同的电子层结构。A单质在F单质中燃烧,产物溶于水得到一种强酸M。回答下列问题:
(1)画出E的离子结构示意图___________ 。
(2)F在周期表中的位置是___________ 。
(3)B、D、E组成的一种常见盐,其中D的质量分数约为 45%,该盐与少量M溶液反应的离子方程式为___________ 。
(4)由这些元素组成的物质,相关信息如下:
①a的电子式为___________ 。 写出其与水反应的化学方程式:___________ 。
②b的一种常见用途为___________ 。
③已知c中所有原子均满足8 电子稳定结构,该化合物的结构式为___________ 。
(1)画出E的离子结构示意图
(2)F在周期表中的位置是
(3)B、D、E组成的一种常见盐,其中D的质量分数约为 45%,该盐与少量M溶液反应的离子方程式为
(4)由这些元素组成的物质,相关信息如下:
| 物质 | 组成和结构信息 |
| a | 由 A、E组成的离子化合物 |
| b | 由D、E组成的含非极性键的离子化合物,阴阳离子数之比为1:2 |
| c | 化学式为BDF2的共价化合物 |
②b的一种常见用途为
③已知c中所有原子均满足8 电子稳定结构,该化合物的结构式为
您最近一年使用:0次
解题方法
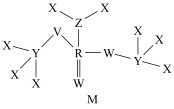
3 . X、Y、Z、W、R、V是原子序数依次增大的短周期主族元素,Y形成的一种氧化物是常见的温室气体,Z、W是空气中含量排前二的元素,W与V、Z与R均为同主族元素,六种元素形成的一种化合物M的结构如图所示。请回答下列问题:______ ;R的原子结构示意图为_______ ;Z的最简单氢化物的化学式为______ 。
(2)原子半径:Y_____ (填“>”“<”或“=”,下同)W;非金属性:V____ W;R的K层电子总数与L层电子总数之比为_____ (填最简整数比)。
(3)下列说法正确的是_______(填标号)。
(2)原子半径:Y
(3)下列说法正确的是_______(填标号)。
| A.M分子中所有原子均满足8电子稳定结构 |
| B.仅由X、Z、W元素形成的化合物可能为离子化合物 |
C.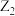 常用作保护气 常用作保护气 |
| D.R元素的氧化物对应的水化物为强酸 |
您最近一年使用:0次
2024·上海·模拟预测
4 . MnCl2溶液与 溶液混合可制备
溶液混合可制备 晶体。
晶体。
(1)基态Mn原子的电子排布式是___________ 。
(2) 的性质与卤素离子相近,被称为拟卤离子,
的性质与卤素离子相近,被称为拟卤离子, 被称为拟卤素。
被称为拟卤素。
i. 与
与 反应的生成物的结构式分别是
反应的生成物的结构式分别是 、
、___________ 。
ii. 有酸性但乙炔无明显酸性,
有酸性但乙炔无明显酸性, 的酸性比乙炔的强的原因是
的酸性比乙炔的强的原因是___________ 。
(3)为防止晶体缺陷过多,制备时反应需缓慢且平稳。先将MnCl2溶液与柠檬酸钠______________________________________________________ 。
(4)钠离子电池的正极材料 在充、放电过程中某时刻的晶胞示意图如下。
在充、放电过程中某时刻的晶胞示意图如下。 中存在的化学键有配位键、
中存在的化学键有配位键、___________ 。
②该时刻的晶胞所示的 中,
中,
___________ 。
 溶液混合可制备
溶液混合可制备 晶体。
晶体。(1)基态Mn原子的电子排布式是
(2)
 的性质与卤素离子相近,被称为拟卤离子,
的性质与卤素离子相近,被称为拟卤离子, 被称为拟卤素。
被称为拟卤素。i.
 与
与 反应的生成物的结构式分别是
反应的生成物的结构式分别是 、
、ii.
 有酸性但乙炔无明显酸性,
有酸性但乙炔无明显酸性, 的酸性比乙炔的强的原因是
的酸性比乙炔的强的原因是(3)为防止晶体缺陷过多,制备时反应需缓慢且平稳。先将MnCl2溶液与柠檬酸钠
(4)钠离子电池的正极材料
 在充、放电过程中某时刻的晶胞示意图如下。
在充、放电过程中某时刻的晶胞示意图如下。
 中存在的化学键有配位键、
中存在的化学键有配位键、②该时刻的晶胞所示的
 中,
中,
您最近一年使用:0次
5 . 下表列出了①~⑨九种元素在周期表中的位置:
(1)元素④在周期表中所处位置_______ 。
(2)按气态氢化物的稳定性由强到弱的顺序排列,④⑦⑧的氢化物稳定性:_______ (写氢化物的化学式)。
(3)元素⑤、⑥最高价氧化物对应水化物的碱性强弱为_______ (填化学式)。
(4)元素⑧的原子结构示意图是_______ 。
(5)写出元素⑤形成的单质在氧气中燃烧的化学方程式_______ 。
(6)用电子式表示⑤与⑧反应得到的化合物的形成过程_______ 。
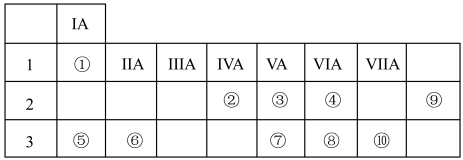
(1)元素④在周期表中所处位置
(2)按气态氢化物的稳定性由强到弱的顺序排列,④⑦⑧的氢化物稳定性:
(3)元素⑤、⑥最高价氧化物对应水化物的碱性强弱为
(4)元素⑧的原子结构示意图是
(5)写出元素⑤形成的单质在氧气中燃烧的化学方程式
(6)用电子式表示⑤与⑧反应得到的化合物的形成过程
您最近一年使用:0次
6 . 现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第4周期元素,它们的原子序数依次增大。请根据下列相关信息回答问题。
(1)B元素基态原子具有___________ 种运动状态不同的电子,能量最高的电子,其电子云在空间有___________ 个伸 展方向。
(2)根据上述信息,画出C元素基态原子的轨道表示式___________ 。
(3)F在元素周期表中属于___________ 区元素。
(4)写出DA3的电子式:___________ (用元素符号表示)。
| 元素 | 相关信息 |
| A | 元素的原子核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p电子数比s电子数少1 |
| C | 元素的第一至第四电离能分别是I1=738 kJ/mol、I2=1451 kJ/mol、I3= 7733 kJ/mol、I4= 10540 kJ/mol |
| D | 原子核外填充电子的所有p轨道全满或半满 |
| E | 元素的主族序数与周期序数的差为3 |
| F | 在元素周期表的第6列 |
(2)根据上述信息,画出C元素基态原子的轨道表示式
(3)F在元素周期表中属于
(4)写出DA3的电子式:
您最近一年使用:0次
解题方法
7 . 碳、氮和硅是自然界中大量存在的元素,硅及其化合物是工业上最重要的材料。设 代表阿伏加德罗常数的值。粗硅的制备方法有两种:
代表阿伏加德罗常数的值。粗硅的制备方法有两种:
方法一: 方法二:
方法二:
(1)基态Si原子中存在___________ 对自旋状态相反的电子,基态Mg原子的最外层电子的电子云轮廓图是___________ 。
(2)上述2个反应中,涉及的所有元素中第一电离能最小的是___________ (填元素符号)。
(3)金刚石、晶体硅(Si)、 三种晶体的熔点由高到低的顺序
三种晶体的熔点由高到低的顺序___________ 。
(4)①NH3分子的空间构型是___________ 。
②化合物NF3沸点为-129 ℃,则其晶体类型为___________ 。___________ 。
④其中C、N、O三种元素的电负性由大到小顺序是___________ 。
(5)①肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子的电子式为___________ 。
②肼可用作火箭燃料,肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在___________ 。(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
 代表阿伏加德罗常数的值。粗硅的制备方法有两种:
代表阿伏加德罗常数的值。粗硅的制备方法有两种:方法一:
 方法二:
方法二:
(1)基态Si原子中存在
(2)上述2个反应中,涉及的所有元素中第一电离能最小的是
(3)金刚石、晶体硅(Si)、
 三种晶体的熔点由高到低的顺序
三种晶体的熔点由高到低的顺序(4)①NH3分子的空间构型是
②化合物NF3沸点为-129 ℃,则其晶体类型为
已知尿素的结构式为: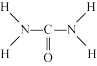 。
。
④其中C、N、O三种元素的电负性由大到小顺序是
(5)①肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子的电子式为
②肼可用作火箭燃料,肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在
a.离子键 b.共价键 c.配位键 d.范德华力
您最近一年使用:0次
名校
8 . 现有五种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)A和B形成的最简单化合物为________ 化合物(填“离子”或“共价”),写出其电子式:________________ 。
(2)D元素基态原子中能量最高的原子轨道呈________________ 形。
(3)比较B元素和C元素第一电离能大小(用元素符号表示):_________________ ,并解释原因:________________ 。
(4)某同学推断E基态原子电子排布式为1s22s22p63s23p7,该式违背了________________ 。
(5)F位于第________________ 族、________________ 区,该元素原子的简化电子排布式为________________ 。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C元素原子核外有2个未成对电子 |
D元素的第一至第五电离能如下:
|
E是前四周期中电负性最小的元素 |
F在周期表的第七列 |
(2)D元素基态原子中能量最高的原子轨道呈
(3)比较B元素和C元素第一电离能大小(用元素符号表示):
(4)某同学推断E基态原子电子排布式为1s22s22p63s23p7,该式违背了
(5)F位于第
您最近一年使用:0次
名校
解题方法
9 . 现有A、B、C、D、E五种元素,它们的核电荷数依次增多。
①A的核电荷数大于2,可形成氢化物 ,该氢化物在常温下是液体;
,该氢化物在常温下是液体;
②A和B两元素可形成化合物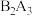 ,该化合物既能溶于强酸溶液,又能溶于强碱溶液;
,该化合物既能溶于强酸溶液,又能溶于强碱溶液;
③ 比
比 多8个电子;
多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为 。
。
试回答下列问题:
(1)A是_____ (写元素符号,下同), 分子的空间结构为
分子的空间结构为_____________ 。
(2)B的离子结构示意图为_______ ,C元素最高价氧化物对应的水化物的电子式为_________ ,D的原子的电子排布式为___________ 。
(3)用电子式表示 的形成过程:
的形成过程:______________ 。
(4)写出CD的溶液中通入氯气的离子方程式:_____________ 。
(5)比较B、C、E三种元素形成的简单离子半径由小到大的顺序(B、C、E离子用实际离子符号表示):_____________ 。
①A的核电荷数大于2,可形成氢化物
 ,该氢化物在常温下是液体;
,该氢化物在常温下是液体;②A和B两元素可形成化合物
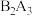 ,该化合物既能溶于强酸溶液,又能溶于强碱溶液;
,该化合物既能溶于强酸溶液,又能溶于强碱溶液;③
 比
比 多8个电子;
多8个电子;④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为
 。
。试回答下列问题:
(1)A是
 分子的空间结构为
分子的空间结构为(2)B的离子结构示意图为
(3)用电子式表示
 的形成过程:
的形成过程:(4)写出CD的溶液中通入氯气的离子方程式:
(5)比较B、C、E三种元素形成的简单离子半径由小到大的顺序(B、C、E离子用实际离子符号表示):
您最近一年使用:0次
10 . 已知 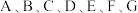 是原子序数依次递增的短周期元素,已知 A和
是原子序数依次递增的短周期元素,已知 A和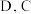 和
和  为同一主族元素,A与
为同一主族元素,A与 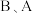 与
与  形成共价化合物,B原子的最外层电子数比次外层多3,
形成共价化合物,B原子的最外层电子数比次外层多3, 元素的最高正化合价与最低负化合价的代数和为6,
元素的最高正化合价与最低负化合价的代数和为6, 是同周期中离子半径最小的元素,
是同周期中离子半径最小的元素, 形成的化合物是造成酸雨的主要原因。请回答下列问题:
形成的化合物是造成酸雨的主要原因。请回答下列问题:
(1)七种元素中,非金属性最强的元素在周期表中的位置是_____________ ,画出其原子结构示意图:_________________ .
(2)元素 的简单离子的半径由小到大的顺序为
的简单离子的半径由小到大的顺序为_____________________________ 。
(3)元素B的最低价氢化物的电子式为_____________________ 。
(4)由 所形成的常见离子化合物是
所形成的常见离子化合物是_____________ (写化学式),其所含化学键类型为_____________ 。
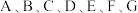 是原子序数依次递增的短周期元素,已知 A和
是原子序数依次递增的短周期元素,已知 A和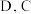 和
和  为同一主族元素,A与
为同一主族元素,A与 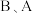 与
与  形成共价化合物,B原子的最外层电子数比次外层多3,
形成共价化合物,B原子的最外层电子数比次外层多3, 元素的最高正化合价与最低负化合价的代数和为6,
元素的最高正化合价与最低负化合价的代数和为6, 是同周期中离子半径最小的元素,
是同周期中离子半径最小的元素, 形成的化合物是造成酸雨的主要原因。请回答下列问题:
形成的化合物是造成酸雨的主要原因。请回答下列问题:(1)七种元素中,非金属性最强的元素在周期表中的位置是
(2)元素
 的简单离子的半径由小到大的顺序为
的简单离子的半径由小到大的顺序为(3)元素B的最低价氢化物的电子式为
(4)由
 所形成的常见离子化合物是
所形成的常见离子化合物是
您最近一年使用:0次