名校
解题方法
1 . 卤族元素相关物质在生产、生活中应用广泛。回答下列问题:
(1) 的离子结构示意图为
的离子结构示意图为______ 。
(2)卤素单质有着相似的化学性质,但同时也有差别。比如 与NaOH反应生成NaCl、NaClO和水,而
与NaOH反应生成NaCl、NaClO和水,而 与NaOH发生如下反应:
与NaOH发生如下反应: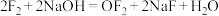 。其中
。其中 的电子式为
的电子式为______ ,用电子式描述NaF的形成过程:______ 。
(3)根据卤族元素性质的相似性和递变性,推测元素砹(At)的单质为有色固体,HAt的稳定性______ (填“大于”或“小于”)HI的稳定性,AgAt______ (填“易”或“难”)溶于水。
(4)不同卤素原子之间以共价键相结合形成的化合物称为卤素互化物,如 等。它们与卤素单质性质相似。
等。它们与卤素单质性质相似。
① 与水反应的产物可能为
与水反应的产物可能为______ (填化学式)。
②下列说法不正确的是______ 。
A.HF、HCl、HBr的沸点依次升高
B. 沸点依次升高
沸点依次升高
C.已知离子半径大小会影响离子键的强弱,从而影响物质的熔点:若离子半径越大,离子键越弱。据此推测NaF、NaCl、NaBr熔点依次降低
D. (X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(1)
 的离子结构示意图为
的离子结构示意图为(2)卤素单质有着相似的化学性质,但同时也有差别。比如
 与NaOH反应生成NaCl、NaClO和水,而
与NaOH反应生成NaCl、NaClO和水,而 与NaOH发生如下反应:
与NaOH发生如下反应: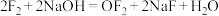 。其中
。其中 的电子式为
的电子式为(3)根据卤族元素性质的相似性和递变性,推测元素砹(At)的单质为有色固体,HAt的稳定性
(4)不同卤素原子之间以共价键相结合形成的化合物称为卤素互化物,如
 等。它们与卤素单质性质相似。
等。它们与卤素单质性质相似。①
 与水反应的产物可能为
与水反应的产物可能为②下列说法不正确的是
A.HF、HCl、HBr的沸点依次升高
B.
 沸点依次升高
沸点依次升高C.已知离子半径大小会影响离子键的强弱,从而影响物质的熔点:若离子半径越大,离子键越弱。据此推测NaF、NaCl、NaBr熔点依次降低
D.
 (X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
您最近一年使用:0次
2024-04-04更新
|
191次组卷
|
2卷引用:四川省广安市华蓥中学2023-2024学年高二下学期3月月考化学试题
2 . 氢键的概念及表示方法
(1)概念:氢键是由已经与电负性很大的原子形成共价键的______ (如水分子中的氢)与另一个电负性很大的原子(如水分子中的氧)之间的作用力。
(2)表示方法:氢键的通式可用X—H…Y—表示。式中X和Y表示___________ ,“—”表示__________ ,“…”表示________ 。
(1)概念:氢键是由已经与电负性很大的原子形成共价键的
(2)表示方法:氢键的通式可用X—H…Y—表示。式中X和Y表示
您最近一年使用:0次
3 . 完成下列问题
(1)下列化学用语只能用来表示一种微粒的是______
(2)下列叙述中所描述的物质一定是金属元素的是______
(3)下列说法正确的是______
(4)X、Y、Z、W是原子序数依次增大的短周期元素。W与X位于同一主族;X、Y、Z三种元素形成的化合物具有强氧化性,其结构如下图所示;。
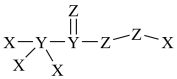
下列叙述错误的是______
(5)锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶(SrCO3)是制取锶的原料,用天青石固体(主要成分SrSO4,难溶于水)和Na2CO3溶液混合浸泡可制取碳酸锶。完成下列填空:
①在上述反应体系中出现的几种短周期元素中,原子半径最大的是___________ (填元素符号,下同)。非金属性最强的是___________ 。写出与锶同族第3周期元素原子的结构示意图___________ 。
②反应体系中出现的非金属元素可形成二硫化碳(CS2),其分子构型是直线型分子,写出该分子的电子式___________ 。
③已知:锶的原子序数为38,某锶原子的质量数为88,写出能包含这些信息的一种化学符号___________ 。下列关于锶及其化合物的叙述中,错误的是___________ 。
a.锶的金属性比镁强 b.氢氢化锶呈两性
c.锶在化合物中呈+2价 d.锶在自然界中以游离态存在
(1)下列化学用语只能用来表示一种微粒的是______
| A.S | B.C2H6O | C.12C | D.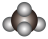 |
(2)下列叙述中所描述的物质一定是金属元素的是______
| A.易失去电子的物质 | B.第三周期中,原子的最外电子层只有2个电子的元素 |
| C.单质具有金属光泽的元素 | D.原子的最外电子层只有1个电子的元素 |
(3)下列说法正确的是______
| A.H2O、H2S、H2Se的分子间作用力依次增大 |
| B.Na2O2、MgCl2、NaOH、NH4Cl均为含共价键的离子化合物 |
| C.化学键通常指的是相邻的原子或离子之间的强烈的相互作用 |
| D.NaHSO4加热熔化时破坏了该物质中的离子键和共价键 |
(4)X、Y、Z、W是原子序数依次增大的短周期元素。W与X位于同一主族;X、Y、Z三种元素形成的化合物具有强氧化性,其结构如下图所示;。
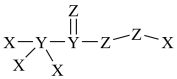
下列叙述错误的是______
| A.该化合物中各元素原子均达稳定结构 |
| B.Z的氢化物的沸点可能高于Y的氢化物 |
| C.Z、W形成的简单离子半径,Z大于W |
| D.由X、Y、Z、W四种元素形成的化合物一定能与X、Z、W形成的化合物反应 |
(5)锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶(SrCO3)是制取锶的原料,用天青石固体(主要成分SrSO4,难溶于水)和Na2CO3溶液混合浸泡可制取碳酸锶。完成下列填空:
①在上述反应体系中出现的几种短周期元素中,原子半径最大的是
②反应体系中出现的非金属元素可形成二硫化碳(CS2),其分子构型是直线型分子,写出该分子的电子式
③已知:锶的原子序数为38,某锶原子的质量数为88,写出能包含这些信息的一种化学符号
a.锶的金属性比镁强 b.氢氢化锶呈两性
c.锶在化合物中呈+2价 d.锶在自然界中以游离态存在
您最近一年使用:0次
4 . 最早的球棒分子模型是由德国化学家奥古斯特·威廉·冯·霍夫曼所作,目的是用来讲课。下图表示四种烷烃分子,下列说法不正确 的是
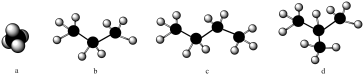
| A.a是甲烷的填充模型 |
| B.c和d互为同分异构体,物理性质和化学性质均相同 |
| C.b中含有极性共价键和非极性共价键 |
| D.c是b的同系物 |
您最近一年使用:0次
2023-08-28更新
|
358次组卷
|
3卷引用:2.1.1 烷烃的结构和性质 随堂练习
名校
解题方法
5 . 化合物X是一种维生素,对维持人体基本机能具有重要作用。化合物X由元素A、D、E、G、M、Q组成,它们是原子序数依次增大的前四周期元素,相关信息如下:
(1)A的元素符号为___________ 。
(2)D在元素周期表中的位置为___________ 。
(3)第一电离能:E>G,从基态原子的核外电子排布角度解释原因:___________ 。
(4)E、M的最高价氧化物对应的水化物的酸性:E___________ M(填“>”或“<”),并从元素周期律角度解释原因:___________ 。
(5)Q处于元素周期表中的___________ 区(填“s”“p”“d”或“ds”),基态Q3+的价电子排布式为___________ 。
| 元素 | 信息 |
| A | 核外电子只有一种自旋取向 |
| D | 基态原子价电子排布式为nsnnpn |
| E | 基态原子中的未成对电子数是同周期中最多的 |
| G | 基态原子有8个不同运动状态的电子 |
| M | 与E互为同主族元素 |
| Q | 在化合物X中呈+3价,Q3+与Fe2+具有相同的核外电子排布 |
(2)D在元素周期表中的位置为
(3)第一电离能:E>G,从基态原子的核外电子排布角度解释原因:
(4)E、M的最高价氧化物对应的水化物的酸性:E
(5)Q处于元素周期表中的
您最近一年使用:0次
2023-07-12更新
|
230次组卷
|
3卷引用:北京市海淀区2022-2023学年高二下学期7月期末考试化学试题
6 . 以下模型能够解释多电子原子光谱复杂现象的是
| A.“葡萄干布丁”模型 | B.核式模型 |
| C.玻尔原子结构模型 | D.量子力学模型 |
您最近一年使用:0次
2023·广东·二模
解题方法
7 . 聚四氟乙烯被称为“塑料王”,其合成路线如图(已知Sb为第五周期第VA族元素)。
CHCl3 CHClF2
CHClF2 CF2=CF2
CF2=CF2
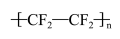
下列说法正确的是
CHCl3
 CHClF2
CHClF2 CF2=CF2
CF2=CF2
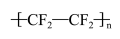
下列说法正确的是
A.CHCl3的电子式为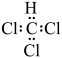 |
B.四氟乙烯分子的球棍模型为 |
| C.CHClF2不存在同分异构体 |
| D.基态Sb原子的价层电子的轨道表示式为5s25p3 |
您最近一年使用:0次
名校
8 . 次氯酸可以和丙烯发生加成反应CH3CH=CH2+HClO→CH3CH(OH)CH2Cl,以CH3CH(OH)CH2Cl为原料可以合成CH3CH(OH)COOH,进一步合成新型降解材料聚乳酸。下列化学用语表示正确的是
A.原子核内有8个中子的碳原子: | B.丙烯分子的球棍模型: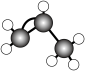 |
C.次氯酸的电子式: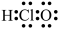 | D.聚乳酸的结构简式: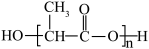 |
您最近一年使用:0次
名校
解题方法
9 . 原子结构与化学键
人们运用化学科学,从分子、原子水平上研究了物质及其变化规律。原子结构理论和化学键理论从微观层次揭示了物质的结构。
(1)日本的福岛核废水中含有一种对环境有害的放射性核素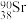 ,关于该核素说法错误是___________。
,关于该核素说法错误是___________。
(2)硒是人体必需的微量元素,如图是元素硒的信息,关于硒元素的说法错误的是___________。

(3)下列性质的比较,不能用元素周期律解释的是___________。
(4)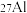 是地壳中最丰富的金属元素,其原子含有中子数为
是地壳中最丰富的金属元素,其原子含有中子数为___________ ,与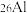 互为
互为___________ 。用化学符号表示铝离子的结构示意图___________ 。A1与 两种微粒在结构上相同的是
两种微粒在结构上相同的是___________ (填选项字母)。
A.质子数 B.核外电子数 C.电子层数 D.最外层电子数
(5)汽车安全气囊中的填充物有 (叠氮酸钠)、
(叠氮酸钠)、 、
、 等物质,
等物质, 遇撞击时能生成金属钠和
遇撞击时能生成金属钠和 ,气囊的体积迅速膨胀,达到保护驾乘人员的目的。
,气囊的体积迅速膨胀,达到保护驾乘人员的目的。
①写出 的电子式
的电子式___________ 。
② 是由一种单原子离子和一种多原子离子以1∶1的比例构成的化合物。
是由一种单原子离子和一种多原子离子以1∶1的比例构成的化合物。 晶体中存在的化学键类型是
晶体中存在的化学键类型是___________ 。
③汽车安全气囊填充物的三种物质中属于共价化合物的是___________ (填化学式),所涉及的5种元素中,原子半径最大的是___________ (填元素符号)。
④某品牌汽车的安全气囊中若有13g ,遇撞击时能产生气体
,遇撞击时能产生气体___________ L(标准状况下),转移电子___________ mol。
(6) 、
、 能与金属钠发生反应生成
能与金属钠发生反应生成 ,化学方程式如下所示:
,化学方程式如下所示:
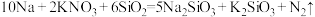
①用单线桥法在上述的化学方程式中标出电子转移的方向和数目___________ 。
②上述反应中氧化剂是___________ (填写化学式,下同),氧化产物是___________ 。
人们运用化学科学,从分子、原子水平上研究了物质及其变化规律。原子结构理论和化学键理论从微观层次揭示了物质的结构。
(1)日本的福岛核废水中含有一种对环境有害的放射性核素
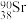 ,关于该核素说法错误是___________。
,关于该核素说法错误是___________。A.与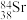 的化学性质几乎相同 的化学性质几乎相同 | B.中子数与质子数之差为52 |
C.与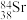 互为同位素 互为同位素 | D.Sr在元素周期表中位于ⅡA族 |

| A.位于ⅥA族 | B.质量数为34 |
| C.位于第四周期 | D.相对原子质量为78.96 |
| A.非金属性:F>O>N |
| B.碱性:KOH>NaOH>LiOH |
C.热稳定性: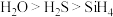 |
D.酸性: |
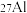 是地壳中最丰富的金属元素,其原子含有中子数为
是地壳中最丰富的金属元素,其原子含有中子数为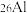 互为
互为 两种微粒在结构上相同的是
两种微粒在结构上相同的是A.质子数 B.核外电子数 C.电子层数 D.最外层电子数
(5)汽车安全气囊中的填充物有
 (叠氮酸钠)、
(叠氮酸钠)、 、
、 等物质,
等物质, 遇撞击时能生成金属钠和
遇撞击时能生成金属钠和 ,气囊的体积迅速膨胀,达到保护驾乘人员的目的。
,气囊的体积迅速膨胀,达到保护驾乘人员的目的。①写出
 的电子式
的电子式②
 是由一种单原子离子和一种多原子离子以1∶1的比例构成的化合物。
是由一种单原子离子和一种多原子离子以1∶1的比例构成的化合物。 晶体中存在的化学键类型是
晶体中存在的化学键类型是③汽车安全气囊填充物的三种物质中属于共价化合物的是
④某品牌汽车的安全气囊中若有13g
 ,遇撞击时能产生气体
,遇撞击时能产生气体(6)
 、
、 能与金属钠发生反应生成
能与金属钠发生反应生成 ,化学方程式如下所示:
,化学方程式如下所示: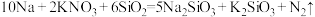
①用单线桥法在上述的化学方程式中标出电子转移的方向和数目
②上述反应中氧化剂是
您最近一年使用:0次
10 . 氢氟酸是芯片加工的重要试剂,可通过反应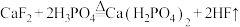 制取。下列说法正确的是
制取。下列说法正确的是
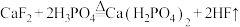 制取。下列说法正确的是
制取。下列说法正确的是A.基态 原子的电子排布式为 原子的电子排布式为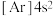 | B. 的电子式为 的电子式为 |
C.中子数为15的P可以表示为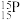 | D. 的电离方程式为 的电离方程式为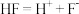 |
您最近一年使用:0次
2023-03-09更新
|
346次组卷
|
2卷引用:湖北省部分普通高中联盟2022-2023学年高二下学期期中联考化学试题



