22-23高一上·浙江·期末
名校
1 . A、B、X、Y、Z和R是原子序数依次递增的短周期元素,其中A与Y同主族,X与R同主族,A与B、X均可形成10个电子化合物;B与R的最外层电子数之比为2:3;Z的最外层电子数与其电子层数相等,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。
回答下列问题:
(1)X元素在周期表中的位置是_______ ;化合物Y2X2的电子式为_______ ;X、Y、Z、R形成的简单离子的半径大小顺序是_______ (用离子符号表示);
(2)X和R的氢化物中,沸点更高的是_______ (填化学式),原因是_______ 。
(3)Z单质与Y的最高价氧化物的水化物反应的离子方程式为_______ ;
(4)由A、X、Y、R组成的两种盐(均含有以上四种元素)的溶液反应可产生RX2气体,写出其反应的离子方程式_______ 。
回答下列问题:
(1)X元素在周期表中的位置是
(2)X和R的氢化物中,沸点更高的是
(3)Z单质与Y的最高价氧化物的水化物反应的离子方程式为
(4)由A、X、Y、R组成的两种盐(均含有以上四种元素)的溶液反应可产生RX2气体,写出其反应的离子方程式
您最近一年使用:0次
解题方法
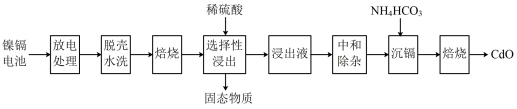
2 . 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知镍镉电池的电池总反应为: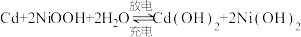 ,利用废旧镍镉电池回收铬的流程如下:
,利用废旧镍镉电池回收铬的流程如下:
已知:中和除杂后的溶液中主要含有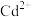 、
、 、
、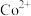 。
。
回答下列问题:
(1)NiOOH中,Ni的化合价为:______ 。
(2)写出“焙烧”过程中含镍物质变化的化学反应方程式:______ 。
(3)在“选择性浸出”一步中,40℃时,不同的金属氧化物在稀 中2小时后的浸出率随PH的变化如下图1所示,则:
中2小时后的浸出率随PH的变化如下图1所示,则:

①“选择性浸出”时,最适宜的pH为______ (填选项字母),写出在此pH下发生的主要离子方程式:______ 。
A.5 B.4 C.3 D.2
②浸出液中各元素含量如表1所示。Co的浓度比镍还小的原因可能是:______ 。
表1 浸出液组成
(4)沉铬时生成 的离子反应方程式:
的离子反应方程式:______ 。
(5)镍铬电池充电时, 移向
移向______ (填“明极”或“阳极”),写出阳极的电极反应式:______ 。
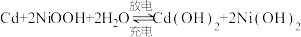 ,利用废旧镍镉电池回收铬的流程如下:
,利用废旧镍镉电池回收铬的流程如下:
已知:中和除杂后的溶液中主要含有
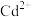 、
、 、
、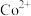 。
。回答下列问题:
(1)NiOOH中,Ni的化合价为:
(2)写出“焙烧”过程中含镍物质变化的化学反应方程式:
(3)在“选择性浸出”一步中,40℃时,不同的金属氧化物在稀
 中2小时后的浸出率随PH的变化如下图1所示,则:
中2小时后的浸出率随PH的变化如下图1所示,则:
①“选择性浸出”时,最适宜的pH为
A.5 B.4 C.3 D.2
②浸出液中各元素含量如表1所示。Co的浓度比镍还小的原因可能是:
| 元素Elements | Cd | Ni | Co | Fe |
浓度(Concentrations/( ) ) | 77.5 | 2.61 | 0.406 | 0.176 |
表1 浸出液组成
(4)沉铬时生成
 的离子反应方程式:
的离子反应方程式:(5)镍铬电池充电时,
 移向
移向
您最近一年使用:0次
2022-08-18更新
|
155次组卷
|
2卷引用:贵州省遵义市新高考协作体2022-2023学年高三上学期入学质量检测理综化学试题
21-22高一·全国·假期作业
名校
解题方法
3 . 下图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系。(反应中生成的水已略去):

请回答以下问题:
(1)B是_______ ,D是_______ ,G是_______ ,H是_______ (填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式为:_______ 。漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学方程式为_______ 。
(3)A中元素的原子结构示意图为_______ 。

请回答以下问题:
(1)B是
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式为:
(3)A中元素的原子结构示意图为
您最近一年使用:0次
解题方法
4 . 元素周期表的形式多种多样,扇形元素周期表的一部分(1~36号元素)如图所示,对比中学常见的元素周期表,思考扇形元素周期表的填充规律。请用准确的化学符号和用语 回答下列问题:

(1)元素1在元素周期表中的位置_______ 。
(2)比较f、o、k简单离子的半径,由大到小的顺序是_______ (用离子符号表示)。
(3)b与e组成的化合物中,含有非极性共价键的化合物的电子式_______ 。
(4)i的最高价氧化物对应水化物的化学式_______ ,比较i、d最简单氢化物的稳定性_______ (用化学式表示)。
(5)比较m、f、g的金属性强弱,由强到弱的顺序是_______ (用元素符号表示)
(6)比较j和h的非金属性强弱,设计简单的实验方案_______ 。

(1)元素1在元素周期表中的位置
(2)比较f、o、k简单离子的半径,由大到小的顺序是
(3)b与e组成的化合物中,含有非极性共价键的化合物的电子式
(4)i的最高价氧化物对应水化物的化学式
(5)比较m、f、g的金属性强弱,由强到弱的顺序是
(6)比较j和h的非金属性强弱,设计简单的实验方案
您最近一年使用:0次
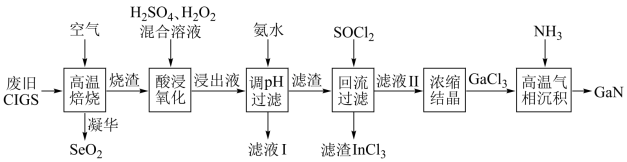
5 . 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为 。某探究小组回收处理流程如图:
。某探究小组回收处理流程如图:
回答下列问题:
(1)硒(Se)与硫为同族元素,Se的最外层电子数为_______ ;在化合物 中镓(Ga)和铟(In)均为+3价,则Cu的化合价为
中镓(Ga)和铟(In)均为+3价,则Cu的化合价为_______ 。
(2)“酸浸氧化”得蓝色溶液,则该过程发生的主要氧化还原反应的化学方程式为_______ 。
(3)氢氧化铜沉淀可溶于氨水,则滤液I中的阴离子主要有_______ 和_______ 两种。
(4)滤渣加入 混合前需要洗涤、干燥,并用试剂
混合前需要洗涤、干燥,并用试剂_______ 和_______ 来检验滤渣中的 是否洗净。
是否洗净。
(5)滤渣加入 可反生反应:
可反生反应: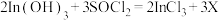 ;对物质X的性质有如下判断,你认为不正确的是 。
;对物质X的性质有如下判断,你认为不正确的是 。
(6)“高温气相沉积”过程中发生的化学反应方程式为_______ 。
 。某探究小组回收处理流程如图:
。某探究小组回收处理流程如图:
回答下列问题:
(1)硒(Se)与硫为同族元素,Se的最外层电子数为
 中镓(Ga)和铟(In)均为+3价,则Cu的化合价为
中镓(Ga)和铟(In)均为+3价,则Cu的化合价为(2)“酸浸氧化”得蓝色溶液,则该过程发生的主要氧化还原反应的化学方程式为
(3)氢氧化铜沉淀可溶于氨水,则滤液I中的阴离子主要有
(4)滤渣加入
 混合前需要洗涤、干燥,并用试剂
混合前需要洗涤、干燥,并用试剂 是否洗净。
是否洗净。(5)滤渣加入
 可反生反应:
可反生反应: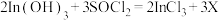 ;对物质X的性质有如下判断,你认为不正确的是 。
;对物质X的性质有如下判断,你认为不正确的是 。| A.有弱酸性 | B.可使溴水褪色 |
C.与 溶液反应得白色沉淀 溶液反应得白色沉淀 | D.与烧碱溶液反应可生成两种盐 |
您最近一年使用:0次
2022-05-13更新
|
240次组卷
|
3卷引用:湖北省鄂州市部分高中教科研协作体2021-2022学年高一下学期期中考试化学试题
湖北省鄂州市部分高中教科研协作体2021-2022学年高一下学期期中考试化学试题(已下线)第13练 自然资源的开发利用-2022年【暑假分层作业】高一化学(人教版2019必修第二册)广东省实验中学2023-2024学年高三上学期第一次阶段考试化学试题
2022高三·全国·专题练习
解题方法
6 . 从木姜子中提取的化合物K具有抗肿瘤活性,下列为K的人工合成路线。

已知:格氏反应:R1X+R2MgX→R1-R2+MgX2(X为卤素原子)
回答下列问题:
(1)A的分子式为_______ 。
(2)TBSCl在此合成中作用是_______ 。
(3)F的结构简式为_______ ,H中的R基团的化学式为_______ 。
(4)化合物K中有_______ 个手性碳原子。
(5)E的同系物分子式为C7H12O,其核磁共振氢谱峰面积比为4∶4∶2∶1∶1,写出该化合物的结构简式_______ 。
(6)反应⑧的反应类型为_______ 。
(7)设计由CH3CH2OH制备CH3(CH2)4CH3的合成路线_______ 。(无机试剂任选)

已知:格氏反应:R1X+R2MgX→R1-R2+MgX2(X为卤素原子)
回答下列问题:
(1)A的分子式为
(2)TBSCl在此合成中作用是
(3)F的结构简式为
(4)化合物K中有
(5)E的同系物分子式为C7H12O,其核磁共振氢谱峰面积比为4∶4∶2∶1∶1,写出该化合物的结构简式
(6)反应⑧的反应类型为
(7)设计由CH3CH2OH制备CH3(CH2)4CH3的合成路线
您最近一年使用:0次
7 . 3D打印对钛粉末的要求很高。熔盐电解精炼是制取钛粉的有效途径。精炼时一般采用等摩尔比的KCl-NaCl熔盐,其中含有一定浓度的低价氯化钛(TiClx,x=2、3)。(已知:①熔盐中Ti3+少,Ti2+多熔盐电解精炼制得的钛粉颗粒相对粗大;②钛的熔点为1668℃,TiCl4熔点-24. 1℃、沸点136. 4℃)。
(1)精炼时,粗品质的海绵钛、废钛材等做电解池的_______ 极。
(2)采用海绵钛与TiCl4制取低价钛离子的电解质熔盐时,熔盐中存下如下4个反应:
ⅰ.3Ti4++Ti0→4Ti3+△H1
ⅱ.Ti4++Ti0→2Ti2+△H2
ⅲ.Ti4++Ti2+→2Ti3+△H3
ⅳ._______ △H4
①反应ⅳ的化学方程式为_______ 。
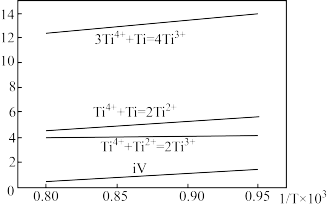
②上述4个反应的平衡常数与温度的关系如下图。由此可知△H1_______ 3△H2(填“>”、“<”或“=”)。
③有助于制取低价钛离子的电解质熔盐的措施为_______ 。
(3)向下图装置中加入海绵钛,从石英管中缓慢加入a mol TiCl4,恒温条件下进行反应。
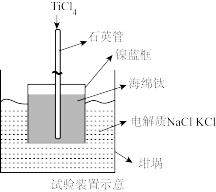
①平衡时,测得消耗海绵钛及TiCl4的物质的量分别为b mol、c mol。熔盐中低价钛离子的平均价态为_______ 。
②用各离子的物质的量分数表示平衡浓度,则反应ⅲ的平衡常数K3=_______ 。
③若向此平衡体系中继续注入TiCl4,则再次平衡后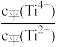
_______ (填“增大”、“减小”或“不变”)
(4)电解精炼制钛粉,偶尔会得到一些相对粗大的钛粉颗粒而影响产品质量,请分析产生的原因_______ (写出1条原因,合理即可。)
(1)精炼时,粗品质的海绵钛、废钛材等做电解池的
(2)采用海绵钛与TiCl4制取低价钛离子的电解质熔盐时,熔盐中存下如下4个反应:
ⅰ.3Ti4++Ti0→4Ti3+△H1
ⅱ.Ti4++Ti0→2Ti2+△H2
ⅲ.Ti4++Ti2+→2Ti3+△H3
ⅳ._______ △H4
①反应ⅳ的化学方程式为
②上述4个反应的平衡常数与温度的关系如下图。由此可知△H1

③有助于制取低价钛离子的电解质熔盐的措施为
(3)向下图装置中加入海绵钛,从石英管中缓慢加入a mol TiCl4,恒温条件下进行反应。

①平衡时,测得消耗海绵钛及TiCl4的物质的量分别为b mol、c mol。熔盐中低价钛离子的平均价态为
②用各离子的物质的量分数表示平衡浓度,则反应ⅲ的平衡常数K3=
③若向此平衡体系中继续注入TiCl4,则再次平衡后
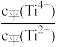
(4)电解精炼制钛粉,偶尔会得到一些相对粗大的钛粉颗粒而影响产品质量,请分析产生的原因
您最近一年使用:0次
名校
8 . 锌锰废电池中的碳包含碳粉、Fe,Cu、Ag和 等物质,从中回收
等物质,从中回收 的工艺流程如图。
的工艺流程如图。_______ 。
(2)“灼烧”的目的是为了除去_______ 。
(3) 的电子式为
的电子式为_______ ,分子中含有的化学键类型为_______ 。
(4)“还原”过程中, 溶解的离子方程式为
溶解的离子方程式为_______ ;溶解一定量的 ,
, 的实际消耗量比理论值高的原因
的实际消耗量比理论值高的原因_______ 。
(5)“沉淀”过程中,需缓慢滴加溶液 溶液(pH约为12),过滤,得滤渣X,其主要成分为
溶液(pH约为12),过滤,得滤渣X,其主要成分为 。若改变滴加顺序,改为“向
。若改变滴加顺序,改为“向 中缓慢滴加还原所得溶液”,滤渣X中会混有较多
中缓慢滴加还原所得溶液”,滤渣X中会混有较多_______ 杂质。
(6)普通锌锰干电池的构造如图所示,其电池反应的方程式为: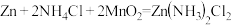
 。电池工作时:
。电池工作时:_______ (填“正极”或“负极”)。
②电池工作时, 向
向_______ 方向移动(填“石墨棒”或“锌筒”)。
③电池内每消耗1.3g锌,若电流效率为80%,则外电路通过的电子数为_______ 。
 等物质,从中回收
等物质,从中回收 的工艺流程如图。
的工艺流程如图。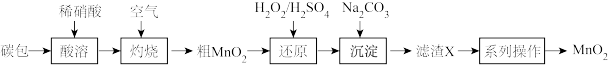
(2)“灼烧”的目的是为了除去
(3)
 的电子式为
的电子式为(4)“还原”过程中,
 溶解的离子方程式为
溶解的离子方程式为 ,
, 的实际消耗量比理论值高的原因
的实际消耗量比理论值高的原因(5)“沉淀”过程中,需缓慢滴加溶液
 溶液(pH约为12),过滤,得滤渣X,其主要成分为
溶液(pH约为12),过滤,得滤渣X,其主要成分为 。若改变滴加顺序,改为“向
。若改变滴加顺序,改为“向 中缓慢滴加还原所得溶液”,滤渣X中会混有较多
中缓慢滴加还原所得溶液”,滤渣X中会混有较多(6)普通锌锰干电池的构造如图所示,其电池反应的方程式为:
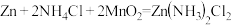
 。电池工作时:
。电池工作时:
②电池工作时,
 向
向③电池内每消耗1.3g锌,若电流效率为80%,则外电路通过的电子数为
您最近一年使用:0次
2022-04-23更新
|
369次组卷
|
2卷引用:福建省厦门双十中学2021-2022学年高一下学期期中考试化学试题
9 . 可用“沉淀法”除去粗盐中的 、
、 、
、 杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
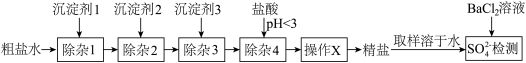
(1)实验1中加入沉淀剂3后会生成_______ (填化学式)。
(2)“除杂4”发生反应的离子方程式有_______ 。
(3)“操作X”为_______ 。
(4)查阅资料:难溶电解质的溶解度会受到溶液中其它离子的影响。加入与难溶电解质相同离子的电解质,因“同离子效应”溶解度降低;加入与难溶电解质不同离子的电解质,因“盐效应”溶解度增大。
①提出假设:
②设计实验:探究不同试剂对硫酸钡溶解度的影响程度
“滤液处理”需用到的试剂有_______ 。
③实验分析:实验3中 溶液的用量为理论值的1.5倍,最后仍检出
溶液的用量为理论值的1.5倍,最后仍检出 的原因是该体系中“同离子效应”
的原因是该体系中“同离子效应”_______ “盐效应”(填“大于”或“小于”)。
④实验结论:粗盐提纯时,为了有效降低产品中 含量,必须
含量,必须_______ 。
 、
、 、
、 杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
| 沉淀剂1 | 沉淀剂1 | 沉淀剂1 | 过滤方式 |  检测结果 检测结果 | |
| 实验1 |  溶液 溶液 | NaOH溶液 |  溶液 溶液 | 逐一过滤 | 少量浑浊 |
| 实验2 |  溶液 溶液 |  溶液 溶液 | NaOH溶液 | 逐一过滤 | 少量浑浊 |
| 实验3 | NaOH溶液 |  溶液 溶液 |  溶液 溶液 | 逐一过滤 | 大量沉淀 |
| 实验4 |  溶液 溶液 | NaOH溶液 |  溶液 溶液 | 一起过滤 | 大量沉淀 |
(2)“除杂4”发生反应的离子方程式有
(3)“操作X”为
(4)查阅资料:难溶电解质的溶解度会受到溶液中其它离子的影响。加入与难溶电解质相同离子的电解质,因“同离子效应”溶解度降低;加入与难溶电解质不同离子的电解质,因“盐效应”溶解度增大。
①提出假设:
| 依据 | 假设 | |
| 假设1 | 实验1和2中 检测时出现少量浑浊 检测时出现少量浑浊 |  溶解度 溶解度 |
| 假设2 | 实验3中 检出量明显高于1和2 检出量明显高于1和2 | NaOH能明显增大 溶解度 溶解度 |
| 假设3 | NaOH或 能明显增大 能明显增大 溶解度 溶解度 |
| 探究1 | 探究2 | 探究3 | 探究4 | |
| 实验流程 | 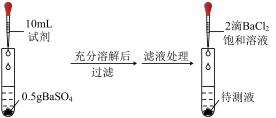 | |||
| 试剂 | 饱和食盐水 | 2 NaOH溶液 NaOH溶液 | 0.5  溶液 溶液 | 蒸馏水 |
| 现象 | 少量浑浊 | 大量沉淀 | 大量沉淀 | 无明显现象 |
③实验分析:实验3中
 溶液的用量为理论值的1.5倍,最后仍检出
溶液的用量为理论值的1.5倍,最后仍检出 的原因是该体系中“同离子效应”
的原因是该体系中“同离子效应”④实验结论:粗盐提纯时,为了有效降低产品中
 含量,必须
含量,必须
您最近一年使用:0次
2022-04-02更新
|
490次组卷
|
2卷引用:福建省八地市(福州、厦门、泉州、莆田、南平、宁德、三明、龙岩)2022届高三毕业班4月诊断性联考化学试题
解题方法
10 . 砷的化合物可用于半导体领域,如我国“天宫”空间站的核心舱“天和号”就是采用砷化镓薄膜电池来供电。一种从酸性高浓度含砷废水[砷主要以亚砷酸( )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
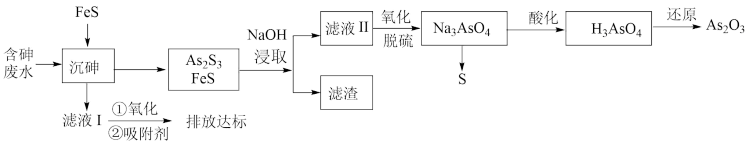
已知:
Ⅰ.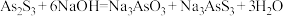
Ⅱ.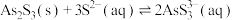
Ⅲ.砷酸( )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 、氢碘酸等还原
、氢碘酸等还原
(1) 中砷元素的化合价为
中砷元素的化合价为___________ 价。
(2)“沉砷”过程中FeS是否可以用过量的 替换
替换___________ (填“是”或“否”);请从平衡移动的角度解释原因:___________ 。
(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出脱硫的离子反应方程式___________ 。
(4)用 “还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有
“还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有___________ 。
(5)已知:常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。
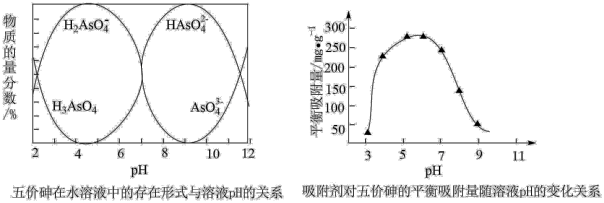
当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因_____ 。
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为 沉淀。若沉降后上层清液中
沉淀。若沉降后上层清液中 为
为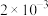 mol/L,则溶液中
mol/L,则溶液中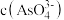 的浓度为
的浓度为_____ mol/L。该处理后的溶液是否符合国家排放标准___________ (填“是”或“否”)。(已知: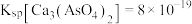 ,国家规定工业废水排放中砷元素含量<0.5mg/L)
,国家规定工业废水排放中砷元素含量<0.5mg/L)
 )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
已知:
Ⅰ.
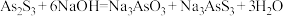
Ⅱ.
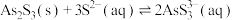
Ⅲ.砷酸(
 )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 、氢碘酸等还原
、氢碘酸等还原(1)
 中砷元素的化合价为
中砷元素的化合价为(2)“沉砷”过程中FeS是否可以用过量的
 替换
替换(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出脱硫的离子反应方程式
(4)用
 “还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有
“还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有(5)已知:常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。

当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为
 沉淀。若沉降后上层清液中
沉淀。若沉降后上层清液中 为
为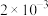 mol/L,则溶液中
mol/L,则溶液中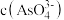 的浓度为
的浓度为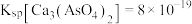 ,国家规定工业废水排放中砷元素含量<0.5mg/L)
,国家规定工业废水排放中砷元素含量<0.5mg/L)
您最近一年使用:0次



