2023高三·全国·专题练习
1 . 超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2=2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2 L(标准状况)CO2和KO2反应后,气体体积变为18.8 L(标准状况),列式计算反应消耗的KO2的质量_______ 。
您最近一年使用:0次
2023高三·全国·专题练习
2 . 回答下列问题:
(1)标准状况下,1.92g某气体的体积为672mL,则此气体的相对分子质量为______ 。
(2)在25℃、101kPa的条件下,相同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为______ 。
(3)两个相同容积的密闭容器X、Y,在25℃下,X中充入agA气体,Y中充入agCH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为______ 。
(1)标准状况下,1.92g某气体的体积为672mL,则此气体的相对分子质量为
(2)在25℃、101kPa的条件下,相同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为
(3)两个相同容积的密闭容器X、Y,在25℃下,X中充入agA气体,Y中充入agCH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为
您最近一年使用:0次
2023高三·全国·专题练习
3 . 金属钠及其化合物在人类生产生活中起着重要作用。天然碱的主要成分为 ,1mol
,1mol  经充分加热得到
经充分加热得到 的质量为
的质量为_______ g。
 ,1mol
,1mol  经充分加热得到
经充分加热得到 的质量为
的质量为
您最近一年使用:0次
2023高三·全国·专题练习
4 . 2-噻吩乙醇(Mr=128)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
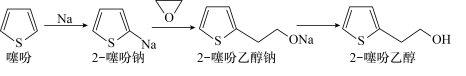
Ⅰ.制钠砂。向烧瓶中加入300mL液体A和4.60g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10℃,加入25mL噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至-10℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30min。
Ⅳ.水解。恢复室温,加入70mL水,搅拌30min;加盐酸调pH至4~6,继续反应2h,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水MgSO4,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品17.92g。
产品的产率为_______ (用Na计算,精确至0.1%)。

Ⅰ.制钠砂。向烧瓶中加入300mL液体A和4.60g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10℃,加入25mL噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至-10℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30min。
Ⅳ.水解。恢复室温,加入70mL水,搅拌30min;加盐酸调pH至4~6,继续反应2h,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水MgSO4,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品17.92g。
产品的产率为
您最近一年使用:0次
解题方法
5 . 将12.0g铜粉缓慢加入到50.0mL某浓度的浓硝酸中,随反应的进行,产生的 和NO总体积(折算成标准状况)随铜粉加入量的变化如图。完成下列问题:
和NO总体积(折算成标准状况)随铜粉加入量的变化如图。完成下列问题:___________ mol。
(2)反应中生成的 和NO的体积之比为
和NO的体积之比为___________ 。
(3)原硝酸的物质的量浓度为___________  。
。
(4)若使铜粉继续溶解,可向反应后的溶液中加入___________。
 和NO总体积(折算成标准状况)随铜粉加入量的变化如图。完成下列问题:
和NO总体积(折算成标准状况)随铜粉加入量的变化如图。完成下列问题: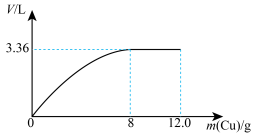
(2)反应中生成的
 和NO的体积之比为
和NO的体积之比为(3)原硝酸的物质的量浓度为
 。
。(4)若使铜粉继续溶解,可向反应后的溶液中加入___________。
| A.稀硫酸 | B. 固体 固体 |
C. 固体 固体 | D. 固体 固体 |
您最近一年使用:0次
解题方法
6 . 9.6g铜与100mL稀硝酸反应,铜完全溶解。反应的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2___________+4H2O
(1)以上化学方程式中缺少物质的化学式为___________ 。
(2)计算生成的气体在标准状况下的体积___________ 。
(3)若反应前后溶液的体积不变,计算生成Cu(NO3)2的物质的量浓度___________ 。
(1)以上化学方程式中缺少物质的化学式为
(2)计算生成的气体在标准状况下的体积
(3)若反应前后溶液的体积不变,计算生成Cu(NO3)2的物质的量浓度
您最近一年使用:0次
2023高三·全国·专题练习
7 . 回答下列问题:
(1)标准状况下33.6LH2中,所含质子个数是_______ 。
(2)所含电子的物质的量为4mol的H2,标准状况下的体积是_______ 。
(3)标准状况下,4.8g甲烷(CH4)所占的体积为_______ L,它与标准状况下_______ L硫化氢(H2S)含有相同数目的氢原子。
(4)标准状况下,16gO2与14gN2的混合气体所占的体积是_______ 。
(5)9.03×1023个NH3含_______ mol氢原子,_______ mol质子,在标准状况下的体积约为_______ L。
(6)标准状况下,若6.72LO3含有m个氧原子,则阿伏加德罗常数的值可表示为_______ (用含m的式子表示)。
(1)标准状况下33.6LH2中,所含质子个数是
(2)所含电子的物质的量为4mol的H2,标准状况下的体积是
(3)标准状况下,4.8g甲烷(CH4)所占的体积为
(4)标准状况下,16gO2与14gN2的混合气体所占的体积是
(5)9.03×1023个NH3含
(6)标准状况下,若6.72LO3含有m个氧原子,则阿伏加德罗常数的值可表示为
您最近一年使用:0次
名校
8 . 氧化还原反应在生产、生活等领域有广泛的应用。
(1)铝热反应可用于焊接钢轨,其反应原理为: 。在该反应中
。在该反应中___________ 元素(填元素符号)的化合价升高,通过此反应的分析可知规律:氧化还原反应中元素化合价升高总数___________ (填“>”、“<”或“=”)元素化合价降低总数。
(2)汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应: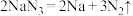 ,所产生的气体快速充满气囊,可以达到保护车内人员的目的。某安全气囊
,所产生的气体快速充满气囊,可以达到保护车内人员的目的。某安全气囊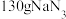 完全分解,反应中转移电子的物质的量为
完全分解,反应中转移电子的物质的量为___________  ,在标准状况下,气囊膨胀的体积约为
,在标准状况下,气囊膨胀的体积约为___________  。
。
(3)钠—钾合金(化学式为 )可在核反应堆中用作热交换液。合金与水反应原理为:
)可在核反应堆中用作热交换液。合金与水反应原理为: ,现将
,现将 加入
加入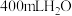 中充分反应,忽略溶液体积的变化。
中充分反应,忽略溶液体积的变化。
①反应生成 的质量为
的质量为___________ 。
②所得溶液中 的物质的量浓度为
的物质的量浓度为___________ 。
(1)铝热反应可用于焊接钢轨,其反应原理为:
 。在该反应中
。在该反应中(2)汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应:
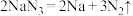 ,所产生的气体快速充满气囊,可以达到保护车内人员的目的。某安全气囊
,所产生的气体快速充满气囊,可以达到保护车内人员的目的。某安全气囊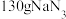 完全分解,反应中转移电子的物质的量为
完全分解,反应中转移电子的物质的量为 ,在标准状况下,气囊膨胀的体积约为
,在标准状况下,气囊膨胀的体积约为 。
。(3)钠—钾合金(化学式为
 )可在核反应堆中用作热交换液。合金与水反应原理为:
)可在核反应堆中用作热交换液。合金与水反应原理为: ,现将
,现将 加入
加入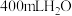 中充分反应,忽略溶液体积的变化。
中充分反应,忽略溶液体积的变化。①反应生成
 的质量为
的质量为②所得溶液中
 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
2023-06-16更新
|
204次组卷
|
3卷引用:合格考真题汇编5氧化还原反应
2023高三·全国·专题练习
9 . 为了测定Na2CS3溶液的浓度,按图装置进行实验,将35.0 mL Na2CS3溶液置于装置A的三颈瓶中,打开仪器d的活塞,滴入足量2.0 mol·L-1 H2SO4,关闭活塞。

已知:CS +2H+=CS2+H2S↑,CS2和H2S均有毒,CS2不溶于水,沸点46 ℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。若反应结束后将通热N2改为通热空气,通过测定C中溶液质量的增加值来计算三硫代碳酸钠溶液的浓度时,计算值
+2H+=CS2+H2S↑,CS2和H2S均有毒,CS2不溶于水,沸点46 ℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。若反应结束后将通热N2改为通热空气,通过测定C中溶液质量的增加值来计算三硫代碳酸钠溶液的浓度时,计算值___________ (填“偏高”“偏低”或“无影响”),原因是___________

已知:CS
 +2H+=CS2+H2S↑,CS2和H2S均有毒,CS2不溶于水,沸点46 ℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。若反应结束后将通热N2改为通热空气,通过测定C中溶液质量的增加值来计算三硫代碳酸钠溶液的浓度时,计算值
+2H+=CS2+H2S↑,CS2和H2S均有毒,CS2不溶于水,沸点46 ℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。若反应结束后将通热N2改为通热空气,通过测定C中溶液质量的增加值来计算三硫代碳酸钠溶液的浓度时,计算值
您最近一年使用:0次
2023高三·全国·专题练习
10 .  热分解的质量变化过程如图所示,其中
热分解的质量变化过程如图所示,其中 之前是隔绝空气加热,
之前是隔绝空气加热, 之后是在空气中加热,A、B、C三点时的产物均为纯净物。用化学方程式表示从A点到B点的物质转化:
之后是在空气中加热,A、B、C三点时的产物均为纯净物。用化学方程式表示从A点到B点的物质转化:_______ ,C点时产物的化学式是_______ 。
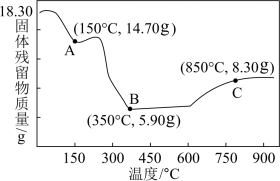
 热分解的质量变化过程如图所示,其中
热分解的质量变化过程如图所示,其中 之前是隔绝空气加热,
之前是隔绝空气加热, 之后是在空气中加热,A、B、C三点时的产物均为纯净物。用化学方程式表示从A点到B点的物质转化:
之后是在空气中加热,A、B、C三点时的产物均为纯净物。用化学方程式表示从A点到B点的物质转化:
您最近一年使用:0次



