2022高一·上海·专题练习
解题方法
1 . 某气态烃在标准状况下密度为2.59 g·L-1。
(1)其摩尔质量为_______ 。
(2)该烃的含碳量为82.8%,则分子中碳、氢原子的个数比是_______ ,分子式是_______ 。
(3)可能的结构简式:_______ 。
(1)其摩尔质量为
(2)该烃的含碳量为82.8%,则分子中碳、氢原子的个数比是
(3)可能的结构简式:
您最近一年使用:0次
解题方法
2 . 现有一瓶常见一元酸形成的铵盐固体,为测定其中的含氮量可以采用“甲醛法”,即: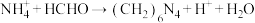 (未配平)。现称取4g该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100mL溶液。取出5mL,滴入酚酞后再逐滴滴入
(未配平)。现称取4g该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100mL溶液。取出5mL,滴入酚酞后再逐滴滴入 的NaOH溶液,当滴到25mL时溶液呈粉红色,且在半分钟内不褪色。计算:
的NaOH溶液,当滴到25mL时溶液呈粉红色,且在半分钟内不褪色。计算:
(1)过程中消耗的甲醛物质的量为_______ mol。
(2)该铵盐中氮的质量分数是_______ %。(写出计算过程)
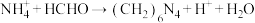 (未配平)。现称取4g该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100mL溶液。取出5mL,滴入酚酞后再逐滴滴入
(未配平)。现称取4g该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100mL溶液。取出5mL,滴入酚酞后再逐滴滴入 的NaOH溶液,当滴到25mL时溶液呈粉红色,且在半分钟内不褪色。计算:
的NaOH溶液,当滴到25mL时溶液呈粉红色,且在半分钟内不褪色。计算:(1)过程中消耗的甲醛物质的量为
(2)该铵盐中氮的质量分数是
您最近一年使用:0次
2022-05-19更新
|
896次组卷
|
3卷引用:专题讲座(一) 化学计算的常用方法(练)-2023年高考化学一轮复习讲练测(全国通用)
(已下线)专题讲座(一) 化学计算的常用方法(练)-2023年高考化学一轮复习讲练测(全国通用)浙江省Z20名校联盟(名校新高考研究联盟)2022届高三第三次联考化学试题浙江省Z20名校联盟2022届高三第三次联考化学试题
2022高一·上海·专题练习
解题方法
3 . 有机玻璃(聚丙烯酸甲酯)的结构简式可用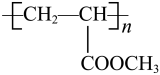 表示。设聚合度n为3000,则有机玻璃的单体为
表示。设聚合度n为3000,则有机玻璃的单体为_______ ,链节为_______ 。该有机玻璃的相对分子质量为_______ 。
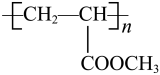 表示。设聚合度n为3000,则有机玻璃的单体为
表示。设聚合度n为3000,则有机玻璃的单体为
您最近一年使用:0次
解题方法
4 . 已知某加碘盐(含 的食盐)中含碘量为
的食盐)中含碘量为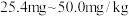 。现有1000kg该加碘盐,计算:
。现有1000kg该加碘盐,计算:
(1)该加碘食盐中至少含碘_______ mol
(2)若用 与
与 反应制
反应制 ,标准状况至少需要消耗
,标准状况至少需要消耗
_______ L(写出计算过程)。
 的食盐)中含碘量为
的食盐)中含碘量为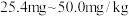 。现有1000kg该加碘盐,计算:
。现有1000kg该加碘盐,计算:(1)该加碘食盐中至少含碘
(2)若用
 与
与 反应制
反应制 ,标准状况至少需要消耗
,标准状况至少需要消耗
您最近一年使用:0次
5 . 以下方法常用于对废水中的苯酚进行定量测定:取 含苯酚废水,加过量溴水使苯酚完全反应,煮沸,再加入过量
含苯酚废水,加过量溴水使苯酚完全反应,煮沸,再加入过量 溶液生成三溴苯酚,再用
溶液生成三溴苯酚,再用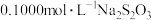 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 .已知
.已知 (三溴苯酚)
(三溴苯酚) .
. 和
和 溶液颜色均为无色.
溶液颜色均为无色.
(1)消耗 的物质的量为
的物质的量为________ .
(2)废水中苯酚的物质的量浓度为_______ (写出简要计算过程).
 含苯酚废水,加过量溴水使苯酚完全反应,煮沸,再加入过量
含苯酚废水,加过量溴水使苯酚完全反应,煮沸,再加入过量 溶液生成三溴苯酚,再用
溶液生成三溴苯酚,再用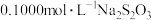 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 .已知
.已知 (三溴苯酚)
(三溴苯酚) .
. 和
和 溶液颜色均为无色.
溶液颜色均为无色.(1)消耗
 的物质的量为
的物质的量为(2)废水中苯酚的物质的量浓度为
您最近一年使用:0次
6 . 请回答下列问题:
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为_______
(2)将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为_______
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为_______
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为_______
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是_______
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为_______
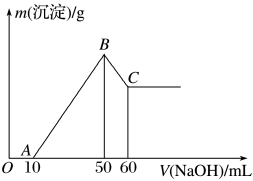
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为
(2)将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为

您最近一年使用:0次
2022-04-04更新
|
1305次组卷
|
3卷引用:专题02 阿伏加德罗常数及其化学计算 (测)-2023年高考化学二轮复习讲练测(新高考专用)
(已下线)专题02 阿伏加德罗常数及其化学计算 (测)-2023年高考化学二轮复习讲练测(新高考专用)江苏省天一中学2021-2022学年高一上学期期末考试化学(强化班)试题四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题
2022高三·全国·专题练习
7 . 反应完成后得到的混合物处理得到固体NaHCO3和滤液,对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.14g,则固体NaHCO3的质量为_______ g。
您最近一年使用:0次
2022高三·全国·专题练习
8 . 碳酸钠产品中 含量测定:
含量测定:
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸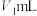 ;
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸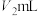 ;
;
④平行测定三次,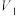 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
开始分解。
(ii)相关盐在不同温度下的溶解度表(g/100gH2O)
(1)产品中 的质量分数为
的质量分数为___________ (保留三位有效数字);
(2)第一滴定终点时,某同学俯视读数,其他操作均正确,则 质量分数的计算结果
质量分数的计算结果___________ (填“偏大”“偏小”或“无影响”)。
 含量测定:
含量测定:①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用
 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸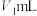 ;
;③在上述锥形瓶中再加入2滴指示剂N,继续用
 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸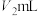 ;
;④平行测定三次,
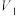 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。已知:(i)当温度超过35℃时,
 开始分解。
开始分解。(ii)相关盐在不同温度下的溶解度表(g/100gH2O)
温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
 | 11.9 | 15.8 | 21.0 | 27.0 | |||
 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
 的质量分数为
的质量分数为(2)第一滴定终点时,某同学俯视读数,其他操作均正确,则
 质量分数的计算结果
质量分数的计算结果
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
9 . 结晶水测定:称量干燥坩埚的质量为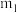 ,加入胆矾后总质量为
,加入胆矾后总质量为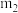 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为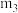 。
。
(1)根据实验数据,胆矾分子中结晶水的个数为___________ (写表达式)。
(2)下列操作中,会导致结晶水数目测定值偏高的是___________ (填标号)。
①胆矾未充分干燥
②坩埚未置于干燥器中冷却
③加热时有少胆矾迸溅出来
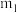 ,加入胆矾后总质量为
,加入胆矾后总质量为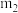 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为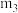 。
。(1)根据实验数据,胆矾分子中结晶水的个数为
(2)下列操作中,会导致结晶水数目测定值偏高的是
①胆矾未充分干燥
②坩埚未置于干燥器中冷却
③加热时有少胆矾迸溅出来
您最近一年使用:0次
2022高三·全国·专题练习
10 . 通过下列方法测定产品纯度:准确称取0.5000gCuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000mol∙L−1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.80mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2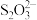 +I2=
+I2=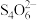 +2I-。计算CuSO4·5H2O样品的纯度(写出计算过程):
+2I-。计算CuSO4·5H2O样品的纯度(写出计算过程):_____ 。
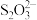 +I2=
+I2=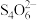 +2I-。计算CuSO4·5H2O样品的纯度(写出计算过程):
+2I-。计算CuSO4·5H2O样品的纯度(写出计算过程):
您最近一年使用:0次



