1 . 把7.2g铁粉投入40mL某HNO3溶液中,充分反应后剩余固体1.6g,产生NO2和NO的混合气体0.08mol。若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度
| A.3.5mol·L-1 | B.4.5mol·L -1 | C.7.0mol·L -1 | D.9.0mol·L -1 |
您最近一年使用:0次
2016-04-27更新
|
406次组卷
|
11卷引用:2017届辽宁省东北育才学校高三上学期第一次模拟化学试卷
2017届辽宁省东北育才学校高三上学期第一次模拟化学试卷2017届辽宁省沈阳东北育才学校高三上模拟一化学试卷2015-2016学年河北省冀州中学高一下开学考试化学试卷2016届贵州省习水县第一中学高三下学期期中化学试卷2015-2016学年内蒙古包头一中高一下学期期中考试化学试卷2015-2016学年黑龙江省实验中学高二下期末化学试卷山西省忻州市第一中学2016-2017学年高一必修一:非金属及其化合物同步练习化学试题天津市耀华中学2019-2020学年高一下学期第一次月考化学试题天津市第二南开学校2019-2020学年高一下学期阶段性检测化学试题河南省许昌市建安区第三高级中学2020-2021学年高一上学期1月月考化学试题安徽省舒城中学2020-2021学年高二下学期第三次月考化学试题
2 . 实验室中经常需配制一定浓度的NaOH溶液,现将22.0g NaOH固体溶于水配成100.0mL溶液,其密度为1.2g.mL﹣1.
(1)该溶液中NaOH的质量分数约为 .
(2)从该溶液中取出10.0mL,其中NaOH的物质的量浓度为 ,含NaOH的物质的量为 .
(3)将取出的10.0mL溶液加水稀释到100.0mL,稀释后溶液中NaOH的物质的量浓度为 .
(1)该溶液中NaOH的质量分数约为 .
(2)从该溶液中取出10.0mL,其中NaOH的物质的量浓度为 ,含NaOH的物质的量为 .
(3)将取出的10.0mL溶液加水稀释到100.0mL,稀释后溶液中NaOH的物质的量浓度为 .
您最近一年使用:0次
3 . 已知20℃时,磷酸与氢氧化钙生成的三种盐的溶解度(每升饱和溶液中含溶质的质量)如下表所示:
下列叙述正确的是
| 物质 | Ca3(PO4)2 | CaHPO4 | Ca(H2PO4)2 |
| 溶解度(g·L-1) | 2×10-2 | 4.303×10-2 | 18 |
下列叙述正确的是
| A.含Ca(H2PO4)2的磷肥可以与草木灰混施 |
| B.Ksp[CaHPO4]=c(Ca2+)·c(H+)·c(PO43-) |
| C.20℃时,Ca(H2PO4)2饱和溶液物质的量浓度为0.13 mol·L-1 |
| D.向澄清石灰水中逐滴滴入稀磷酸,开始出现浑浊,后变澄清 |
您最近一年使用:0次
2014·全国·一模
4 . 下表为四种溶液的溶质质量分数和物质的量浓度的数值,根据表中数据判断四种溶液中密度最小的是
| 溶液 | KOH | HNO3 | CH3COOH | HCl |
| 溶质质量分数w(%) | 56 | 63 | 60 | 36.5 |
| 物质的量浓度c(mol·L-1) | 14.3 | 13.8 | 10.6 | 11.8 |
| A.HCl | B.HNO3 | C.CH3COOH | D.KOH |
您最近一年使用:0次
13-14高三上·上海虹口·期末
解题方法
5 . 铁是一种典型的过渡金属,铁和铁的化合物在生产和生活中有广泛的应用。完成下列计算:
(1)将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁。
①钢样中含铁________ g。
②生成的CO2在标准状况下体积为________ mL。
(2)向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤。洗涤沉淀,将洗涤液与滤液合并后稀释至250mL。取25mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50mL。计算原溶液中Fe3+的物质的量浓度_______________ 。
(3)铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)]。将一块带锈铁片放入700mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020g铁。求:
①反应后溶液中溶质的成分与物质的量_____________ 。
②原带锈铁片中铁锈的质量分数_______________ 。
(4)用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示)。经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11:12。已知两种阳离子为Fe2+与Fe3+,物质的量之比为2:1。请通过计算确定X的化学式________________ 。
(1)将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁。
①钢样中含铁
②生成的CO2在标准状况下体积为
(2)向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤。洗涤沉淀,将洗涤液与滤液合并后稀释至250mL。取25mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50mL。计算原溶液中Fe3+的物质的量浓度
(3)铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)]。将一块带锈铁片放入700mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020g铁。求:
①反应后溶液中溶质的成分与物质的量
②原带锈铁片中铁锈的质量分数
(4)用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示)。经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11:12。已知两种阳离子为Fe2+与Fe3+,物质的量之比为2:1。请通过计算确定X的化学式
您最近一年使用:0次
10-11高一上·浙江宁波·期中
6 . 将标准状况下的a升氯化氢气体溶于1000克水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是
A. | B. | C.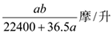 | D. |
您最近一年使用:0次
11-12高三上·江苏泰州·期中
解题方法
7 . 常温下,海水在浓缩过程中析出盐的种类和质量(表中为每升海水析出的各种盐的克数。单位g/L)如下:
海水从密度为1.21 g/mL浓缩到密度为1.22g/mL时发生的变化是:
| 海水密度 (g/mL) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.04 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
海水从密度为1.21 g/mL浓缩到密度为1.22g/mL时发生的变化是:
| A.各种盐的溶解度增大 | B.海水中水的质量分数减小 |
| C.析出的粗盐中 NaCl的质量分数增大 | D.海水中Br-浓度不变 |
您最近一年使用:0次
2010·江苏南通·一模
解题方法
8 . 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为_________ 。若要计算该溶液的质量分数,还需要的一个条件是____________ (用文字说明)。
(2)发生器中鼓入空气的作用可能是__ (选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的离子反应方程式为______________ 。
吸收塔的温度不能超过20℃,其目的是___________________________ 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是________________________________ 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是_______ (选填序号)。
a.Na2O2b.Na2S c.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是__ (选填序号)
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是______ (填操作名称)

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为
(2)发生器中鼓入空气的作用可能是
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的离子反应方程式为
吸收塔的温度不能超过20℃,其目的是
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是
a.Na2O2b.Na2S c.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是
您最近一年使用:0次
2010·江苏扬州·模拟预测
解题方法
9 . 工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:____ 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为_____ 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与VmL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为______________________ ;
②若V=35,试计算混合物中CuS的质量分数________________
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与VmL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为
②若V=35,试计算混合物中CuS的质量分数
您最近一年使用:0次



