1 .  为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是A.100g46%的乙醇溶液中含有O-H键的数目为 |
B.标准状况下,11.2LHF中电子的数目为 |
C.pH=1的 溶液中 溶液中 的数目为 的数目为 |
D.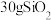 中含有的Si-O键数目为 中含有的Si-O键数目为 |
您最近一年使用:0次
2 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.标准状况下,22.4L 中分子的数目为 中分子的数目为 |
B.1L 的水溶液中所含原子的数目为 的水溶液中所含原子的数目为 |
C.电解足量饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为 |
D.1mol 和 和 的混合气体中所含碳原子的数目为 的混合气体中所含碳原子的数目为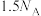 |
您最近一年使用:0次
3 .  为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下, 溶于水,溶液中 溶于水,溶液中 、 、 和 和 的微粒数之和小于 的微粒数之和小于 |
B.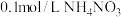 溶液中含有 溶液中含有 数目小于 数目小于 |
C. 与 与 完全反应,反应中转移的电子数介于 完全反应,反应中转移的电子数介于 和 和 之间 之间 |
D. 苯乙烯中含有碳碳双键数为 苯乙烯中含有碳碳双键数为 |
您最近一年使用:0次
名校
4 . 肼 是一种应用广泛的化工原料,可用作火箭和燃料电池的燃料。实验室制取肼的化学方程式为:
是一种应用广泛的化工原料,可用作火箭和燃料电池的燃料。实验室制取肼的化学方程式为: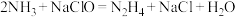 。已知
。已知 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 是一种应用广泛的化工原料,可用作火箭和燃料电池的燃料。实验室制取肼的化学方程式为:
是一种应用广泛的化工原料,可用作火箭和燃料电池的燃料。实验室制取肼的化学方程式为: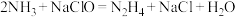 。已知
。已知 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.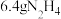 分子中含有的电子数为 分子中含有的电子数为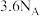 |
B.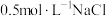 溶液中含有的氯原子数为 溶液中含有的氯原子数为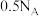 |
C.每消耗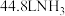 ,理论上转移电子数为 ,理论上转移电子数为 |
D.标准状况下,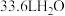 含有水分子数为 含有水分子数为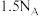 |
您最近一年使用:0次
2024-03-19更新
|
148次组卷
|
2卷引用:2024届重庆市第八中学校高三下学期模拟预测化学试题(四)
5 . 某兴趣小组通过下列实验探究 与
与 的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
(1)探究 与
与 的氧化性强弱
的氧化性强弱
【实验 】将
】将 溶液和
溶液和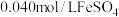 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
)等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
_____  (填“>”“<”)。
(填“>”“<”)。
(2)验证反应 是可逆反应
是可逆反应
【实验Ⅱ】
①取实验 反应后的上层清液或沉淀进行实验,将表格补充完整。
反应后的上层清液或沉淀进行实验,将表格补充完整。
②根据实验数据,证明该反应为可逆反应,不需要完成表格中编号_____ 的实验。
(3)测定反应 的平衡常数
的平衡常数
测定方案:通过氧化还原滴定法可测定平衡时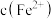 ,再根据实验
,再根据实验 反应物浓度数据计算得出
反应物浓度数据计算得出 和
和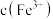 ,进而求算出平衡常数
,进而求算出平衡常数 。
。
【实验Ⅲ】室温下,待实验Ⅰ中反应达到平衡状态时,取 上层清液,用
上层清液,用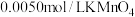 标准溶液滴定
标准溶液滴定 ,达到滴定终点记录消耗
,达到滴定终点记录消耗 标准溶液的体积。重复实验3次,平均消耗
标准溶液的体积。重复实验3次,平均消耗 标准溶液的体积为
标准溶液的体积为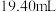 。
。
①用于盛装 标准溶液进行滴定的玻璃仪器名称为
标准溶液进行滴定的玻璃仪器名称为_____ 。
②平衡时
_____  ,平衡常数
,平衡常数
_____ 。
③若取实验 反应后的含
反应后的含 浊液进行实验Ⅱ,会使测得的平衡常数
浊液进行实验Ⅱ,会使测得的平衡常数 值
值_____ 。
A.偏大 B.偏小 C.无影响 D.无法判断
 与
与 的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。(1)探究
 与
与 的氧化性强弱
的氧化性强弱【实验
 】将
】将 溶液和
溶液和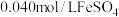 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
)等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
 (填“>”“<”)。
(填“>”“<”)。(2)验证反应
 是可逆反应
是可逆反应【实验Ⅱ】
①取实验
 反应后的上层清液或沉淀进行实验,将表格补充完整。
反应后的上层清液或沉淀进行实验,将表格补充完整。| 实验编号 | 操作及现象 | 结论 |
| 1 | 取上层黄色清液,滴加 | 存在 |
| 2 | 取少量灰黑色沉淀,滴加浓硝酸,沉淀溶解,出现红棕色气体 | 存在 |
| 3 | 操作及现象是: | 存在 |
| 4 | 取上层清液,滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
(3)测定反应
 的平衡常数
的平衡常数测定方案:通过氧化还原滴定法可测定平衡时
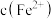 ,再根据实验
,再根据实验 反应物浓度数据计算得出
反应物浓度数据计算得出 和
和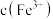 ,进而求算出平衡常数
,进而求算出平衡常数 。
。【实验Ⅲ】室温下,待实验Ⅰ中反应达到平衡状态时,取
 上层清液,用
上层清液,用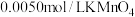 标准溶液滴定
标准溶液滴定 ,达到滴定终点记录消耗
,达到滴定终点记录消耗 标准溶液的体积。重复实验3次,平均消耗
标准溶液的体积。重复实验3次,平均消耗 标准溶液的体积为
标准溶液的体积为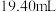 。
。①用于盛装
 标准溶液进行滴定的玻璃仪器名称为
标准溶液进行滴定的玻璃仪器名称为②平衡时

 ,平衡常数
,平衡常数
③若取实验
 反应后的含
反应后的含 浊液进行实验Ⅱ,会使测得的平衡常数
浊液进行实验Ⅱ,会使测得的平衡常数 值
值A.偏大 B.偏小 C.无影响 D.无法判断
您最近一年使用:0次
名校
解题方法
6 . 相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是
A.溶液密度ρ可表示为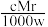 | B.物质的量浓度c可表示为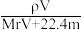 |
C.溶液的质量分数w%可表示为 | D.相对分子质量Mr可表示为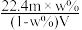 |
您最近一年使用:0次
2023-10-29更新
|
1093次组卷
|
42卷引用:山西省晋城市第一中学校2023-2024学年高三上学期第四次调研化学试题
山西省晋城市第一中学校2023-2024学年高三上学期第四次调研化学试题2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷(已下线)2018年9月16日《每日一题》人教必修1- 每周一测湖南省长沙市周南梅溪湖中学2018-2019学年高一下学期一模检测化学试题【全国百强校】四川省成都市石室中学2018-2019学年高一上学期10月月考化学试题广东省揭阳市惠来县第一中学2018-2019学年高一上学期期中考试化学试题辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题人教版高一化学必修1第一章—第三章综合测试题江西省南昌市新建区第一中学2019—2020学年高一上学期第一次月考化学试题鲁科版高中化学必修1第一章《认识化学科学》测试卷云南省丽江市华坪县第一中学2019—2020学年高一上学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高一上学期期末考试化学试题河北省沧州市第一中学2019-2020学年高二4月月考化学试题(已下线)【南昌新东方】2019 雷氏学校 高一上第一次月考(已下线)考点02 物质的量与阿伏加德罗常数-2020年高考化学命题预测与模拟试题分类精编江西省南昌市八一中学2019-2020学年高一下学期开学考试(5月)化学试题宁夏贺兰县景博中学2019-2020学年高一上学期第一次月考化学试题浙江省诸暨中学2019-2020学年高二下学期期中考试化学试题(已下线)【南昌新东方】4.进贤一中 田荣达江西省南昌新建一中2020-2021学年高一上学期第一次月考化学试题黑龙江省齐齐哈尔市讷河市拉哈一中2020-2021学年高一上学期12月月考化学试题江西省南昌市进贤县第一中学2020-2021学年高一上学期第一次月考化学试题(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)河南省郑州市第一中学2020-2021学年高一上学期第一次月考化学试题陕西省周至县第四中学2021-2022学年高三上学期10月月考化学试题(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)陕西省西安市第一中学2021-2022学年高一上学期10月月考化学试题湖北省荆州中学2021-2022学年高一上学期期末考试化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题内蒙古鄂尔多斯市第一中学2022-2023 学年高一上学期期末考试化学试题湖北省部分重点中学2022-2023年高一上学期期末联合考试化学试题(已下线)第12讲 物质的量浓度的相关计算-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)第2讲 物质的浓度及溶液配制黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题湖南省部分学校2023-2024学年高三上学期第二次联考化学试题辽宁省东北育才学校科学高中部2023-2024学年高一上学期第一次月考化学试题山东省新泰市第一中学(实验部)2023-2024学年高一上学期第二次月考化学试题河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题天津市第一中学2023-2024学年高一上学期月考(第三章单元测验1)化学试题广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
名校
7 . 用 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是A.常温下,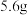 铁与足量浓硫酸充分反应转移的电子数为 铁与足量浓硫酸充分反应转移的电子数为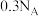 |
B.标准状态下,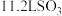 分子中所含的 分子中所含的 原子数为 原子数为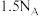 |
C.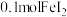 与 与 反应时,转移电子的数目为 反应时,转移电子的数目为 |
D.浓度均为 的 的 溶液和 溶液和 溶液中, 溶液中, 数目均为 数目均为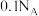 |
您最近一年使用:0次
2023-10-09更新
|
289次组卷
|
2卷引用:陕西省渭南市大荔县2023-2024学年高三一模考试化学试题
8 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,2.24LSO3中电子的数目为4NA |
B.NaHCO3溶液中Na+和HCO 个数比为1∶1 个数比为1∶1 |
| C.28gC2H4和C3H6的混合气体中含有的C原子数为2NA |
| D.pH=2的H2SO4溶液中H+数目为0.01NA |
您最近一年使用:0次
名校
解题方法
9 . 化学计量在生产和科研中应用广泛。回答下列问题:
(1)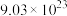 个
个 分子在标准状况下的体积为
分子在标准状况下的体积为___________ ,其质子的物质的量为___________ 。
(2)某气态氧化物的化学式为 ,标准状况下
,标准状况下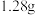 该氧化物的体积为
该氧化物的体积为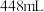 ,则
,则 的摩尔质量为
的摩尔质量为___________ 。
(3)若 g某气体A2,含有的分子数为
g某气体A2,含有的分子数为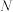 ,
, 气体在标准状况下的体积约为
气体在标准状况下的体积约为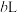 ,则阿伏加德罗常数的数值可表示为
,则阿伏加德罗常数的数值可表示为___________ (用含字母的代数式表示)。
(4)标准状况下将a LX气体(摩尔质量为 )全部溶于0.1 L水(水的密度为
)全部溶于0.1 L水(水的密度为 )中(假设气体与水不反应),所得溶液的密度为
)中(假设气体与水不反应),所得溶液的密度为 ,则此溶液的物质的量浓度为
,则此溶液的物质的量浓度为___________ 。
(5)将 溶液与
溶液与 溶液相混合,则混合溶液中
溶液相混合,则混合溶液中 的物质的量浓度为
的物质的量浓度为___________ (忽略混合前后溶液体积的变化)。
(6)某混合溶液中含有离子: 、
、 、
、 、
、 ,测得
,测得 、
、 和
和 的物质的量浓度依次为:
的物质的量浓度依次为: 、
、 、
、 ,则该混合溶液中
,则该混合溶液中
___________ 。
(1)
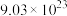 个
个 分子在标准状况下的体积为
分子在标准状况下的体积为(2)某气态氧化物的化学式为
 ,标准状况下
,标准状况下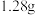 该氧化物的体积为
该氧化物的体积为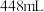 ,则
,则 的摩尔质量为
的摩尔质量为(3)若
 g某气体A2,含有的分子数为
g某气体A2,含有的分子数为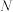 ,
, 气体在标准状况下的体积约为
气体在标准状况下的体积约为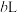 ,则阿伏加德罗常数的数值可表示为
,则阿伏加德罗常数的数值可表示为(4)标准状况下将a LX气体(摩尔质量为
 )全部溶于0.1 L水(水的密度为
)全部溶于0.1 L水(水的密度为 )中(假设气体与水不反应),所得溶液的密度为
)中(假设气体与水不反应),所得溶液的密度为 ,则此溶液的物质的量浓度为
,则此溶液的物质的量浓度为(5)将
 溶液与
溶液与 溶液相混合,则混合溶液中
溶液相混合,则混合溶液中 的物质的量浓度为
的物质的量浓度为(6)某混合溶液中含有离子:
 、
、 、
、 、
、 ,测得
,测得 、
、 和
和 的物质的量浓度依次为:
的物质的量浓度依次为: 、
、 、
、 ,则该混合溶液中
,则该混合溶液中
您最近一年使用:0次
2023-09-21更新
|
227次组卷
|
2卷引用:河南省部分名校2023-2024学年高三上学期核心模拟考试(一)化学试题
10 . 高铁酸钾 是新型多功能水处理剂,其生产工艺如图所示:
是新型多功能水处理剂,其生产工艺如图所示:
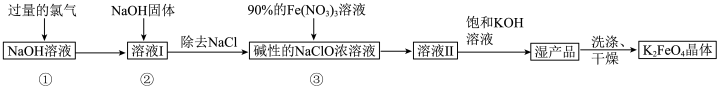
已知:① 与
与 溶液反应的产物与反应温度有关,温度较低时产物为
溶液反应的产物与反应温度有关,温度较低时产物为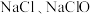 和
和 ;温度较高时产物为
;温度较高时产物为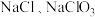 和
和 。
。
②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出 与
与 溶液在较高温度下反应的离子方程式:
溶液在较高温度下反应的离子方程式:___________ 。
(2)向“溶液Ⅰ”中加入 固体起到的作用有降低
固体起到的作用有降低 的溶解度、
的溶解度、___________ 、___________ ;
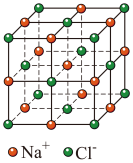
(3) 晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的
晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的 间的距离为
间的距离为___________  ,该晶体的密度为
,该晶体的密度为___________  。(列出计算式)
。(列出计算式)
(4)配制 溶液时,将
溶液时,将 固体溶解在
固体溶解在 水中(水的密度近似为
水中(水的密度近似为 ),所得溶液的密度为
),所得溶液的密度为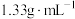 ,则该溶液的物质的量浓度为
,则该溶液的物质的量浓度为___________  。(保留3位有效数字)
。(保留3位有效数字)
(5)步骤③发生的反应中氧化剂与还原剂的物质的量之比n(氧化剂)∶n(还原剂)
___________ 。对“湿产品”进行“洗涤、干燥”时,洗涤剂最好选用___________ (填标号)溶液和异丙醇。
A. B.
B. C.
C.
 是新型多功能水处理剂,其生产工艺如图所示:
是新型多功能水处理剂,其生产工艺如图所示:
已知:①
 与
与 溶液反应的产物与反应温度有关,温度较低时产物为
溶液反应的产物与反应温度有关,温度较低时产物为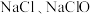 和
和 ;温度较高时产物为
;温度较高时产物为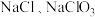 和
和 。
。②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出
 与
与 溶液在较高温度下反应的离子方程式:
溶液在较高温度下反应的离子方程式:(2)向“溶液Ⅰ”中加入
 固体起到的作用有降低
固体起到的作用有降低 的溶解度、
的溶解度、(3)
 晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的
晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的 间的距离为
间的距离为 ,该晶体的密度为
,该晶体的密度为 。(列出计算式)
。(列出计算式)
(4)配制
 溶液时,将
溶液时,将 固体溶解在
固体溶解在 水中(水的密度近似为
水中(水的密度近似为 ),所得溶液的密度为
),所得溶液的密度为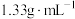 ,则该溶液的物质的量浓度为
,则该溶液的物质的量浓度为 。(保留3位有效数字)
。(保留3位有效数字)(5)步骤③发生的反应中氧化剂与还原剂的物质的量之比n(氧化剂)∶n(还原剂)

A.
 B.
B. C.
C.
您最近一年使用:0次
2023-09-09更新
|
282次组卷
|
2卷引用:黑龙江省大庆市2023-2024学年高三上学期第一次教学质量检测化学试题



