名校
解题方法
1 . 下列实验操作可达到预期目的的是
| 选项 | 目的 | 操作 |
| A | 测定硫酸铜晶体中结晶水含量 | 加热后的坩埚直接放在石棉网上冷却,称量 |
| B | 验证淀粉是否完全水解 | 向淀粉溶液中加入稀硫酸,加热、搅拌、冷却后,加过量氢氧化钠溶液中和稀硫酸,滴加几滴碘水 |
| C | 配制0.1mol/LNa2CO3溶液 | 称取5.3gNa2CO3∙10H2O固体于烧杯中,加入少量蒸馏水溶解,冷却后,转移至500mL容量瓶中定容 |
| D | 配制FeSO4溶液 | 先将FeSO4固体溶在稀硫酸中,然后稀释,并加入少量铁粉 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-06-02更新
|
487次组卷
|
2卷引用:山东师范大学附属中学2022届高三考前预测化学试题
2 . NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,11.2L  所含的分子数为0.5NA 所含的分子数为0.5NA |
B.0.1mol/L  溶液中,含有的 溶液中,含有的 数目小于0.1NA 数目小于0.1NA |
C.2 mol NO与1 mol  在密闭容器中充分反应后的分子数小于2NA 在密闭容器中充分反应后的分子数小于2NA |
| D.常温下,1 mol Fe与足量的浓硝酸反应转移的电子数为3NA |
您最近一年使用:0次
2022-05-20更新
|
402次组卷
|
5卷引用:重庆市普通高中2022届高三学业水平选择性考试联合诊断化学试题
重庆市普通高中2022届高三学业水平选择性考试联合诊断化学试题(已下线)专题02 化学计量与化学计算-三年(2020-2022)高考真题分项汇编(已下线)专题02 化学计量与化学计算-2022年高考真题模拟题分项汇编(已下线)云南省昆明市官渡区第二中学2023-2024学年高二上学期开学考试化学试题云南省昆明市官渡区第二中学2023-2024学年高三上学期开学考试化学试题
3 . 利用压强传感器测定氨气的喷泉实验中的压强变化。下列说法错误的是
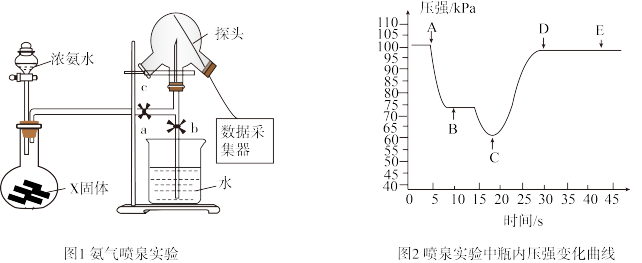

| A.烧瓶中制取氨气时常用的固体为CaO或NaOH |
| B.可用湿润的红色石蕊试纸置于三颈瓶口c处验满 |
| C.关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,挤压胶头滴管,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,A点时喷泉最剧烈 |
D.常温下完成该实验,假设溶液刚好充满烧瓶且混合均匀,则溶液的物质的量浓度大于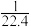 mol/L mol/L |
您最近一年使用:0次
2022-05-16更新
|
326次组卷
|
5卷引用:湖南省株洲市第一中学2021届高三第一次模拟检测化学试题
4 . 为了探究市售Fe3O4能否与常见的酸(盐酸、稀硫酸)发生反应,实验小组做了以下工作。
Ⅰ.Fe3O4的制备
(1)将可溶性亚铁盐和铁盐按一定配比混合后,加入NaOH溶液,在一定条件下反应可制行Fe3O4,反应的离子方程式为_______ 。
Ⅱ.Fe3O4与酸反应的热力学论证
(2)理论上完全溶解1.16gFe3O4至少需要3 mol/LH2SO4溶液的体积约为_______ mL(保留1位小数)。
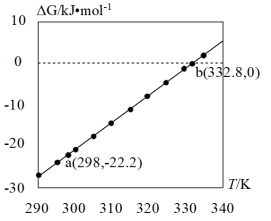
(3)查阅文献:吉布斯自由能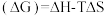 ,在100 kPa下,Fe3O4与酸反应的△G与温度T的关系如图所示。Fe3O4与酸自发反应的温度条件是
,在100 kPa下,Fe3O4与酸反应的△G与温度T的关系如图所示。Fe3O4与酸自发反应的温度条件是_______ 。
Ⅲ.Fe3O4与酸反应的实验研究
用10 mL3 mol/LH2SO4溶液浸泡1.0 g Fe3O4粉末,5分钟后各取2 mL澄清浸泡液,按编号i进行实验。(所用 、KSCN溶液均为0.1 mol/L,Fe2+遇
、KSCN溶液均为0.1 mol/L,Fe2+遇 溶液生成蓝色沉淀。)
溶液生成蓝色沉淀。)
(4)实验ⅱ的作用是_______ 。
(5)实验ⅰ中滴加K3[Fe(CN)6]溶液无蓝色沉淀生成,其可能原因是Fe2+的浓度太小,为了验证这一推断,可改进的方法是_______ 。
(6)实验ⅲ:用10 mL6 mol/L盐酸代替H2SO4浸泡样品后,重复实验ⅰ,发现试管①有蓝色沉淀,试管②溶液显红色,说明Cl-有利于Fe3O4与H+反应,为了验证这一推测,可在用H2SO4溶液浸泡时加入_______ ,然后重复实验i。
(7)实验ⅳ:用20 mL6 mol/L盐酸浸泡1.0 g天然磁铁矿粉末,20 min后浸泡液几乎无色,重复实验i,发现试管①、②均无明显现象,与实验iii现象不同的可能原因是_______ 。
Ⅰ.Fe3O4的制备
(1)将可溶性亚铁盐和铁盐按一定配比混合后,加入NaOH溶液,在一定条件下反应可制行Fe3O4,反应的离子方程式为
Ⅱ.Fe3O4与酸反应的热力学论证
(2)理论上完全溶解1.16gFe3O4至少需要3 mol/LH2SO4溶液的体积约为
(3)查阅文献:吉布斯自由能
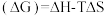 ,在100 kPa下,Fe3O4与酸反应的△G与温度T的关系如图所示。Fe3O4与酸自发反应的温度条件是
,在100 kPa下,Fe3O4与酸反应的△G与温度T的关系如图所示。Fe3O4与酸自发反应的温度条件是
Ⅲ.Fe3O4与酸反应的实验研究
用10 mL3 mol/LH2SO4溶液浸泡1.0 g Fe3O4粉末,5分钟后各取2 mL澄清浸泡液,按编号i进行实验。(所用
 、KSCN溶液均为0.1 mol/L,Fe2+遇
、KSCN溶液均为0.1 mol/L,Fe2+遇 溶液生成蓝色沉淀。)
溶液生成蓝色沉淀。)| 编号 | i | ii |
| 实验操作 | 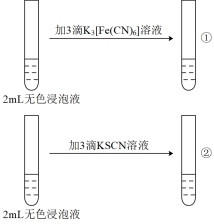 | 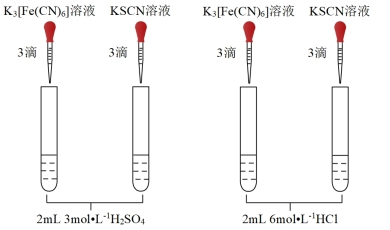 |
| 现象 | ①无蓝色沉淀 ②溶液显红色 | 均无明显现象 |
(5)实验ⅰ中滴加K3[Fe(CN)6]溶液无蓝色沉淀生成,其可能原因是Fe2+的浓度太小,为了验证这一推断,可改进的方法是
(6)实验ⅲ:用10 mL6 mol/L盐酸代替H2SO4浸泡样品后,重复实验ⅰ,发现试管①有蓝色沉淀,试管②溶液显红色,说明Cl-有利于Fe3O4与H+反应,为了验证这一推测,可在用H2SO4溶液浸泡时加入
(7)实验ⅳ:用20 mL6 mol/L盐酸浸泡1.0 g天然磁铁矿粉末,20 min后浸泡液几乎无色,重复实验i,发现试管①、②均无明显现象,与实验iii现象不同的可能原因是
您最近一年使用:0次
2022-05-05更新
|
540次组卷
|
3卷引用:福建省三明市2022届普通高中毕业班下学期5月质量测试化学试题
福建省三明市2022届普通高中毕业班下学期5月质量测试化学试题(已下线)专题17 化学实验综合题-三年(2020-2022)高考真题分项汇编福建省泉州第一中学2023-2024学年高三上学期12月月考化学试题
名校
5 . NA为阿伏加德罗常数的值。下列叙述正确的是
| A.1molOH-中含有9NA个电子 |
| B.1molCl2与NaOH完全反应,转移2NA个电子 |
| C.14gC2H4与C3H6混合物中含有2NA个氢原子 |
| D.10mL0.1mol·L-1NaAlO2溶液中含有2×10-3NA个氧原子 |
您最近一年使用:0次
2022-05-03更新
|
480次组卷
|
3卷引用:河南省许昌济源平顶山2022届高三下学期第三次质量检测理科综合化学试题
河南省许昌济源平顶山2022届高三下学期第三次质量检测理科综合化学试题(已下线)第06练 物质的量-2023年高考化学一轮复习小题多维练(全国通用)湖南省株洲市攸攸县第二中学2022-2023学年高三上学期第五次月考化学试题
名校
6 .  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.标准状况下, 分子数为 分子数为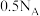 |
B. 白磷分子中共价键数目为 白磷分子中共价键数目为 |
C. 的盐酸中, 的盐酸中, 数目为 数目为 |
D.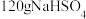 晶体中 晶体中 的数目为 的数目为 |
您最近一年使用:0次
2022-04-30更新
|
262次组卷
|
2卷引用:河北省唐山市2022届高三普通高中学业水平选择性考试第二次模拟演练化学试题
解题方法
7 . 单质硫在热的NaOH溶液中发生如下反应:3S+6NaOH 2Na2S+Na2SO3+3H2O。若硫过量,会进一步生成Na2Sx和Na2S2O3:(x-1)S+Na2S
2Na2S+Na2SO3+3H2O。若硫过量,会进一步生成Na2Sx和Na2S2O3:(x-1)S+Na2S Na2Sx,S+Na2SO3
Na2Sx,S+Na2SO3 Na2S2O3。现有3.84 g硫与含0.06 mol NaOH的热溶液完全反应,生成a mol Na2Sx和b mol Na2S2O3,在混合溶液中加入NaClO碱性溶液300 mL,恰好将硫元素全部转化为SO
Na2S2O3。现有3.84 g硫与含0.06 mol NaOH的热溶液完全反应,生成a mol Na2Sx和b mol Na2S2O3,在混合溶液中加入NaClO碱性溶液300 mL,恰好将硫元素全部转化为SO 。
。
请计算:
(1)a mol Na2Sx和b mol Na2S2O3中a∶b=____ 。
(2)NaClO溶液的物质的量浓度为____ mol·L-1 (写出计算过程)。
 2Na2S+Na2SO3+3H2O。若硫过量,会进一步生成Na2Sx和Na2S2O3:(x-1)S+Na2S
2Na2S+Na2SO3+3H2O。若硫过量,会进一步生成Na2Sx和Na2S2O3:(x-1)S+Na2S Na2Sx,S+Na2SO3
Na2Sx,S+Na2SO3 Na2S2O3。现有3.84 g硫与含0.06 mol NaOH的热溶液完全反应,生成a mol Na2Sx和b mol Na2S2O3,在混合溶液中加入NaClO碱性溶液300 mL,恰好将硫元素全部转化为SO
Na2S2O3。现有3.84 g硫与含0.06 mol NaOH的热溶液完全反应,生成a mol Na2Sx和b mol Na2S2O3,在混合溶液中加入NaClO碱性溶液300 mL,恰好将硫元素全部转化为SO 。
。请计算:
(1)a mol Na2Sx和b mol Na2S2O3中a∶b=
(2)NaClO溶液的物质的量浓度为
您最近一年使用:0次
2022-04-16更新
|
420次组卷
|
2卷引用:浙江省宁波市2022届高三下学期高考模拟考试(二模)化学试题
8 . 用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.28 g氮气含有的原子数为NA |
| B.标准状况下,44.8 L H2O中含有的水分子数为2 NA |
| C.1 mol 铁与足量的稀盐酸反应,失去的电子数为2 NA |
D.0.5 mol/L Fe2(SO4)3 溶液中,SO 的数目为1. 5 NA 的数目为1. 5 NA |
您最近一年使用:0次
2022-02-26更新
|
663次组卷
|
5卷引用:二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)
(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)广东省潮州市潮安区2021-2022学年高一上学期期末考试化学试题(已下线)微专题04 以物质的量为中心的计算-备战2023年高考化学一轮复习考点微专题天津市南开大学附属中学2022-2023学年高一上学期期中阶段检测化学试题天津北京师范大学静海附属学校 (天津市静海区北师大实验学校)2023-2024学年高三上学期第二次阶段检测(期中)化学试题
名校
9 .  为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是A.12g金刚石中含有的碳碳键数目为 |
B.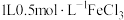 溶液中 溶液中 的数目为0.5 的数目为0.5 |
C.1LpH=2的 溶液中 溶液中 数目为0.01 数目为0.01 |
D. 与足量 与足量 在光照条件下充分反应得到 在光照条件下充分反应得到 的数目为0.5 的数目为0.5 |
您最近一年使用:0次
2022-02-05更新
|
370次组卷
|
2卷引用:重庆市2021-2022学年高三上学期学业质量调研抽测(第一次)化学试卷
10 . 下列关于“100 mL 0.1 mol·L-1 BaCl2溶液”的说法正确的是
| A.该溶液中含有的微粒主要有:BaCl2、Ba2+、Cl-、H2O |
| B.若取该溶液10 mL,其中c(Ba2+)=0.01 mol·L-1 |
| C.若取该溶液10 mL,恰好能与10 mL 0.1 mol·L-1 Na2SO4溶液完全反应 |
| D.该溶液与0.1 mol·L-1 NaCl溶液中的c(Cl-)相等 |
您最近一年使用:0次
2022-01-25更新
|
1087次组卷
|
7卷引用:二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)
(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)北京市丰台区2021-2022学年高一上学期期末考试化学试题(已下线)第一章 化学计量在实验中的应用(测)-2023年高考化学一轮复习讲练测(全国通用)(已下线)2.3.3 物质的量浓度与计算-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)山东省青岛市即墨区2022-2023学年高一上学期期中考试化学试题(已下线)【2022】【高一化学】【期中考】-182(已下线)【知识图鉴】单元讲练测必修第一册第二单元02基础练



