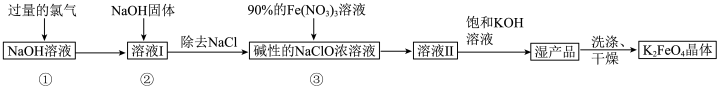
1 . 高铁酸钾 是新型多功能水处理剂,其生产工艺如图所示:
是新型多功能水处理剂,其生产工艺如图所示:
已知:① 与
与 溶液反应的产物与反应温度有关,温度较低时产物为
溶液反应的产物与反应温度有关,温度较低时产物为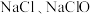 和
和 ;温度较高时产物为
;温度较高时产物为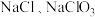 和
和 。
。
②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出 与
与 溶液在较高温度下反应的离子方程式:
溶液在较高温度下反应的离子方程式:___________ 。
(2)向“溶液Ⅰ”中加入 固体起到的作用有降低
固体起到的作用有降低 的溶解度、
的溶解度、___________ 、___________ ;
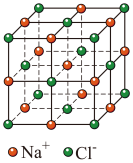
(3) 晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的
晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的 间的距离为
间的距离为___________  ,该晶体的密度为
,该晶体的密度为___________  。(列出计算式)
。(列出计算式)
(4)配制 溶液时,将
溶液时,将 固体溶解在
固体溶解在 水中(水的密度近似为
水中(水的密度近似为 ),所得溶液的密度为
),所得溶液的密度为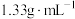 ,则该溶液的物质的量浓度为
,则该溶液的物质的量浓度为___________  。(保留3位有效数字)
。(保留3位有效数字)
(5)步骤③发生的反应中氧化剂与还原剂的物质的量之比n(氧化剂)∶n(还原剂)
___________ 。对“湿产品”进行“洗涤、干燥”时,洗涤剂最好选用___________ (填标号)溶液和异丙醇。
A. B.
B. C.
C.
 是新型多功能水处理剂,其生产工艺如图所示:
是新型多功能水处理剂,其生产工艺如图所示:
已知:①
 与
与 溶液反应的产物与反应温度有关,温度较低时产物为
溶液反应的产物与反应温度有关,温度较低时产物为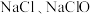 和
和 ;温度较高时产物为
;温度较高时产物为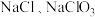 和
和 。
。②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出
 与
与 溶液在较高温度下反应的离子方程式:
溶液在较高温度下反应的离子方程式:(2)向“溶液Ⅰ”中加入
 固体起到的作用有降低
固体起到的作用有降低 的溶解度、
的溶解度、(3)
 晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的
晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的 间的距离为
间的距离为 ,该晶体的密度为
,该晶体的密度为 。(列出计算式)
。(列出计算式)
(4)配制
 溶液时,将
溶液时,将 固体溶解在
固体溶解在 水中(水的密度近似为
水中(水的密度近似为 ),所得溶液的密度为
),所得溶液的密度为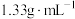 ,则该溶液的物质的量浓度为
,则该溶液的物质的量浓度为 。(保留3位有效数字)
。(保留3位有效数字)(5)步骤③发生的反应中氧化剂与还原剂的物质的量之比n(氧化剂)∶n(还原剂)

A.
 B.
B. C.
C.
您最近一年使用:0次
2023-09-09更新
|
283次组卷
|
2卷引用:黑龙江省大庆市2023-2024学年高三上学期第一次教学质量检测化学试题
2023高三·全国·专题练习
名校
解题方法
2 . 有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀,消耗xmolH2SO4;另一份滴加AgNO3溶液,使Cl-离子完全沉淀,消耗ymolAgNO3.则原混合溶液中的c(Na+)
A.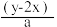 mol·L-1 mol·L-1 | B.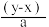 mol·L-1 mol·L-1 |
C.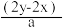 mol·L-1 mol·L-1 | D.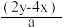 mol·L-1 mol·L-1 |
您最近一年使用:0次
2023高三·全国·专题练习
名校
3 . 下列配制溶液的说法正确的有:①1L水中溶解了5.85gNaCl,所得溶液的物质的量浓度为0.1mol/L;②31gNa2O溶于水得到1L溶液,所得溶液的物质的量浓度为0.5mol/L;③标准状况下,22.4LHCl溶于水配成1L溶液,所得盐酸的物质的量浓度为1mol/L;④从1L0.1mol/LHNO3溶液中取出250mL,剩余溶液中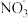 的浓度为0.075mol/L;⑤将25gCuSO4·5H2O晶体溶于75g水中所得溶质的质量分数为16%;⑥将一定量18.4mol/L的硫酸与水等质量混合,所得溶液的浓度大于9.2mol/L
的浓度为0.075mol/L;⑤将25gCuSO4·5H2O晶体溶于75g水中所得溶质的质量分数为16%;⑥将一定量18.4mol/L的硫酸与水等质量混合,所得溶液的浓度大于9.2mol/L
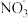 的浓度为0.075mol/L;⑤将25gCuSO4·5H2O晶体溶于75g水中所得溶质的质量分数为16%;⑥将一定量18.4mol/L的硫酸与水等质量混合,所得溶液的浓度大于9.2mol/L
的浓度为0.075mol/L;⑤将25gCuSO4·5H2O晶体溶于75g水中所得溶质的质量分数为16%;⑥将一定量18.4mol/L的硫酸与水等质量混合,所得溶液的浓度大于9.2mol/L| A.①③ | B.④⑥ | C.③⑤ | D.⑤⑥ |
您最近一年使用:0次
4 .  是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备,反应为
是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备,反应为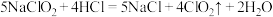 。
。 表示阿伏加德罗常数的值,下列说法中正确的是
表示阿伏加德罗常数的值,下列说法中正确的是
 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备,反应为
是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备,反应为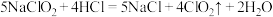 。
。 表示阿伏加德罗常数的值,下列说法中正确的是
表示阿伏加德罗常数的值,下列说法中正确的是A.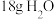 中含有的电子数为 中含有的电子数为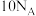 |
B. 固体中含有 固体中含有 个 个 分子 分子 |
C.每生成 ,转移的电子数为 ,转移的电子数为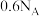 |
D.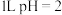 的稀盐酸中含有的 的稀盐酸中含有的 数目为 数目为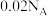 |
您最近一年使用:0次
2023-04-29更新
|
562次组卷
|
3卷引用:辽宁省阜新市2023届高三4月联考化学试题
解题方法
5 . 硫酸锰可为动植物提供微量元素,还可用作工业催化剂等。用 还原
还原 可制备硫酸锰,装置如图所示(夹持装置已省略)。
可制备硫酸锰,装置如图所示(夹持装置已省略)。
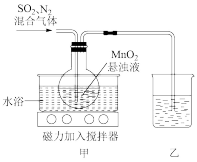
回答下列问题:
(1)实验室中常用70%的浓硫酸和 制备
制备 ,若该制备实验中需70%的浓硫酸49g,则需98%的浓硫酸(浓度为
,若该制备实验中需70%的浓硫酸49g,则需98%的浓硫酸(浓度为 )
)_______ mL(保留一位小数)来配制。这种方法制备 的化学方程式为
的化学方程式为_______ 。
(2)实验中通入 的作用是
的作用是_______ 。
(3)装置甲为制备 的装置,采用水浴加热,而不是采用酒精灯明火加热。相比酒精灯加热,水浴加热的主要优点是
的装置,采用水浴加热,而不是采用酒精灯明火加热。相比酒精灯加热,水浴加热的主要优点是_______ 。
(4)装置甲中 还原
还原 的离子方程式是
的离子方程式是_______ 。
(5)装置乙的作用是防止 逸出对实验者造成毒害,则该装置中的试剂是
逸出对实验者造成毒害,则该装置中的试剂是_______ 。
(6)若检测到制备后的溶液中 ,原因可能是
,原因可能是_______ 。
 还原
还原 可制备硫酸锰,装置如图所示(夹持装置已省略)。
可制备硫酸锰,装置如图所示(夹持装置已省略)。
回答下列问题:
(1)实验室中常用70%的浓硫酸和
 制备
制备 ,若该制备实验中需70%的浓硫酸49g,则需98%的浓硫酸(浓度为
,若该制备实验中需70%的浓硫酸49g,则需98%的浓硫酸(浓度为 )
) 的化学方程式为
的化学方程式为(2)实验中通入
 的作用是
的作用是(3)装置甲为制备
 的装置,采用水浴加热,而不是采用酒精灯明火加热。相比酒精灯加热,水浴加热的主要优点是
的装置,采用水浴加热,而不是采用酒精灯明火加热。相比酒精灯加热,水浴加热的主要优点是(4)装置甲中
 还原
还原 的离子方程式是
的离子方程式是(5)装置乙的作用是防止
 逸出对实验者造成毒害,则该装置中的试剂是
逸出对实验者造成毒害,则该装置中的试剂是(6)若检测到制备后的溶液中
 ,原因可能是
,原因可能是
您最近一年使用:0次
2023-01-14更新
|
134次组卷
|
3卷引用:海南省屯昌县2023届高三二模统考(A)化学试题
名校
解题方法
6 . 下列有关物质的量浓度和质量分数的计算正确的是
| A.98%的浓硫酸的物质的量浓度大于49%的硫酸的物质的量浓度的二倍 |
| B.20%的氢氧化钠溶液和30%的氢氧化钠溶液等体积混合,混合后溶液的溶质质量分数大于25% |
C. , ,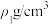 的硫酸溶液与 的硫酸溶液与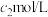 , ,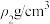 的硫酸溶液等体积混合,得到 的硫酸溶液等体积混合,得到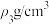 的硫酸溶液的浓度为 的硫酸溶液的浓度为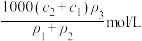 |
D.25℃时 饱和溶液(密度为 饱和溶液(密度为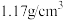 )的物质的量浓度约为5.3mol/L(已知25℃时氯化钠在水中的溶解度为36克) )的物质的量浓度约为5.3mol/L(已知25℃时氯化钠在水中的溶解度为36克) |
您最近一年使用:0次
2022-12-25更新
|
434次组卷
|
2卷引用:重庆缙云教育联盟2023届高三二模考试化学试题
7 . 设NA为阿伏加德罗常数的值,关于反应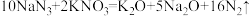 ,下列说法正确的是
,下列说法正确的是
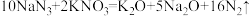 ,下列说法正确的是
,下列说法正确的是A.生成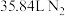 时,转移的电子数为NA 时,转移的电子数为NA |
B.等物质的量的 和 和 中所含阴离子数均为NA 中所含阴离子数均为NA |
| C.当氧化产物比还原产物多7mol时,转移的电子数为5NA |
D.含NA个 的 的 溶解于1L水中,所得溶液中 溶解于1L水中,所得溶液中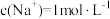 |
您最近一年使用:0次
2022-12-16更新
|
472次组卷
|
7卷引用:四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题
2011·黑龙江·三模
名校
8 . 在80g密度为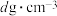 的硫酸铁溶液中,含有2.8g
的硫酸铁溶液中,含有2.8g ,则此溶液中
,则此溶液中 的物质的量浓度数值为
的物质的量浓度数值为
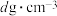 的硫酸铁溶液中,含有2.8g
的硫酸铁溶液中,含有2.8g ,则此溶液中
,则此溶液中 的物质的量浓度数值为
的物质的量浓度数值为A.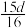 | B.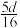 | C.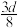 | D.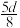 |
您最近一年使用:0次
2022-12-16更新
|
344次组卷
|
19卷引用:2011届黑龙江哈三中高三第三次模拟考试(理综)化学部分
(已下线)2011届黑龙江哈三中高三第三次模拟考试(理综)化学部分(已下线)2014高考名师推荐化学CB计算法(已下线)2013-2014河北石家庄二中上学期10月月考高一化学试卷(已下线)2013-2014河北省石家庄一中上学期开学考试高二化学试卷(已下线)2015届福建省三明一中高三学年度上学期第一次月考化学试卷(已下线)2015届浙江省台州中学高三上学期第一次统练化学试卷(已下线)2015届福建省三明一中高三上学期第一次月考化学试卷(已下线)2013-2014学年河北石家庄二中高一上第一次月考化学试卷2016届江西省靖安中学高三上学期第一次月考化学试卷广西河池市高级中学2017-2018学年高一上学期第一次月考化学试题(已下线)2019年高考化学一轮复习讲练测1.2 物质的量浓度 练山西省忻州市第二中学2019届高三上学期期中考试化学试题(已下线)河北省保定一中2018-2019学年高一上学期期末测试化学试题河南省开封市五县2020-2021学年高一上学期期中联考化学试题河南省滑县实验学校2020-2021学年高一上学期11月半月考试化学试题四川省南充高级中学2017-2018学年高一上学期期中考试化学试题内蒙古呼和浩特市第一中学 2022-2023学 年高一上学期阶段性考试化学试题云南省玉溪市通海县第一中学2022-2023学年高一上学期期中考试化学试题作业(十六) 物质的量浓度的有关计算
9 . 某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐渐加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。请计算:

(1)配制质量分数为10%的氢氧化钠溶液200g,需要氢氧化钠的质量_______ g。
(2)反应至A点时,溶液中钠元素的质量是_______ g。

(1)配制质量分数为10%的氢氧化钠溶液200g,需要氢氧化钠的质量
(2)反应至A点时,溶液中钠元素的质量是
您最近一年使用:0次
名校
解题方法
10 . 海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是
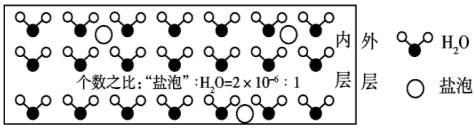

| A.海冰内层“盐泡”越多,密度越小 |
| B.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在 |
C.海冰内层NaCl的浓度约为 (设海冰的密度为0.9 (设海冰的密度为0.9 ) ) |
| D.海冰冰龄越长,内层的“盐泡”越多 |
您最近一年使用:0次
2022-11-26更新
|
626次组卷
|
15卷引用:【市级联考】四川省攀枝花市2019—2020学年高三上学期第一次统考化学试题
【市级联考】四川省攀枝花市2019—2020学年高三上学期第一次统考化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(六)(已下线)2020届超级全能生24省高三9月联考丙(A)卷 理综化学 福建省漳平市第一中学2020届高三上学期第二次月考化学试题江西省宜春市丰城九中2020届高三12月月考化学试题2020届高三化学二轮冲刺新题专练——化学与STSE考查2020届高三《新题速递·化学》12月第01期(考点01-06)2020届高三化学知识点强化训练-----化学与资源开发福建省莆田市仙游县枫亭中学2020届高三上学期第二次月考化学试题山西省芮城市2020届高三3月月考化学试题河北省枣强中学2019-2020学年高三第四次月考化学试题安徽省合肥市第一中学2022-2023学年高三上学期11月月考化学试题(已下线)热点情景汇编-专题九 物质结构与性质(已下线)专题04 电离方程式、电解质溶液的导电性-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)安徽省十校2022-2023学年高一下学期开学摸底联考化学试题



