名校
1 . 下列有关实验原理或操作正确的是( )
| A.用20mL量筒量取15mL 酒精,加水5mL,配制质量分数为75%酒精溶液 |
| B.在200mL 某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属阳离子,不考虑水解问题,则该硫酸盐的物质的量浓度为2.5mol·L−1 |
| C.实验中需用2.0mol·L−1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为 1000mL、201.4g |
| D.实验室配制500mL0.2mol·L−1的硫酸亚铁溶液,其操作是:用天平称15.2g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500mL容量瓶,洗涤、稀释、定容、摇匀 |
您最近一年使用:0次
2019-10-31更新
|
365次组卷
|
4卷引用:吉林省长春市东北师范大学附中2020届高三上学期第一次摸底考试化学试题
吉林省长春市东北师范大学附中2020届高三上学期第一次摸底考试化学试题(已下线)考点20 化学实验基础知识-2020年高考化学命题预测与模拟试题分类精编广东省汕头市潮阳黄图盛中学2021-2022学年高三下学期一模检验化学试题福建省福州第一中学2021届高三下学期开学考试化学试题
名校
2 . 有3.92 g铁的氧化物,用足量的CO在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到7.0 g固体沉淀物,这种铁的氧化物为
| A.Fe3O4 | B.FeO | C.Fe2O3 | D.Fe5O7 |
您最近一年使用:0次
2019-10-27更新
|
244次组卷
|
5卷引用:上海市松江区2017年高考化学二模试卷
上海市松江区2017年高考化学二模试卷上海市松江区2017届高三下学期期中教学质量监控(二模)化学试题上海市进才中学2022-2023学年高一上学期期末考试化学试题(已下线)第14讲 化学反应的计算-【暑假自学课】2023年新高一暑假精品课(苏教版2019)河南省博爱县第一中学2023-2024学年高二上学期9月月考化学试题
3 . KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火。实验室用KClO3和MnO2混合加热制氧气,现取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g (25℃),再加5 g水充分溶解,仍剩余固体4.80g(25℃)。
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为___ g。
(2)若剩余的4.80g固体是MnO2和KCl的混合物。
①求25℃时KCl的溶解度_____ ;
②求原混合物中KClO3的质量_____ ;
③所得KCl溶液的密度为1.72g/cm3,则溶液的物质的量浓度为多少_____ ?(保留2位小数)
(3)工业常利用3Cl2 + 6KOH KClO3 + 5KCl + 3H2O,制取KClO3(混有KClO)。实验室模拟KClO3制备,在热的KOH溶液中通入一定量氯气充分反应后,测定溶液中n(K+):n(Cl-) = 14:11,将所得溶液低温蒸干,那么在得到的固体中KClO3的质量分数的取值范围为多少
KClO3 + 5KCl + 3H2O,制取KClO3(混有KClO)。实验室模拟KClO3制备,在热的KOH溶液中通入一定量氯气充分反应后,测定溶液中n(K+):n(Cl-) = 14:11,将所得溶液低温蒸干,那么在得到的固体中KClO3的质量分数的取值范围为多少_____ ?(用小数表示,保留3位小数)
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为
(2)若剩余的4.80g固体是MnO2和KCl的混合物。
①求25℃时KCl的溶解度
②求原混合物中KClO3的质量
③所得KCl溶液的密度为1.72g/cm3,则溶液的物质的量浓度为多少
(3)工业常利用3Cl2 + 6KOH
 KClO3 + 5KCl + 3H2O,制取KClO3(混有KClO)。实验室模拟KClO3制备,在热的KOH溶液中通入一定量氯气充分反应后,测定溶液中n(K+):n(Cl-) = 14:11,将所得溶液低温蒸干,那么在得到的固体中KClO3的质量分数的取值范围为多少
KClO3 + 5KCl + 3H2O,制取KClO3(混有KClO)。实验室模拟KClO3制备,在热的KOH溶液中通入一定量氯气充分反应后,测定溶液中n(K+):n(Cl-) = 14:11,将所得溶液低温蒸干,那么在得到的固体中KClO3的质量分数的取值范围为多少
您最近一年使用:0次
10-11高一上·湖北·期中
名校
4 . 某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3-,已知其中Na+、K+、Ca2+、NO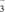 的浓度均为0.1 mol·L-1,则Cl-的物质的量浓度为
的浓度均为0.1 mol·L-1,则Cl-的物质的量浓度为
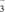 的浓度均为0.1 mol·L-1,则Cl-的物质的量浓度为
的浓度均为0.1 mol·L-1,则Cl-的物质的量浓度为| A.0.1mol·L-1 | B.0.3mol·L-1 | C.0.2mol·L-1 | D.0.4mol·L-1 |
您最近一年使用:0次
2019-10-22更新
|
389次组卷
|
19卷引用:2016届江西省宜春市樟树市高三五模化学试卷
2016届江西省宜春市樟树市高三五模化学试卷(已下线)2010年湖北省襄樊市四校联考高一上学期期中考试化学试题(已下线)2012-2013学年安徽六安新安中学高一上学期期中考试化学试卷陕西省韩城市象山中学2017-2018学年高一第一次月考化学试题北京市衡中清大教育集团2017-2018学年高一上学期第二次月考化学试题江苏省盘湾中学、陈洋中学2017-2018学年高一上学期期中联考化学试题【校级联考】四川省蓉城名校联盟2018-2019学年高一上学期期中联考化学试题湖南省茶陵县第三中学2018-2019学年高一上学期第三次月考化学试题四川省遂宁市遂宁中学外国语实验学校2018-2019学年高一上学期第二学段考试化学试题湖北省仙桃市汉江中学2017-2018学年高一上学期期末考试化学试题山西省运城市芮城县2018-2019学年高一上学期期末考试化学试题【全国百强校】内蒙古自治区乌兰察布市集宁区第一中学2018-2019学年高一上学期期末考试化学试题湖南省衡阳县第四中学2020届高三366班(实验班)8月月考化学试题陕西省咸阳市兴平西郊高级中学2019-2020高一上学期第一次月考化学试题吉林省吉林地区普通高中友好学校联合体第三十一届2019-2020学年高一上学期期中考试化学试题广东省深圳市红岭中学2019-2020学年高一上学期第一学段检测化学试题安徽省合肥市一六八中2017-2018学年高一上学期期中考试化学试题四川省成都市蒲江县蒲江中学2019-2020学年高一上学期10月月考化学试题江苏省常州市第一中学2021-2022学年高一上学期期中考试化学试题
名校
5 . 某溶液X含有H+、Al3+、NH4+、Fe2+、Fe3+、HCO3-、S2-、SO42-、Cl-、OH-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下:
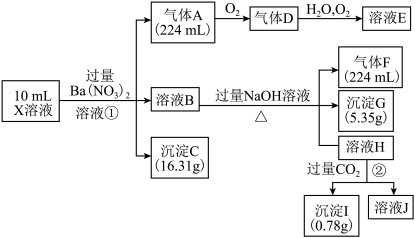
(1)通过上述实验过程,一定不存在的离子是_______ 。
(2)反应①中生成A的离子方程式为________ 。
(3)若测得X溶液中c(H+)=6mol·L-1,则X溶液中_______ (填“含”或“不含”)Fe3+,c(Fe3+)=________ mol·L-1(若填不含,则不需计算),X溶液中c(Cl-)=_______ mol·L-1。

(1)通过上述实验过程,一定不存在的离子是
(2)反应①中生成A的离子方程式为
(3)若测得X溶液中c(H+)=6mol·L-1,则X溶液中
您最近一年使用:0次
2019-10-16更新
|
431次组卷
|
4卷引用:2019年湖北省黄冈市高三11月新高考备考监测联考化学试题
2019年湖北省黄冈市高三11月新高考备考监测联考化学试题山东省临沂市第一中学2020届高三10月月考化学试题山东省新高考备考监测2020届高三10月联考化学试题(已下线)第三单元 物质的性质与转化(基础过关)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)
名校
6 . 已知某饱和NaCl溶液的体积为VmL,密度为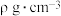 ,质量分数为w%,溶液中含NaCl的质量为m g。则下列表达式正确的是
,质量分数为w%,溶液中含NaCl的质量为m g。则下列表达式正确的是
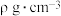 ,质量分数为w%,溶液中含NaCl的质量为m g。则下列表达式正确的是
,质量分数为w%,溶液中含NaCl的质量为m g。则下列表达式正确的是A. | B. |
C.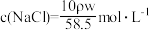 | D.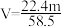 |
您最近一年使用:0次
2019-10-12更新
|
316次组卷
|
5卷引用:2019年陕西省安康市高三第一次调研考试化学试题
2019年陕西省安康市高三第一次调研考试化学试题河南省豫北重点中学2017-2018学年高一10月联考化学试题河北省定州中学2017-2018学年高一(承智班)下学期开学考试化学试题(已下线)小题必刷11 物质的量浓度与溶液的配制——2021年高考化学一轮复习小题必刷(通用版)陕西省宝鸡市渭滨中学2021-2022学年高一上学期第一次月考化学试题
名校
7 . 下列表述正确的是
| A.22.4LHCl溶于水制得1L盐酸时,其浓度为1 mol•L-1 |
| B.1L0.3mol•L-1的CuCl2溶液中含有Cu2+和Cl-的总物质的量为0.9mol |
| C.在K2SO4和NaCl的中性混合水溶液中,如果c(Na+)=c(SO42-),则c(K+)=c(Cl-) |
| D.10℃时,100mLKCl饱和溶液蒸发掉5g水,冷却到10℃时,它仍为饱和溶液 |
您最近一年使用:0次
2019-10-12更新
|
208次组卷
|
3卷引用:2019年陕西省安康市高三第一次调研考试化学试题
2011·山西晋中·一模
名校
8 . 实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是
| A.1000mL,212.0g | B.950mL,543.4g | C.任意规格,572g | D.500mL,286g |
您最近一年使用:0次
2019-07-08更新
|
103次组卷
|
6卷引用:2011届山西省介休十中高三下学期第一次模拟考试化学试卷
(已下线)2011届山西省介休十中高三下学期第一次模拟考试化学试卷辽宁省大连市第四十八中学2019届高三年级5月模拟考试化学试题甘肃省永昌四中2019-2020学年高一上学期期末考试化学试题湖南省长沙市长沙六中2020届高三上学期第一次月考化学试题(已下线)2.2.2 溶液的配制与分析(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)宁夏海原第一中学2021-2022学年高一上学期第一次月考化学试题
名校
9 . 氯化亚铜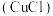 是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成
是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成 。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
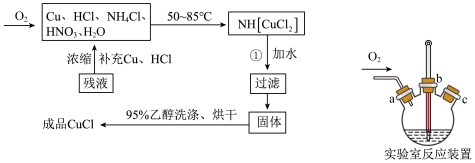
实验药品:铜丝 、氯化铵
、氯化铵 、65%硝酸
、65%硝酸 、20%盐酸
、20%盐酸 、水。
、水。
(1)质量分数为20%的盐酸密度为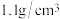 ,物质的量浓度为
,物质的量浓度为______ ;用浓盐酸配制20%盐酸需要的玻璃仪器有:______ 、烧杯、玻璃棒、胶头滴管。
(2)实验室制备 过程如下:
过程如下:
①检查装置气密性,向三颈瓶中加入铜丝、氢化铵、硝酸、盐酸,关闭 。实验开始时,温度计显示反应液温度低于室温,主要原因是
。实验开始时,温度计显示反应液温度低于室温,主要原因是______ ;
②加热至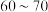 ℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开
℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开 ,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭
,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭 ,冷却至室温,制得
,冷却至室温,制得 。通入氧气的目的为
。通入氧气的目的为______ ;
三颈瓶中生成 的总的离子方程为
的总的离子方程为______ ;
将液体转移至烧杯中用足量蒸馏水稀释,产生白色沉淀,过滤得氧化亚铜粗品和滤液。
③粗品用95%乙醇洗涤、烘干得氧化亚铜。
(3)便于观察和控制产生 的速率,制备氧气的装置最好运用
的速率,制备氧气的装置最好运用______ (填字母)。
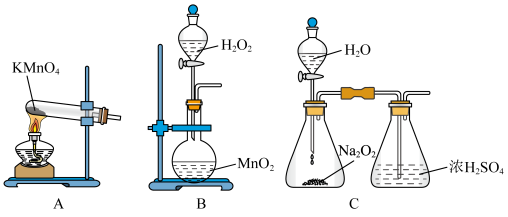
(4)下列说法不正确的是______
A.步骤Ⅰ中 可以省去,因为已经加入了
可以省去,因为已经加入了
B.步骤Ⅱ用去氧水稀释,目的是使 转化为
转化为 ,同时防止
,同时防止 被氧化
被氧化
C.当三颈烧瓶上方不出现红棕色气体时,可停止通入氧气
D.流程中可循环利用的物质只有氯化铵
(5)步骤Ⅲ用95%乙醇代替蒸馏水洗涤的主要目的是______ 、______ (答出两条)。
(6)氯化亚铜的定量分析:
①称取样品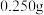 和
和 过量的
过量的 溶液于
溶液于 锥形瓶中,充分溶解;
锥形瓶中,充分溶解;
②用 硫酸[Ce(SO4)2]标准溶液测定。已知:
硫酸[Ce(SO4)2]标准溶液测定。已知:
已知:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
则样品中 的纯度为
的纯度为______ (结果保留3位有效数字)。
误差分析:下列操作会使滴定结果偏高的是______ 。
A.锥形瓶中有少量蒸馏水 B.滴定终点读数时仰视滴定管刻度线
C.所取 溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
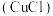 是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成
是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成 。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
实验药品:铜丝
 、氯化铵
、氯化铵 、65%硝酸
、65%硝酸 、20%盐酸
、20%盐酸 、水。
、水。(1)质量分数为20%的盐酸密度为
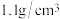 ,物质的量浓度为
,物质的量浓度为(2)实验室制备
 过程如下:
过程如下:①检查装置气密性,向三颈瓶中加入铜丝、氢化铵、硝酸、盐酸,关闭
 。实验开始时,温度计显示反应液温度低于室温,主要原因是
。实验开始时,温度计显示反应液温度低于室温,主要原因是②加热至
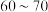 ℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开
℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开 ,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭
,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭 ,冷却至室温,制得
,冷却至室温,制得 。通入氧气的目的为
。通入氧气的目的为三颈瓶中生成
 的总的离子方程为
的总的离子方程为将液体转移至烧杯中用足量蒸馏水稀释,产生白色沉淀,过滤得氧化亚铜粗品和滤液。
③粗品用95%乙醇洗涤、烘干得氧化亚铜。
(3)便于观察和控制产生
 的速率,制备氧气的装置最好运用
的速率,制备氧气的装置最好运用
(4)下列说法不正确的是
A.步骤Ⅰ中
 可以省去,因为已经加入了
可以省去,因为已经加入了
B.步骤Ⅱ用去氧水稀释,目的是使
 转化为
转化为 ,同时防止
,同时防止 被氧化
被氧化C.当三颈烧瓶上方不出现红棕色气体时,可停止通入氧气
D.流程中可循环利用的物质只有氯化铵
(5)步骤Ⅲ用95%乙醇代替蒸馏水洗涤的主要目的是
(6)氯化亚铜的定量分析:
①称取样品
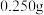 和
和 过量的
过量的 溶液于
溶液于 锥形瓶中,充分溶解;
锥形瓶中,充分溶解;②用
 硫酸[Ce(SO4)2]标准溶液测定。已知:
硫酸[Ce(SO4)2]标准溶液测定。已知:已知:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
| 平衡实验次数 | 1 | 2 | 3 |
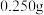 样品消耗硫酸锑标准溶液的体积 样品消耗硫酸锑标准溶液的体积 | 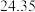 | 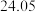 2 2 | 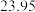 |
则样品中
 的纯度为
的纯度为误差分析:下列操作会使滴定结果偏高的是
A.锥形瓶中有少量蒸馏水 B.滴定终点读数时仰视滴定管刻度线
C.所取
 溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
您最近一年使用:0次
名校
10 . 设NA表示阿伏加 德罗常数的值。下列说法正确的是
| A.60 g丙醇中含有的共价键数目为10NA |
| B.过氧化钠与水反应生成0.l mol O2时,转移的电子数为0.2 NA |
| C.0.l mol•L-1碳酸钠溶液中阴离子总数大于0.1 NA |
| D.密闭容器中,1 mol N2与3mol H2反应制备NH3,产生N—H键的数目为6 NA个 |
您最近一年使用:0次
2019-05-28更新
|
536次组卷
|
4卷引用:【区级联考】湖北省武汉市武昌区2019届高三下学期五月调研考试理科综合化学试题
【区级联考】湖北省武汉市武昌区2019届高三下学期五月调研考试理科综合化学试题(已下线)专题1.1 物质的量 气体摩尔体积(练)-《2020年高考一轮复习讲练测》新疆维吾尔自治区新源县第二中学2020届高三上学期9月月考化学试题湖北省应城市第一高级中学2022-2023学年高三上学期8月热身考试化学试题



