名校
1 . 肼 是一种应用广泛的化工原料,可用作火箭和燃料电池的燃料。实验室制取肼的化学方程式为:
是一种应用广泛的化工原料,可用作火箭和燃料电池的燃料。实验室制取肼的化学方程式为: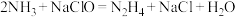 。已知
。已知 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 是一种应用广泛的化工原料,可用作火箭和燃料电池的燃料。实验室制取肼的化学方程式为:
是一种应用广泛的化工原料,可用作火箭和燃料电池的燃料。实验室制取肼的化学方程式为: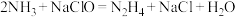 。已知
。已知 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.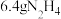 分子中含有的电子数为 分子中含有的电子数为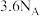 |
B.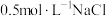 溶液中含有的氯原子数为 溶液中含有的氯原子数为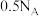 |
C.每消耗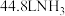 ,理论上转移电子数为 ,理论上转移电子数为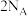 |
D.标准状况下,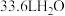 含有水分子数为 含有水分子数为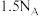 |
您最近一年使用:0次
2024-03-19更新
|
184次组卷
|
3卷引用:2024届重庆市第八中学校高三下学期模拟预测化学试题(四)
名校
解题方法
2 . 微观探析是认识物质的一种途径。设 为阿伏加德罗常数,下列有关说法正确的是
为阿伏加德罗常数,下列有关说法正确的是
 为阿伏加德罗常数,下列有关说法正确的是
为阿伏加德罗常数,下列有关说法正确的是A.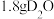 中含有的中子数目为 中含有的中子数目为 |
B.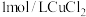 溶液中含有 溶液中含有 的数目小于 的数目小于 |
C.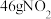 与 与 的混合物中含有的分子数为 的混合物中含有的分子数为 |
D.25℃,101kPa, 与NaOH溶液完全反应,转移电子数目为 与NaOH溶液完全反应,转移电子数目为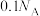 |
您最近一年使用:0次
2024-03-06更新
|
899次组卷
|
4卷引用:2024届广东省汕头市高三下学期一模化学试题
3 . 某兴趣小组通过下列实验探究 与
与 的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
(1)探究 与
与 的氧化性强弱
的氧化性强弱
【实验 】将
】将 溶液和
溶液和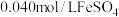 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
)等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
_____  (填“>”“<”)。
(填“>”“<”)。
(2)验证反应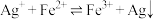 是可逆反应
是可逆反应
【实验Ⅱ】
①取实验 反应后的上层清液或沉淀进行实验,将表格补充完整。
反应后的上层清液或沉淀进行实验,将表格补充完整。
②根据实验数据,证明该反应为可逆反应,不需要完成表格中编号_____ 的实验。
(3)测定反应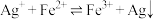 的平衡常数
的平衡常数
测定方案:通过氧化还原滴定法可测定平衡时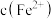 ,再根据实验
,再根据实验 反应物浓度数据计算得出
反应物浓度数据计算得出 和
和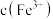 ,进而求算出平衡常数
,进而求算出平衡常数 。
。
【实验Ⅲ】室温下,待实验Ⅰ中反应达到平衡状态时,取 上层清液,用
上层清液,用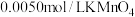 标准溶液滴定
标准溶液滴定 ,达到滴定终点记录消耗
,达到滴定终点记录消耗 标准溶液的体积。重复实验3次,平均消耗
标准溶液的体积。重复实验3次,平均消耗 标准溶液的体积为
标准溶液的体积为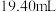 。
。
①用于盛装 标准溶液进行滴定的玻璃仪器名称为
标准溶液进行滴定的玻璃仪器名称为_____ 。
②平衡时
_____  ,平衡常数
,平衡常数
_____ 。
③若取实验 反应后的含
反应后的含 浊液进行实验Ⅱ,会使测得的平衡常数
浊液进行实验Ⅱ,会使测得的平衡常数 值
值_____ 。
A.偏大 B.偏小 C.无影响 D.无法判断
 与
与 的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。(1)探究
 与
与 的氧化性强弱
的氧化性强弱【实验
 】将
】将 溶液和
溶液和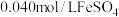 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
)等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
 (填“>”“<”)。
(填“>”“<”)。(2)验证反应
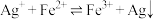 是可逆反应
是可逆反应【实验Ⅱ】
①取实验
 反应后的上层清液或沉淀进行实验,将表格补充完整。
反应后的上层清液或沉淀进行实验,将表格补充完整。| 实验编号 | 操作及现象 | 结论 |
| 1 | 取上层黄色清液,滴加 | 存在 |
| 2 | 取少量灰黑色沉淀,滴加浓硝酸,沉淀溶解,出现红棕色气体 | 存在 |
| 3 | 操作及现象是: | 存在 |
| 4 | 取上层清液,滴加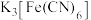 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
(3)测定反应
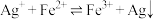 的平衡常数
的平衡常数测定方案:通过氧化还原滴定法可测定平衡时
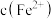 ,再根据实验
,再根据实验 反应物浓度数据计算得出
反应物浓度数据计算得出 和
和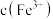 ,进而求算出平衡常数
,进而求算出平衡常数 。
。【实验Ⅲ】室温下,待实验Ⅰ中反应达到平衡状态时,取
 上层清液,用
上层清液,用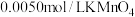 标准溶液滴定
标准溶液滴定 ,达到滴定终点记录消耗
,达到滴定终点记录消耗 标准溶液的体积。重复实验3次,平均消耗
标准溶液的体积。重复实验3次,平均消耗 标准溶液的体积为
标准溶液的体积为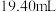 。
。①用于盛装
 标准溶液进行滴定的玻璃仪器名称为
标准溶液进行滴定的玻璃仪器名称为②平衡时

 ,平衡常数
,平衡常数
③若取实验
 反应后的含
反应后的含 浊液进行实验Ⅱ,会使测得的平衡常数
浊液进行实验Ⅱ,会使测得的平衡常数 值
值A.偏大 B.偏小 C.无影响 D.无法判断
您最近一年使用:0次
名校
4 . 将Na2CO3和NaHCO3的混合物3.27 g加热到质量不再减轻时,测得残留固体2.65 g。另取相同质量的此混合物固体,跟 100 mL某浓度的盐酸刚好完全反应生成NaCl,求;
(1)此混合物中NaHCO3与Na2CO3的物质的量之比为______________ ;
(2)所用盐酸的物质的量浓度为______________ ;
(3)生成CO2在标准状况下的体积为______________ 。
(1)此混合物中NaHCO3与Na2CO3的物质的量之比为
(2)所用盐酸的物质的量浓度为
(3)生成CO2在标准状况下的体积为
您最近一年使用:0次
2024-01-10更新
|
144次组卷
|
2卷引用:2024届浙江省舟山中学高三下学期模拟预测化学试题
名校
5 . 工业烟气含有 ,可以用
,可以用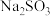 溶液进行绿色化处理后再排放。设
溶液进行绿色化处理后再排放。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 ,可以用
,可以用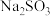 溶液进行绿色化处理后再排放。设
溶液进行绿色化处理后再排放。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.6.4 g  含有的电子数目为0.3 含有的电子数目为0.3 |
B.1 L 1  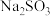 溶液中 溶液中 的数目为2 的数目为2 |
C.22.4 L (标准状况)与足量氧气反应,转移电子数目为2 (标准状况)与足量氧气反应,转移电子数目为2 |
D.1 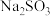 溶液最多能吸收 溶液最多能吸收 的数目为0.1 的数目为0.1 |
您最近一年使用:0次
2023-02-27更新
|
1552次组卷
|
7卷引用:黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试卷(二)
6 . 设NA为阿伏加德罗常数的值,关于反应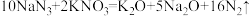 ,下列说法正确的是
,下列说法正确的是
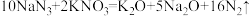 ,下列说法正确的是
,下列说法正确的是A.生成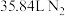 时,转移的电子数为NA 时,转移的电子数为NA |
B.等物质的量的 和 和 中所含阴离子数均为NA 中所含阴离子数均为NA |
| C.当氧化产物比还原产物多7mol时,转移的电子数为5NA |
D.含NA个 的 的 溶解于1L水中,所得溶液中 溶解于1L水中,所得溶液中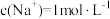 |
您最近一年使用:0次
2022-12-16更新
|
472次组卷
|
7卷引用:2024届河南省焦作市博爱县第一中学高三一模化学试题
名校
解题方法
7 . 1 mol/L 的FeCl3溶液中Cl-浓度为
| A.1 mol/L | B.1 mol | C.3 mol/L | D.3 L/mol |
您最近一年使用:0次
2022-01-05更新
|
617次组卷
|
6卷引用:2024届江苏省苏州市南京航空航天大学苏州附属中学高三上学期二模化学试题
8 . NA表示阿伏加 德罗常数的值。下列叙述正确的是( )
| A.在0.1mol·L-1的Na2CO3溶液中,阴离子总数一定大于0.1NA |
| B.常温常压下,由32gO2与O3组成的混合气体中含有的分子总数小于NA |
| C.36.0gCaO2与足量水完全反应,转移的电子数为NA |
| D.1molCH4与1molCl2混合,充分反应后,生成气体分子数为NA |
您最近一年使用:0次
2020-06-28更新
|
194次组卷
|
2卷引用:2024届四川省雅安市神州天立学校高三下学期高考冲刺考试理科综合试题-高中化学
名校
解题方法
9 . 下列叙述正确的是
| A.将5.85 g NaCl晶体溶入100 mL水中,制得0.1 mol/L的NaCl溶液 |
| B.将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol/L |
C.将w g a%的NaCl饱和溶液蒸发掉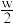 g水,得到2a%的NaCl溶液 g水,得到2a%的NaCl溶液 |
| D.将1体积c1 mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1 mol/L |
您最近一年使用:0次
2020-03-05更新
|
124次组卷
|
2卷引用:2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题



